- ADVIEZEN COMMISSIE OOM
OOM
Pembrolizumab bij endemisch Kaposi
Op basis van de verwachte patentduur van pembrolizumab heeft cieOOM een uitspraak gedaan over de off-label indicatie van pembrolizumab voor het endemisch of klassiek Kaposi sarcoom. Op basis van de resultaten van kleine studies voldoet pembrolizumab aan de NRS-criteria en ondersteunt cieOOM deze aanvraag.
Ipilimumab en nivolumab bij endemisch Kaposi
Goed uitgevoerde en gedocumenteerde studie met homogene sterk geselecteerde CKS-populatie.
Geen subgroep die meer of minder benefit lijkt te hebben.
Gezien zeldzaamheid (0,02-1,6/100.000, extreme rare) en evidente effectiviteit in single arm-studie is deze combinatiebehandeling met deze resultaten voldoende voor een positief oordeel voor off label toepassing voor CKS, met een DoR ruim boven de PASKWIL NRS-criteria.
Lokaal gevorderd colorectaal carcinoom
De vraagstelling bij de aangeleverde dossiers is duidelijk gedefinieerd als een mogelijke plaats voor CAPOX/FOLFOX als INDUCTIE behandeling bij gevorderd CRC. Semantisch moet bij een dergelijke aanvraag gesteld worden dat er sprake is van dusdanig lokaal gevorderde ziekte dat deze als primair niet in opzet curatief resectabel wordt geduid.
Het is duidelijk dat er in bovengenoemde situatie een plaats voor chemotherapie bestaat, waarbij het bijvoorbeeld opvallend is dat capecitabine wel een registratie heeft voor de behandeling van lokaal gevorderd mammacarcinoom maar niet voor het lokaal gevorderd colorectaal carcinoom.
De bijgevoegde literatuur bij deze aanvraag beantwoordt de vraag van de plaats van neoadjuvante behandeling met chemotherapie bij gevorderd maar resectabel colorectaal carcinoom. Er kan gesteld worden dat op basis van tumorbiologische afwegingen er een plaats kan zijn voor chemotherapie die perioperatief wordt gegeven in plaats van alleen postoperatief (indien dit laatste geïndiceerd is), waarbij er op basis van klinische afwegingen conform PASKWIL-criteria geen uitspraak kan worden gedaan over de daadwerkelijk (toegevoegde) waarde van deze behandeling.
Wanneer de resultaten van beide aangeleverde (neo)adjuvante dan wel inductiestudies worden afgezet tegen de huidige adjuvante PASKWIL-criteria zijn de data van de FOXTROT-studie met een verschil in DFS op T=2 jaar (16,9 vs 21,5%, HR 0,72) niet beoordeelbaar (er is geen gekwantificeerde data op T=3 jaar) en was de studie niet gepowered om een verschil in OS aan te tonen.
De resultaten van de OPTICAL-studie tonen na een mediane follow-up van 48 maanden een niet significant verschil in DFS na 3 jaar van minder dan 5% met een bijpassende HR van 0,74. Deze data voldoen niet aan de criteria voor een voorlopig positief advies volgens de huidige adjuvante PASKWIL-criteria.
Resumerend kan cieOOM op basis van de aangeleverde data de aanvraag voor de indicatie INDUCTIE dan wel neoadjuvante behandeling CAPOX/FOLFOX voor lokaal gevorderd colorectaal carcinoom niet beoordelen.
Brigatinib bij NF2-tumoren
De hier besproken niet gerandomiseerde (basket)studie met brigatinib in NF2-gerelateerde tumoren toont resultaten die niet voldoen aan de huidige PASKWIL-criteria voor dergelijke studies. Er ontbreekt tevens een biologische rationale voor de toepassing van brigatinib bij deze indicaties. Deze overwegingen ondersteunen dus niet de aanvraag voor een off label add-on. Tot slot is de patentduur (2035?) langer dan de 2 jaar waarbinnen de CieOOM momenteel kan beoordelen.
NICHE-studie MSI high coloncarcinoom
Deze single arm fase 2-studie van Chalabi et al. laat zoals bekend indrukwekkende resultaten bij de subgroep van coloncarcinoompatiënten met een MSI-tumor zien.
Het betreft neoadjuvante behandeling bij resectabele tumoren, waarbij onduidelijk is wat de pathologische stadiëring zou zijn bij primair resectie. Ook is er geen data over het natuurlijk beloop na alleen resectie, omdat de studie geen controlegroep heeft. Tevens betreft het weliswaar een zeldzame indicatie, maar blijken er wel gerandomiseerde studies te worden gedaan bij dMMR/MSI coloncarcinoom, zodat ook de vraag kan zijn of een single arm-studie voldoende is om tot een advies te komen.
Tijdens de vergadering komen we tot de conclusie dat de cieOOM, net als de cieBOM, geen criteria heeft waarmee we deze resultaten kunnen beoordelen.
Dit onderwerp betreffende het ontbreken van neo-adjuvante beoordelingscriteria heeft de aandacht van cieBOM, we zullen dit nogmaals agenderen in het bestuurlijk overleg binnen de NVMO.
FOLFOXIRI totale neoadjuvante behandeling rectumcarcinoom
De aangeleverde studies geven geen antwoord op de vraag wat de toegevoegde waarde van chemotherapie met CAPOX of FOLFOX binnen totale neaoadjuvante therapie voor het rectumcarcinoom is, waardoor deze aanvraag niet door cieOOM is te beoordelen.
De opzet van de UNICANCER-PRODIGE 23-studie raakt meer aan de vraag wat de toegevoegde waarde van chemotherapie aan een (in beide armen van de studie) vergelijkbaar chemoradiotherapie schema is, en laat met voldoende follow-up duur een significant effect zien op het secundaire eindpunt OS. Omdat echter in deze studie alle patiënten na de rectumresectie adjuvant chemotherapie ontvingen, hetgeen in Nederland geen staande praktijk is, kunnen de resultaten van deze studie niet voor de Nederlandse situatie worden geïnterpreteerd.
CAPOX FOLFOX totale neoadjuvante behandeling rectumcarcinoom
De aangeleverde studies geven geen antwoord op de vraag naar de toegevoegde waarde van chemotherapie met CAPOX of FOLFOX binnen totale neaoadjuvante therapie voor het rectumcarcinoom, waardoor deze aanvraag niet door cieOOM is te beoordelen
Gepegyleerd liposomaal doxorubicine bij klassiek endemisch Kaposi
Er is geen rationale waarom AIDS related KS anders op systemische behandeling zou reageren CKS. Er is zeer beperkte data voorhanden voor de groep CKS. Op basis van tumorbiologie is het echter aannemelijk dat de effectiviteit van liposomaal doxorubicine bij AIDS geassocieerd KS vergelijkbaar zal zijn die bij CKS. Daarom formuleert cieOOM een positief advies voor off-label vergoeding.
Carboplatin bij cabazitaxel prostaatcarcinoom
De studie van Van der Zande et al. betreft een retrospectieve cohort analyse met 45 patiënten. Klinische relevantie van het primaire eindpunt PSA-respons is discutabel. Significante PSA-respons 26,6%, PFS was bij 25 patiënten evalueerbaar: 2 maanden. Het effect lijkt niet afhankelijk van klinische kenmerken van aggressive variant of prostate cancer of tumoren met een specifiek moleculair profiel. Er is geen subgroep gedetecteerd die meer winst zou kunnen hebben van combinatiebehandeling.
In de discussie van het artikel van Van der Zande wordt de Fase 1-2 studie van Corn et al. aangehaald. In deze fase I-II studie werden 160 mCRPC patiënten gerandomiseerd tussen cabazitaxel mono en cabazitaxel+carboplatin. Primair eindpunt was: “investigator-assessed progression-free survival”
At a median follow-up of 31·0 months (IQR 20·5-37·1), the combination improved the median progression-free survival from 4·5 months (95% CI 3·5-5·7) to 7·3 months (95% CI 5·5-8·2; hazard ratio 0·69, 95% CI 0·50-0·95, p=0·018).
Median overall survival was 17·3 months (95% CI 13·8–21·9) with cabazitaxel versus 18·5 months (16·7–21·9) with the combination (HR 0·89, 95% CI 0·63–1·25, p=0·50; figure 2B).
More patients treated with cabazitaxel plus carboplatin experienced grade 3 and 4 toxicities than those treated with cabazitaxel alone, but adverse events leading to treatment discontinuation were similarly low between the two groups.
Post hoc-analyse (exploratief) suggereert meer winst bij agressieve varianten van prostaatcarcinoom.
Deze studie van Corn et al. zou in principe wel door cieBOM beoordeeld kunnen worden, maar voldoet niet aan de huidige PASKWIL-criteria voor studies waarin mOS in controlegroep >12mndn is. PFS winst zou >16wkn moeten zijn met HR<0,70. Alles bij elkaar zijn er onvoldoende data die een offlabel-aanvraag voor de combinatie cabazitaxel/carboplatin ondersteunen.
Cyclofsfamide en vincristine i.c.m. dacarbazine bij feochromocytoom of paraganglioom
Akkoord voor te dragen voor add-on van cyclofosfamide in combinatie met vincristine en dacarbazine voor de behandeling van gemetastaseerd paraganglioom danwel feochromocytoom.
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum: 26-9-2023
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum: 26-09-2023
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee gezien zeldzaamheid
Waar hoort beoordeling thuis:
- Zeldzame indicatie/NRS
Huidige standaard: de behandeling die we nu bespreken: CVD
Huidige indicatietekst:
Cyclofosfamide
Solide tumoren:
- Gemetastaseerd ovariumcarcinoom, mammacarcinoom, kleincellig bronchuscarcinoom en Ewingsarcoom;
- Als adjuvante behandeling bij mammacarcinoom en kleincellig bronchuscarcinoom;
- Als inductie- en consolidatiebehandeling bij gevorderd of gemetastaseerd neuroblastoom.
Einddatum patent: reeds verstreken
Zeldzame indicatie/NRS
Tumortype en behandellijn
Gevorderd/ gemetastaseerd paraganglioom, 1e lijn palliatief
Medicament/middelen
Cyclofosfamide in combinatie met vincristine en dacarbazine (CVD)
Indicatie (EMA) en huidige indicatietekst (op farmatec)
- Gemetastaseerd ovariumcarcinoom, mammacarcinoom, kleincellig bronchuscarcinoom en Ewingsarcoom;
- Als adjuvante behandeling bij mammacarcinoom en kleincellig bronchuscarcinoom;
- Als inductie- en consolidatiebehandeling bij gevorderd of gemetastaseerd neuroblastoom.
Korte bespreking van de studie(s)
Zeldzame ziekte en in de studies worden patienten met maligne paraganglioom en feochromocytoom bij elkaar genomen
Averbuch
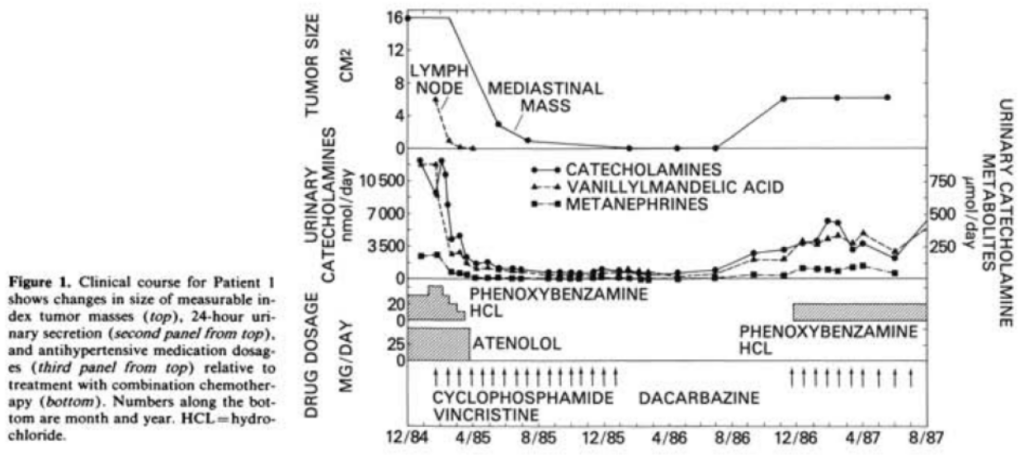
Nonrandomized, single-arm trial. N=14. After optimization of antihypertensive therapy, patients received cyclophosphamide, 750 mg/m2 body surface area on day 1; vincristine, 1.4 mg/m2 on day 1, and dacarbazine, 600 mg/m2 on days 1 and 2, every 21 days.
Combination chemotherapy with cyclophosphamide, vincristine, and dacarbazine produced a complete and partial response rate of 57% (median duration, 21 months; range, 7 to more than 34).
NB “partial response” is afname van > 50%; “minimal” response is 25-50% afname
CR= 2 (14%)
PR= 6 (43%)
Minimal response= 3 (21%)
SD= 2 (14%); PD= 1 (7%)
Complete and partial biochemical responses were seen in 79% of patients (median duration, more than 22 months; range, 6 to more than 35). All responding patients had objective improvement in performance status and blood pressure.
Toxicity included expected hematologic, neurologic, and gastrointestinal effects of chemotherapy without serious sequelae. There were four minor hypotensive episodes and one minor hypertensive episode. Three patients had nadir leukocyte counts below 1 X 10VL; however, there were no episodes of neutropenic fever requiring hospitalization. Four patients had nadir platelet counts below 50 X 10VL, and one patient was hospitalized for a minor hemorrhage associated with thrombocytopenia. (> dus 3x leukopenie graad 4; 4x graad 3 trombopenie en 1x SAE)
Together, neurologic and gastrointestinal toxicity was dose-limiting in only three patients.
Analysis by standard actuarial methods shows that the probability of freedom from progression from initiation of chemotherapy was 50% at 22 months, and plateaued at 35.7% at 23 months with five subsequent censored observations to a maximum follow-up of more than 36 months. Median survival from the time of surgical diagnosis was not reached with a 51.4% plateau at 65 months including four subsequent censored observations to a maximum follow-up of more than 108 months.
Huang
Studie uit hetzelfde centrum (Bethesda), waarin de N=14 van Averbuch meegenomen zijn (dus overlap)
The study design was a nonrandomized, single-arm trial conducted at a government medical referral center. Eighteen patients with metastatic malignant pheochromocytoma/paraganglioma were studied. After controlling symptoms of catecholamine excess, patients were treated with cyclophosphamide at 750 mg/m(2), vincristine at 1.4 mg/m(2), and dacarbazine at 600 mg/m(2) on Day 1 and dacarbazine at 600 mg/m(2) on Day 2, every 21 to 28 days.
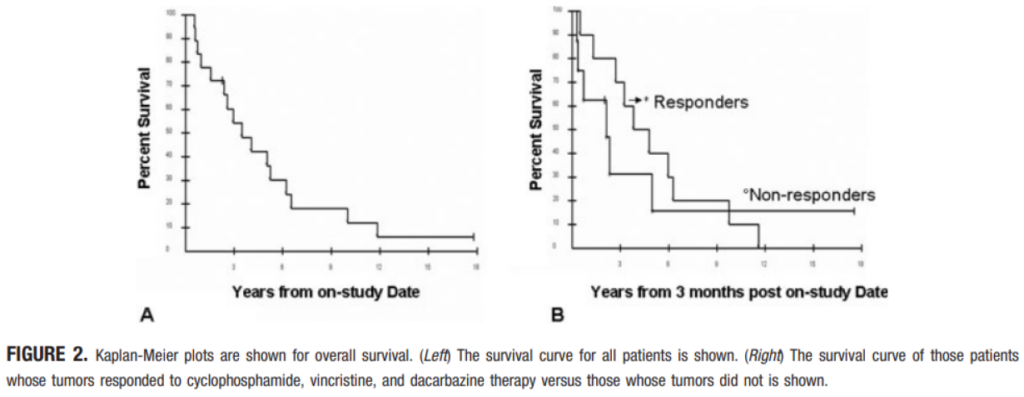
Combination chemotherapy with CVD produced a complete response rate of 11% (2 pts) and a partial response rate of 44% (8 pts). The median duration of response is 20 months. CVD was well tolerated with only grade I/II toxicities. Patients whose tumors were scored as complete or partial response received a mean of 27.4 cycles of CVD and a median of 23.
Side effects occurred without significant sequelae and were generally not dose limiting, except in 2 patients in whom vincristine was discontinued after 3 and 25 cycles because of peripheral neuropathy.
Median survival from the landmark date (3 months after starting chemotherapy) is 3.8 years for patients whose tumors had a complete or partial response to chemotherapy and 1.8 years for the rest. The 2-tailed logrank P value for the comparison of the 2 curves, according to response category, is .65.
Niemeyer
Pooled analysis N= 50 waaronder Huang et al en een andere studie waarbij 40% geen afstandsmetastasen had
A meta-analysis of the effect of chemotherapy on tumour volume showed pooled percentages of complete response, partial response and stable disease of, respectively, 4% (95% CI: 1%-15%), 37%(95% CI: 25%-51%) and 14% (95% CI: 7%-27%). Only two studies concerning a total of 35 patients assessed the response on catecholamine excess; pooled percentages for complete, partial and stable hormonal response were 14% (95% CI: 6%-30%), 40% (95% CI: 25%-57%) and 20% (95% CI: 10%-36%), respectively. Duration of response was also reported in only two studies with a median duration of response of 20 months and 40 months.
Retrospectieve studies zijn buiten beschouwing gelaten
Case seris < 4 pts zijn buiten beschouwing gelaten, zo ook Keizer et al Treatment of malignant pheochromocytoma with combination chemotherapy. Hypertension 1985 May-Jun;7(3 Pt 2):I18-24.
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja
Effectiviteit
Bijwerkingen (totaal/gerelateerd aan de behandeling)

Kwaliteit van leven

Beperkingen van de studie
Het gaat om een zeldzame ziekte die bekend staat om hoge symptoom-last (oa hypertensieve crise, catecholamine release). Er is weinig evidence en geen mogelijkheid voor een grotere prospectieve studie. Maligne paraganglioom en pheochromocytoom worden als 1 biologisch vergelijkbare groep beschouwd.
We bespreken hier of een add-on voor cyclofosfamide gerechtvaardigd is als toevoeging aan vincristine en dacarbazine die reeds voldoende vergoedings-status hebben voor deze indicatie
Gezien nu beperkte evidence in de nu besproken studies is het aannemelijk dat de respons kans hoog genoeg is om in aanmerking te komen voor add-on, bij reeds aangetoonde lange duur van respons > 12 maanden en vermindering van symptomatologie. Er is geen overlevingswinst aangetoond voor deze behandeling. Voorstel ook om beide paraganglioom + pheochromocytoom hierin mee te nemen gezien de biologische vergelijkbaarheid en gezamenlijke inclusie in de genoemde trials
Referentie(s)
Averbuch et al Malignant pheochromocytoma: effective treatment with a combination of cyclophosphamide, vincristine, and dacarbazine Ann Intern Med 1988 Aug 15;109(4):267-73.
Huang et al Treatment of malignant pheochromocytoma/paraganglioma with cyclophosphamide, vincristine, and dacarbazine: recommendation from a 22-year follow-up of 18 patients Cancer 2008 Oct 15;113(8):2020-8.
Niemeyer et al Chemotherapy with cyclophosphamide, vincristine and dacarbazine for malignant paraganglioma and pheochromocytoma: systematic review and meta-analysis Clin Endocrinol (Oxf) 2014 Nov;81(5):642-51.
Discussie/ advies/ wanneer herbeoordelen
Akkoord voor te dragen voor add-on van cyclofosfamide in combinatie met vincristine en dacarbazine voor de behandeling van gemetastaseerd paraganglioom danwel feochromocytoom
Datum besproken vergadering
3-10-2023
