
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum
Indicatieaanvraag/studie: Gemcitabine/capecitabine in tweedelijn voor gemetastaseerd bijnierschorscarcinoom
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum
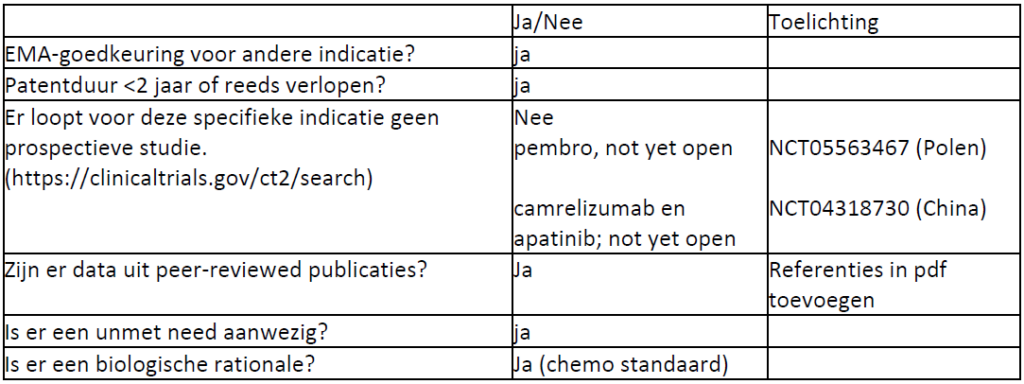
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee
Waar hoort beoordeling thuis:
- Zeldzame indicatie/NRS
Huidige standaard: BSC
Huidige indicatietekst: Gemcitabine;
Lokaal gevorderd of gemetastaseerd: niet-kleincellig longcarcinoom (NSCLC), als primaire behandeling in combinatie met cisplatine. Monotherapie kan worden overwogen bij oudere patiënten of bij patiënten met (ECOG) performance status 2;
blaascarcinoom, in combinatie met cisplatine;
adenocarcinoom van de pancreas;
epitheliaal ovariumcarcinoom, dat recidiveert na meer dan zes maanden na eerstelijns platinabevattende chemotherapie; in combinatie met carboplatine.
Inoperabel, lokaal terugkerend of gemetastaseerd:
mammacarcinoom, met recidief na (neo)adjuvante chemotherapie die een antracycline bevatte (tenzij dit gecontra-indiceerd was), in combinatie met paclitaxel.
Huidige indicatietekst:
Capecitabine;
- Carcinomen van het maag-darmkanaal
- Stadium III (stadium Dukes C) coloncarcinoom als adjuvante behandeling;
- Gemetastaseerd colorectaalcarcinoom;
- Gevorderd maagcarcinoom als eerstelijnsbehandeling in combinatie met een op platina gebaseerd regime.
- Mammacarcinoom
- Lokaal voortgeschreden of gemetastaseerd mammacarcinoom in combinatie met docetaxel, na falen van chemotherapie die een antracyclinederivaat bevatte;
- Lokaal voortgeschreden of gemetastaseerd mammacarcinoom als monotherapie, na falen van taxanen en chemotherapie die een antracyclinederivaat bevatte óf indien verdere behandeling met antracyclinederivaten niet is aangewezen.
Einddatum patent: NVT
Zeldzame indicatie/NRS
Tumortype en behandellijn
Tweedelijns behandeling bijnierschorscarcinoom
Medicament/middelen
Gemcitabine en capecitabine
Indicatie (EMA) en huidige indicatietekst (op farmatec)
Gemzar, 200 mg, 1000 mg, powder for solution for infusion, is a pyrimidine antagonist and is given in the management of solid tumours. It is indicated in bladder cancer, advanced non-small cell lung cancer, advanced pancreatic cancer, breast cancer and ovarian cancer.
Korte bespreking van de studie(s)
Kleine fase II studie BNS carcinoom met PD na mitotane en 1 of 2 lijnen chemotherapie.
From 1998 to 2008, 28 patients with advanced ACC progressing after mitotane plus one or two systemic chemotherapy lines were enrolled.
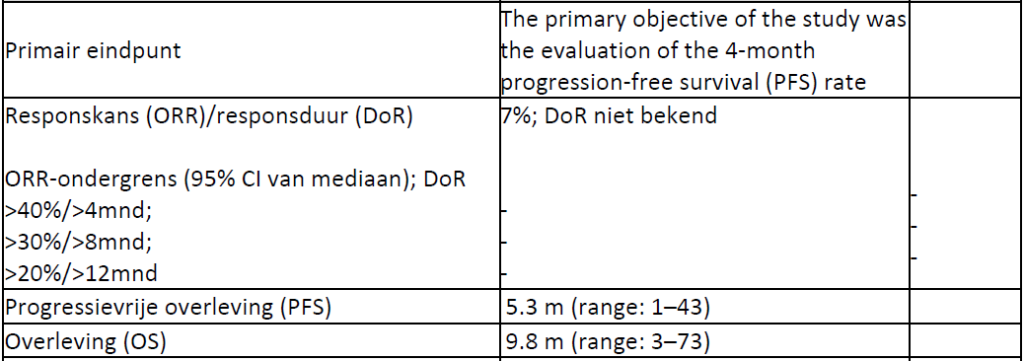
The rate of non-progressing patients after 4 months of treatment was 46.3%. A complete response was observed in 1 patient (3.5%); 1 patient (3.5%) obtained a partial regression, 11 patients (39.3%) obtained a disease stabilization and 15 patients (53.7%) progressed.
Median time to progression and overall survival in the patient population were 5.3 (range: 1–43) and 9.8 months (range: 3–73) respectively.
Treatment was well tolerated, with grade III and IV toxicities consisting of leukopenia in six patients (21.4%), thrombocytopenia in one patient (3.5%), and mucositis in one patient (3.5%).
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja
Effectiviteit
Bijwerkingen (totaal/gerelateerd aan de behandeling)
Lethaal: NB %
Acuut, ernstig (graad 3-4): 21 % (leukopenie)
Staken van de behandeling i.v.m. bijwerkingen: NB %
Kwaliteit van leven
Kwaliteit van leven analyse: nee
Beperkingen van de studie
Kleine fase II studie die 10 jaar heeft gelopen voor 28 patiënten
Referentie(s)
Endocrine-Related Cancer (2010) 17 445–453
Discussie / advies / wanneer herbeoordelen
Resultaten voldoen niet aan NVMO NRS criteria.
Datum besproken vergadering
15 november 2022