
VOORBLAD; IN TE VULLEN DOOR AANVRAGER
Datum 24-01-2023
Indicatieaanvraag/studie: Pazopanib voor chondrosarcoom
VOORBLAD; IN TE VULLEN DOOR CieOOM
Datum 24-01-2023
Beoordeling door CieOOM mogelijk: ja
Beoordeling voorleggen aan CieBOM: nee
Is er volgens CieOOM een gerandomiseerde studie mogelijk: nee (wordt er nu 1 gedaan; NCT 04950075 maar met ander middel INBRX-109, een DR5 agonist antobody)
Waarhoortbeoordelingthuis:
• Zeldzame indicatie/NRS
Huidige standaard: geen
Huidige indicatietekst:
• advanced renal-cell carcinoma, a type of kidney cancer. It is used in patients who have not received any previous treatment or in patients who have already been treated for their advanced disease with anticancer medicines called ‘cytokines’. ‘Advanced’ means thatthecancer has startedto spread;
• certain forms of soft-tissue sarcoma, a type of cancer that develops from the soft, supporting tissues of the body. It is used in patients who have been previously treated with chemotherapy (medicines to treat cancer) because their cancer had spread, or in patients whose cancer has progressed within 12 months after receiving adjuvant or neoadjuvant therapy (treatment received after or before their main treatment).
Farmatec

Einddatum patent: juni 2025
Zeldzame indicatie/NRS
Tumortype en behandellijn
Chondrosarcoom
Medicament/middelen
pazopanib
Indicatie (EMA) en huidige indicatietekst (op farmatec)
The following tumour types were eligible: Fibroblastic (adult fibrosarcoma, myxofibrosarcoma, sclerosing epithelioid fibrosarcoma, malignant solitary fibrous tumours), so-called fibrohistiocytic (pleomorphic malignant fibrous histiocytoma [MFH], giant cell MFH, inflammatory MFH), leiomyosarcoma, malignant glomus tumours, skeletal muscles (pleomorphic and alveolar rhabdomyosarcoma), vascular (epithelioid hemangioendothelioma, angiosarcoma), uncertain differentiation (synovial, epithelioid, alveolar soft part, clear cell, desmoplastic small round cell, extra-renal rhabdoid, malignant mesenchymoma, PEComa, intimal sarcoma), malignant peripheral nerve sheath tumours, undifferentiated soft tissue sarcomas not otherwise specified (NOS) and other types of sarcoma (not listed as ineligible).
The following tumour types were not eligible: Adipocytic sarcoma (all subtypes), all rhabdomyosarcoma that were not alveolar or pleomorphic, chondrosarcoma, osteosarcoma, Ewing tumours/primitive neuroectodermal tumours (PNET), GIST, dermofibromatosis sarcoma protuberans, inflammatory myofibroblastic sarcoma, malignant mesothelioma and mixed mesodermal tumours of the uterus. Of note, patients with adipocytic sarcoma were excluded from the pivotal Phase III study as in a preliminary Phase II study (VEG20002) activity (PFS at week 12) observed with pazopanib in adipocytic did not meet the prerequisite rate to allow further clinical testing.
Korte bespreking van de studie(s)
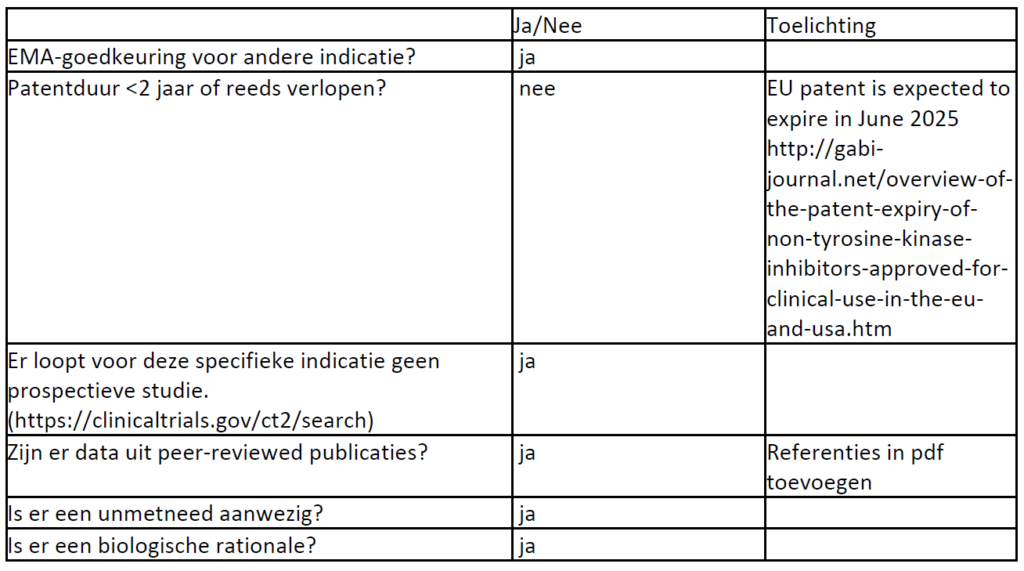
Studie Chow et al (n=47); The primary endpoint was the disease control rate (DCR) at week 16 (4 cycles) of study treatment; disease control was defined as complete response plus partial response plus stable disease. Secondary efficacy endpoints included PFS and overall survival (OS).
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja
Effectiviteit
Bijwerkingen (totaal/gerelateerd aan de behandeling)
- Lethaal: 0-1%
- Acuut, ernstig (graad 3-4): grade 3 and 4 AEs were not frequent across the study sample (resp 11 en 2%).
- Staken van de behandeling i.v.m. bijwerkingen: 12 patients (26%) had AEs leading to withdrawal from the study.
Kwaliteit van leven
Kwaliteit van leven analyse: Niet verricht
Beperkingen van de studie
Single arm, N=47, geen bruikbaar eindpunt voor NRS beoordeling
Referentie(s)
Results of a prospective phase 2 study of pazopanib in patients with surgically unresectable or metastatic chondrosarcoma
Chow W, Frankel P, Ruel C, Araujo DM, Milhem M, Okuno S, Hartner L, Undevia S, Staddon A.Cancer. 2020 Jan 1;126(1):105-111
Korte bespreking van de studie(s)
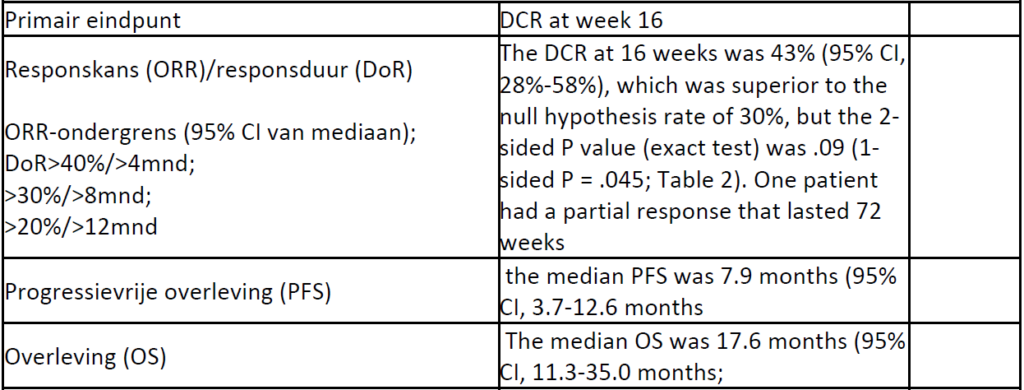
Studie Stacchiotti et al (N=26) in extraskeletal myxoid chondrosarcoma; 22 patienten evalueerbaar voor het primair eindpunt
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja
Effectiviteit
Bijwerkingen (totaal/gerelateerd aan de behandeling)
- Lethaal: 0%
- Acuut, ernstig (graad 3-4): The most frequent grade 3 adverse events were hypertension (nine [35%] of 26 patients), increased concentration of alanine amino-transferase (six [23%]), and increased aspartate aminotransferase (five [19%])
- Staken van de behandeling i.v.m. bijwerkingen: One (4%) of 26 patients definitively discontinued pazopanib because of toxicity (grade 3 anal fistula). Eight (31%) of 26 patients in the safety population (seven in the modified intention-to-treat group) had to reduce the daily dose of pazopanib definitively and three (11%) had a temporary dose reduction because of toxicity
Kwaliteit van leven
Kwaliteit van leven analyse: Niet verricht
Beperkingen van de studie
Single arm, N=26, zeer beperkt indicatiegebied
Referentie(s)
Pazopanib for treatment of advanced extraskeletalmyxoid chondrosarcoma: a multicentre, single-arm, phase 2 trial
Stacchiotti S, Ferrari S, Redondo A, Hindi N, Palmerini E, Vaz Salgado MA, Frezza AM, Casali PG, Gutierrez A, Lopez-Pousa A, Grignani G, Italiano A, LeCesne A, Dumont S, Blay JY, Penel N, Bernabeu D, de Alava E, Karanian M, Morosi C, Brich S, Dagrada GP, Vallacchi V, Castelli C, Brenca M, Racanelli D, Maestro R, Collini P, Cruz J, Martin-Broto J.Lancet Oncol. 2019 Sep;20(9):1252-1262
Korte bespreking van de studie(s)
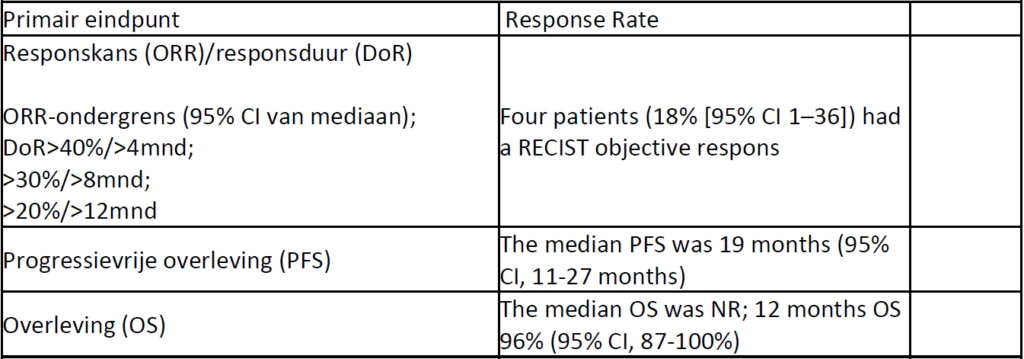
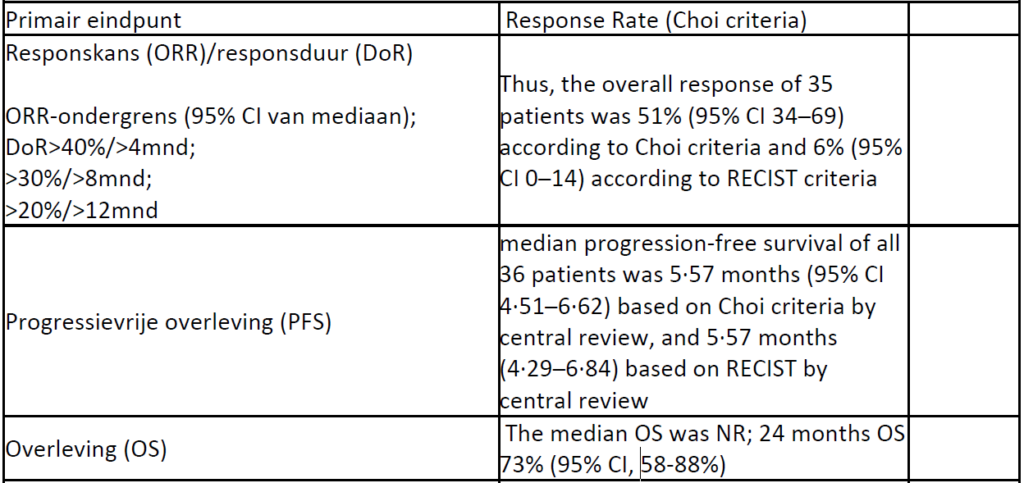
Studie Broto et al (N=36) in advanced malignant and dedifferentiated solitary fibrous tumour; 36 patienten (waarvan 2 met dedifferentiated SFT) evalueerbaar voor het primair eindpunt response cf Choi criteria
Past studieopzet bij de zeldzaamheid van de indicatie?
Ja
Effectiviteit
Bijwerkingen (totaal/gerelateerd aan de behandeling)
- Lethaal: 0%
- Acuut, ernstig (graad 3-4): grade 3 AEs most frequently observed were hypertension, neutropenia, ALT and bilirubine elevations (31, 11, 11 and 8%).
- Staken van de behandeling i.v.m. bijwerkingen: Niet vermeld
Kwaliteit van leven
Kwaliteit van leven analyse: Niet verricht
Beperkingen van de studie
Single arm, N=36, twee subtypes; de facto veruit de meeste data over het non-dedifferentiated SFT
Referentie(s)
Javier Martin-Broto, et al. Pazopanib for treatment of advanced extra skeletal myxoid chondrosarcoma: a multicentre, single-arm, phase 2 trial.Lancet Oncol 2019; 20: 134–44
Discussie / advies / wanneer herbeoordelen
Bij de besproken studies (die eerder zijn gevonden) is er geen beoordeling van een door NVMO erkend eindpunt ihkv niet-gerandomiseerde studies (NRS) mogelijk cq voldoet de response rate niet aan de geaccepteerde NRS criteria voor een positief advies.
Pazopanib voor de indicaties (myxoid) chondrosarcoom en non-dedifferentatied SFT komt niet in aanmerking voor een off-label vergoeding op basis van de aangereikte literatuur.
Datum besproken vergadering
24 januari 2023