
Samenvatting eerder advies
In maart 2020 beoordeelde cieBOM de waarde van eerstelijns palliatieve behandeling met avelumab in combinatie met axitinib bij het lokaal gevorderd of gemetastaseerd heldercellig niercelcarcinoom.1 In de JAVELIN Renal 101-studie werden patiënten met een lokaal gevorderd of gemetastaseerd heldercellig niercelcarcinoom 1:1 gerandomiseerd tussen combinatiebehandeling met avelumab (10 mg/kg intraveneus elke 2 weken) en axitinib (tweemaal daags 5 mg oraal) of sunitinib monotherapie (eenmaal daags 50 mg oraal gedurende 4 weken in een 6-wekelijkse cyclus).2 De behandeling werd gecontinueerd tot ziekteprogressie of onacceptabele toxiciteit. De duale primaire eindpunten van de studie waren progressievrije overleving (PFS) vastgesteld door onafhankelijke centrale beoordeling en overleving (OS) voor de subgroep patiënten met een PD-L1-positieve tumor (≥ 1 procent van de afweercellen in het beoordeelde tumorgebied kleurt positief). Secundaire eindpunten waren onder andere PFS vastgesteld door onafhankelijke centrale beoordeling en OS in de intention-to-treat (ITT)-populatie, PFS beoordeeld door de onderzoeker, objectieve responskans (ORR), veiligheid en patient reported outcome measures (PROM’s).
Tussen maart 2016 en december 2017 werden 886 patiënten geïncludeerd vanuit 144 centra in 21 landen: 442 patiënten waarvan 270 met een PD-L1-positieve tumor in de avelumab-axitinibgroep en 444 patiënten waarvan 290 met een PD-L1-positieve tumor in de sunitinibgroep. De mediane follow-up voor PFS was ten tijde van de interim-analyse 9,9 maanden in de avelumab-axitinibgroep en 8,4 maanden in de sunitinibgroep. De PFS in de groep patiënten met een PD-L1-positieve tumor was statistisch significant langer in de avelumab-axitinibgroep dan in de sunitinibgroep (HR: 0,61 [95%-BI: 0,47-0,79]; p < 0,001). De mediane PFS bedroeg 13,8 maanden in de avelumab-axitinibgroep en 7,2 maanden in de sunitinibgroep. De PFS in de ITT-populatie was ook significant langer in de avelumab-axitinibgroep dan in de sunitinibgroep (HR: 0,69 [95%-BI: 0,56-0,84]; p < 0,001), met een mediaan van 13,8 maanden in de avelumab-axitinibgroep en 8,4 maanden in de sunitinibgroep. De data van deze interim-analyse waren nog onvoldoende matuur voor beoordeling van de OS. De ORR in de patiënten met een PD-L1-positieve tumor was 55,2 procent in de avelumab-axitinibgroep en 25,5 procent in de sunitinibgroep. Het PFS-voordeel van avelumab-axitinib ten opzichte van sunitinib werd gevonden in alle onderzochte subgroepen, inclusief patiënten met een goede prognose volgens IMDC-risicoscore en patiënten met een PD-L1-negatieve tumor. Bijwerkingen van graad 3 of hoger kwamen voor bij 309 patiënten (71,2 procent) in de avelumab-axitinibgroep en 314 patiënten (71,5 procent) in de sunitinibgroep.
Immuungerelateerde bijwerkingen van graad 3 of hoger traden op bij 39 patiënten (9,0 procent) in de avelumab-axitinibgroep. De behandeling werd bij 33 patiënten (7,6 procent) in de avelumab-axitinibgroep en bij 59 patiënten (13,4 procent) in de sunitinibgroep voortijdig gestopt vanwege bijwerkingen. In totaal werden 3 overlijdens in de avelumab-axitinibgroep en 1 overlijden in de sunitinibgroep toegeschreven aan de behandeling. De resultaten van het primaire eindpunt PFS voldeden aan de destijds geldende criteria voor een voorlopig positief advies volgens de PASKWIL-criteria voor palliatieve behandeling. Het was een voorlopig positief advies omdat de resultaten van het andere primaire eindpunt OS nog onvoldoende matuur waren voor beoordeling.
Update van de resultaten
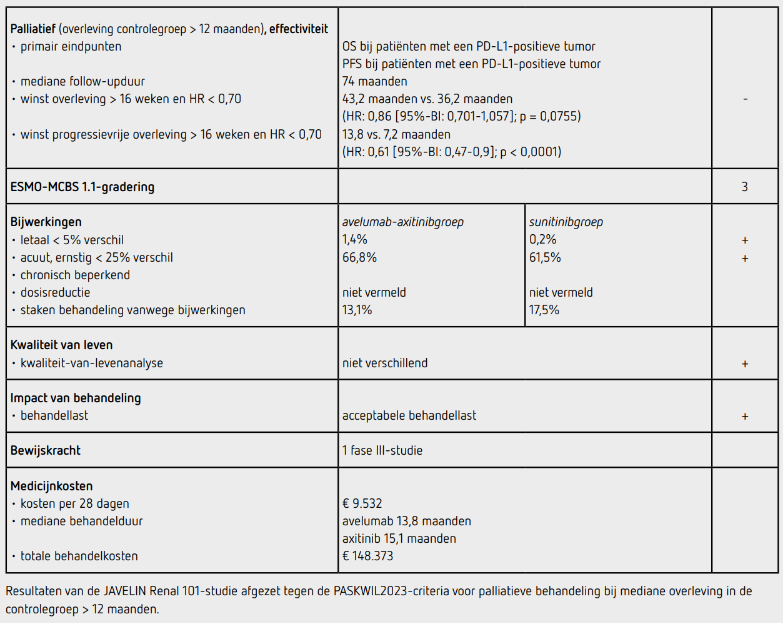
In december 2024 is de finale analyse van deze studie gepubliceerd.3 Voor de primaire analyse van OS werd verwacht om na 368 events met 90 procent power een HR van 0,70 met een eenzijdige alfa van 0,021 aan te kunnen tonen in de PDL-1- positieve groep. Dit statistisch plan is vastgesteld na een amendement in juni 2017. De alfa werd verdeeld volgens de Lan-DeMets O’Brien-Fleming-methode nadat eerder de analyse voor PFS positief was. Voor de huidige analyse werd een grens van 0,01975 (eenzijdig) aangehouden voor statistische significantie (HR < 0,805) in de PD-L1-positieve groep en een grens van 0,00382 voor de ITT-populatie (HR < 0,793). Op het moment van de analyse (data-cutoff 31 augustus 2023) was de mediane follow-up in de avelumab-axitinibgroep en sunitinibgroep respectievelijk 73,7 en 73,6 maanden. Er waren in totaal 578 patiënten overleden, waarvan 375 patiënten met een PD-L1-positieve tumor. De mediane behandelduur met avelumab was 13,8 maanden, met axitinib 15,1 maanden en met sunitinib 8,3 maanden.
In de PD-L1-positieve populatie was de mediane OS 43,2 maanden (95%-BI: 36,5-51,7) in de avelumab-axitinibgroep en 36,2 maanden (95%-BI: 29,8-44,2) in de sunitinibgroep. Dit verschil was niet statistisch significant (HR: 0,86 [95%-BI: 0,701-1,057]; eenzijdige p = 0,0755). Ook in de ITT-populatie verschilde de OS niet significant tussen de beide behandelgroepen (HR: 0,88 [95%-BI: 0,749-1,039]; eenzijdige p = 0,0669). In totaal hadden 290 patiënten (66,8 procent) in de avelumab-axitinibgroep en 270 patiënten (61,5 procent) in de sunitinibgroep een behandelingsgerelateerde bijwerking van graad 3 of hoger, met name hypertensie en diarree. Immuungerelateerde bijwerkingen van graad 3 of hoger kwamen voor bij 64 patiënten (14,7 procent) in de avelumab-axitinibgroep en bij 1 patiënt (0,2 procent) in de sunitinibgroep. In de avelumab-axitinibgroep zijn 6 patiënten (1,4 procent) overleden aan bijwerkingen (4 patiënten ten gevolge van een onduidelijke oorzaak, 1 patiënt door sudden death en 1 patiënt aan myocarditis). 1 patiënt (0,2 procent) overleed in de sunitinibgroep (ten gevolge van ziekteprogressie). In de avelumab-axitinibgroep staakten vanwege bijwerkingen 149 patiënten (34,3 procent) minimaal een van beide middelen en 57 patiënten (13,1 procent) beide middelen. Sunitinib werd gestaakt vanwege bijwerkingen door 77 patiënten (17,5 procent).
Er werd geen persisterend verschil aangetoond tussen de patiënten in de avelumab-axitinibgroep en de sunitinibgroep wat betreft kwaliteit van leven, gemeten met de vragenlijsten EQ-5D-5L en FKSI-19. In de avelumab-axitinibgroep kregen 257 patiënten (58,1 procent) en in de sunitinibgroep kregen 308 patiënten (69,4 procent) een systemische vervolgbehandeling. Het aantal patiënten dat behandeld werd met een vascular endothelial growth factor (VEGF)-receptorremmer was in beide groepen min of meer gelijk, in de avelumab-axitinibgroep 226 patiënten (51,1 procent) en in de sunitinibgroep 205 patiënten (46,2 procent). In de sunitinibgroep kregen patiënten vaker een PD-1- of PD-L1-remmer dan in de avelumab-axitinibgroep, namelijk 238 patiënten (53,6 procent) versus 83 patiënten (18,8 procent).
Bespreking
In de hier besproken herbeoordeling van de JAVELIN Renal 101- studie bij patiënten met een gevorderd of gemetastaseerd heldercellig niercelcarcinoom geeft eerstelijns combinatiebehandeling met avelumab en axitinib in vergelijking met sunitinib geen significante verbetering van het duale primaire eindpunt OS bij patiënten met een PD-L1-positieve tumor (mediane OS 43,2 versus 36,2 maanden; HR: 0,86 [95%- BI: 0,701-1,057]; eenzijdige p = 0,0755). Deze resultaten voldoen niet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer is dan 12 maanden.
Het is onduidelijk waarom het PFS-voordeel van de combinatie avelumab-axitinib zich niet vertaalt in OS-winst, zoals bij combinaties als nivolumab-cabozantinib, pembrolizumab-lenvatinib en pembrolizumab-axitinib.4,5,6 Het aantal geïncludeerde patiënten in de studie met pembrolizumab-lenvatinib (meer dan 1000), pembrolizumab-axitinib (861) en nivolumab-cabozantinib (651) is hoger dan in de JAVELIN Renal 101-studie (560), hetgeen de power om een OS-voordeel aan te tonen beïnvloedt. Daarnaast is het mogelijk dat PD-L1-remmers minder effectief zijn dan PD-1-remmers bij het gemetastaseerd heldercellig niercelcarcinoom. Onder vermelding dat cross-studievergelijkingen hun beperkingen hebben, is het wel opvallend dat het percentage van patiënten in de sunitinibgroep dat behandeld is met een PD-1- of PD-L1-remmer in de tweede lijn hoger is in de JAVELIN Renal 101-studie dan in de cabozantinib-nivolumab- en pembrolizumab-axitinibstudies (53,6 procent versus 30,8 procent en 36 procent), wat de uitkomst van deze 2 andere studies gunstig beïnvloed kan hebben. Een andere verklaring is dat het PFS-voordeel overschat is door informative censoring. Deze hypothese wordt echter niet ondersteund door het percentage patiënten dat de behandeling stopt vanwege bijwerkingen of door inspectie van de PFS-curve.
Bij ruim een kwart van de patiënten in de avelumab-axitinibgroep wordt de behandeling (avelumab en/of axitinib) voortijdig gestaakt vanwege bijwerkingen. Het percentage patiënten dat blijvende (immuungerelateerde) toxiciteit ondervindt, is niet duidelijk benoemd. Wel zijn de kwaliteit-van-levenresultaten gepubliceerd die geen significant verschil laten zien tussen beide behandelgroepen. Immuungerelateerde bijwerkingen komen voor bij 1 op de 2 patiënten en bij 1 op de 7 patiënten zijn deze bijwerkingen van graad 3 of hoger. Een deel van deze bijwerkingen waaronder hypothyreoïdie en bijnierschorsinsufficiëntie zal irreversibel zijn. De kosten van de combinatiebehandeling zijn zeer hoog.
Kosten
Behandeling met avelumab 10 mg/kg kost bij een gewicht van 80 kg 2.840 euro per cyclus van 2 weken. Behandeling met axitinib tweemaal daags 5 mg kost 1.926 euro per 2 weken (bron: medicijnkosten.nl d.d. augustus 2025). De mediane behandelduur met avelumab is 13,8 maanden en met axitinib 15,1 maanden. De totale kosten van de combinatiebehandeling bedragen daarmee 148.373 euro.
Conclusie
In de JAVELIN Renal 101-studie wordt bij patiënten met een gevorderd of gemetastaseerd heldercellig niercelcarcinoom geen statistisch significant verschil aangetoond in het duale primaire eindpunt OS bij patiënten met een PD-L1-positieve tumor met eerstelijnsbehandeling met avelumab en axitinib ten opzichte van sunitinib (mediane OS 43,2 versus 36,2 maanden; HR: 0,86 [95%-BI: 0,701-1,057]; eenzijdige p = 0,0755). Deze resultaten voldoen bij definitieve beoordeling niet aan de PASKWIL2023- criteria voor palliatieve behandeling bij studies waarbij de mediane overleving in de controlegroep langer is dan 12 maanden.
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Eerstelijns combinatiebehandeling met avelumab en axitinib bij het gemetastaseerd heldercellig niercelcarcinoom. Med Oncol 2020;28(3):19-23.
- Motzer RJ, Penkov K, Haanen J et al. Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019;380(12):1103-15.
- Choueiri TK, Penkov K, Uemura H et al. Avelumab + axitinib vs sunitinib as first-line treatment for patients with advanced renal cell carcinoma: final analysis of the phase 3 JAVELIN Renal 101 trial. Ann Oncol 2025;36(4):387-92.
- Choueiri TK, Powles T, Burotto M et al. Nivolumab plus cabozantinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2021;384(9):829-41.
- Motzer R, Alekseev B, Rha SY et al. Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma. N Engl J Med 2021;384(14):1289-300.
- Rini BI, Plimack ER, Stus V et al. Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019;380(12):1116-27.