
Inleiding
Jaarlijks wordt in Nederland bij bijna 12.000 patiënten de diagnose niet-kleincellig longcarcinoom (NSCLC) gesteld. Bij diagnose bevindt zich daarvan 14 procent in stadium IA, 4 procent IB, 2 procent IIA, 6 procent IIB en 9 procent IIIA (2019, DLCA). Stadia IA tot en met IIB (kleine tumoren zonder of met aangedane hiluslymfklieren) zijn primair resectabel, en worden in de meerderheid geopereerd waarbij voor de niet-operabele patiënten (stereotactische) radiotherapie een goed alternatief is. Voor stadium IIIA is de standaardbehandeling chemoradiotherapie gevolgd door adjuvante behandeling met durvalumab of neoadjuvante immunochemotherapie gevolgd door een resectie.
De voorkeursbehandeling voor patiënten met resectabel/operabel stadium I-IIIB NSCLC is een anatomische resectie. In Nederland worden jaarlijks ruim 2.000 parenchymresecties verricht (2019, DLCA). Voor patiënten met een complete resectie van stadium II-IIIA NSCLC is adjuvante platinumbevattende chemotherapie aanbevolen (indien er geen neoadjuvante chemotherapie is gegeven), bij geselecteerde patiënten met stadium IB (tumor > 4 cm) kan ook adjuvante chemotherapie overwogen worden. Over de hele groep leidt dit tot 5 procent absolute winst in algehele overleving na 5 jaar.1 Adjuvante chemotherapie wordt in de praktijk om diverse redenen slechts in minder dan de helft van de patiënten toegediend. Voor geselecteerde patiënten kan na een resectie nog adjuvante immunotherapie gegeven worden in de vorm van atezolizumab voor patiënten met tumoren met een PD-L1t-umorpositiviteitsscore (TPS) van 50 procent of hoger.2
Voor patiënten met een EGFR-mutatie en resectie wordt adjuvant osimertinib geadviseerd gedurende 3 jaar, met een verbetering van algehele overleving van 10 procent na 5 jaar.3 Na primaire resectie en adjuvante therapie blijft het risico op recidief hoog, met een 5-jaars overleving van 73 procent voor patiënten met stadium IB tot 41 procent met stadium IIIA.
Een translocatie in het anaplastic lymphoma kinase (ALK)-gen komt voor in 4-5 procent van de patiënten met NSCLC. Deze patiënten zijn vaak jonger en niet-rokers, en hebben bij diagnose vaker een gevorderd stadium en een hogere kans op hersenmetastasering. Immuuntherapie lijkt niet effectief bij patiënten met deze translocatie. Alectinib is een orale ALK-tyrosinekinaseremmer. Alectinib is de eerste keus voor behandeling bij gemetastaseerd ALK-positief NSCLC, met ook goede activiteit in het centraal zenuwstelsel.4 In de hier te bespreken ALINA-studie wordt het effect van adjuvante behandeling met alectinib vergeleken met chemotherapie in patiënten met een gereseceerd ALK-positief NSCLC.5 Alectinib is door de EMA geregistreerd voor adjuvante behandeling na complete resectie van een ALK-positief NSCLC bij patiënten met een hoog risico op recidief.
1. Kankersoort en lijn van behandeling
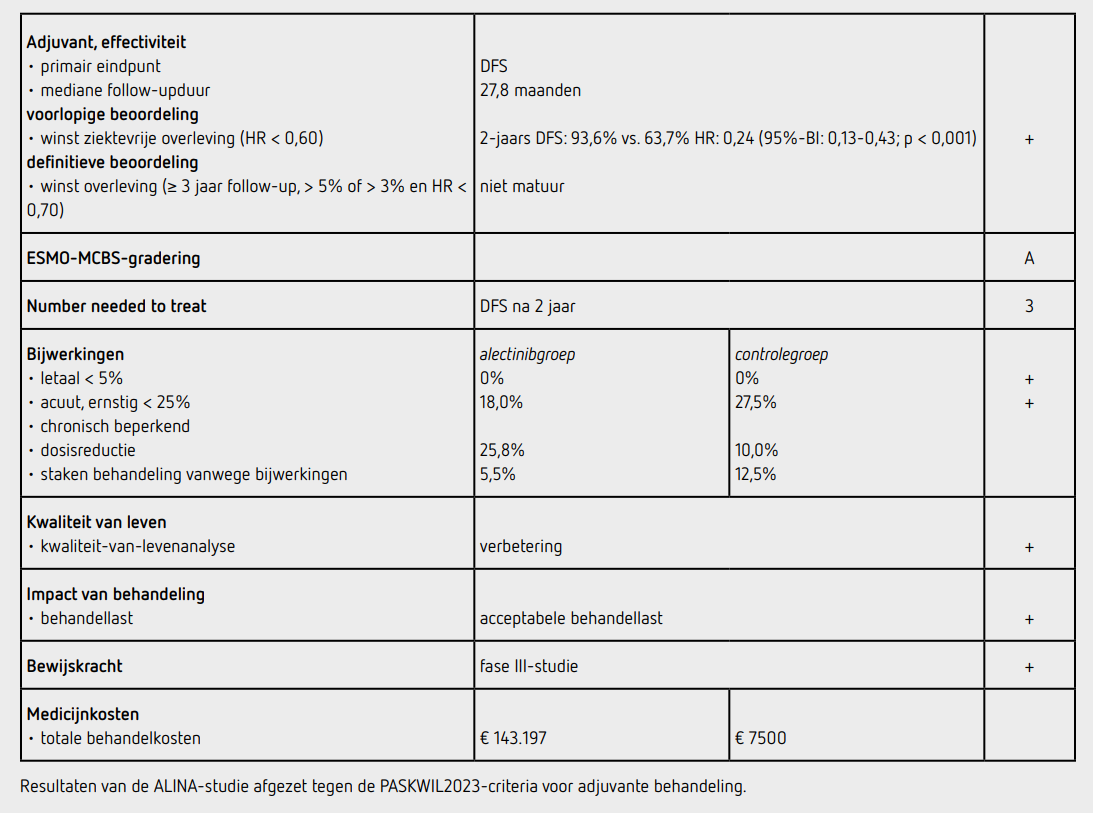
Adjuvante behandeling met alectinib werd onderzocht bij patiënten met een compleet gereseceerd, ALK-positief, stadium IB (tumorgrootte ≥ 4 cm)-IIIA NSCLC.
2. Vergelijking met de referentiebehandeling in Nederland
Ten tijde van de studie was voor deze stadia adjuvante chemotherapie de standaardbehandeling. De referentiebehandeling komt overeen met de Nederlandse situatie.
3. Methode en kwaliteit van de studie
De ALINA-studie is een internationale, open-label, gerandomiseerde fase III-studie voor patiënten met een ALK-positief NSCLC na complete resectie van een stadium IB (tumorgrootte ≥ 4 cm), II of IIIA volgens de TNM 7e editie. Verdere inclusiecriteria waren geschiktheid voor platinumbevattende chemotherapie, een ECOG-performancestatus 0-1, geen eerdere systeemtherapie en afwezigheid van hersenmetastasen op MRI.
Screening en randomisatie vond plaats tussen 4 en 12 weken na de resectie, waarbij sublobaire resecties niet waren toegestaan. Patiënten werden 1:1 gerandomiseerd tussen oraal alectinib (600 mg tweemaal daags) of 4 driewekelijkse cycli platinumbevattende chemotherapie. De chemotherapie bestond uit cisplatine 75 mg/m2 of carboplatine AUC 5 of 6 (indien behandeling cisplatine niet mogelijk was), met daarbij vinorelbine 25 mg/m2 op dag 1 en 8, gemcitabine 1250 mg/m2 op dag 1 en 8, of pemetrexed 500 mg/m2 op dag 1. De behandelduur van alectinib was 24 maanden, tenzij eerder gestopt werd in verband met progressie, bijwerkingen of wens van de patiënt. De optie tot cross-over bij recidief was niet vastgelegd in het protocol, de keuze voor type vervolgtherapie lag bij de behandelaar. Er werd gestratificeerd op ziektestadium (IB versus II versus IIIA) en ras (Aziatisch versus niet-Aziatisch).
Het primaire eindpunt was ziektevrije overleving (DFS), gedefinieerd als tijd tot recidief ziekte, een nieuw primaire NSCLC of overlijden aan elke oorzaak, vastgesteld door de lokale onderzoeker. Secundaire eindpunten waren algehele overleving (OS) en veiligheid. Een exploratief eindpunt was centraal zenuwstelsel (CNS) progressievrije overleving. Aan- of afwezigheid van ziekteactiviteit werd geëvalueerd middels CT of MRI van thorax, lever en bijnieren en MRI van de hersenen bij start van de studie en daarna elke 12 weken gedurende de eerste twee jaar, elke 24 weken in jaar 3 tot 5 en daarna jaarlijks. Kwaliteit van leven werd bepaald met de vragenlijsten SF-36 en EQ-5D-5L.
De studie was ontworpen om een hazard ratio (HR) van 0,55 voor de stadium II-IIIA-populatie en een HR van 0,58 voor de ITT-populatie aan te tonen met 80 procent power en een tweezijdige alfa van 0,05. Hiervoor was een groepsgrootte berekend van 255 patiënten in de ITT-populatie waarvan ten minste 191 met stadium II-IIIA. Ziektevrije overleving (DFS) werd berekend met een vooraf gedefinieerde hiërarchische aanpak eerst in de subgroep patiënten met stadium II-IIIA en daarna in de ITT-populatie. Er was een interim-analyse gepland bij ongeveer 59 DFS-events (67 procent) in de stadium II-IIIA-populatie. Bij deze interim-analyse was een grens voor significantie van 0,018 (corresponderend met HR ≤ 0,52) in de stadium II-IIIA-+populatie en 0,0121 (HR ≤ 0,55) in de ITT-populatie.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen augustus 2018 en december 2021 werden 257 patiënten geïncludeerd in 113 centra in 26 landen. 130 patiënten werden gerandomiseerd in de alectinibgroep, 127 in de chemotherapiearm. Dit rapport beschrijft de resultaten van de interim-analyse, ten tijde van de data-cutoff op 26 juni 2023.
In het algemeen was er een gelijkmatige verdeling van patiënten over beide groepen, de alectinibgroep bevatte iets meer vrouwen (57,7 procent versus 46,5 procent) en nooit-rokers (64,6 procent versus 55,1 procent) dan de chemotherapiegroep. De mediane leeftijd was respectievelijk 54 en 57 jaar, ~55 procent had een Aziatische achtergrond, ongeveer de helft had een ECOG-performancestatus van 0, 10 procent had stadium IB, ~36 procent stadium II en 53-55 procent stadium IIIA ziekte. Een volledige lymfeklierdissectie was uitgevoerd bij 83 procent en ruim 92 procent had een lobectomie ondergaan. Er zat mediaan 1,7 maanden tussen de resectie en randomisatie. Ten tijde van de interim-analyse was er een mediane follow-upduur van 27,8 maanden en was de laatst geïncludeerde patiënt minstens 18 maanden gevolgd. Ruim 20 procent van de patiënten werd nog behandeld met alectinib.
Er was sprake van stadium II of IIIA bij 231 patiënten, waarvan 116 in de alectinibgroep en 115 in de chemotherapiegroep behandeld werden. 59 van deze 231 patiënten had een ziekterecidief ten tijde van de interim-analyse, 14 in de alectinibgroep en 45 in de chemotherapiegroep. De tweejaars-DFS bij patiënten met stadium II-IIIA was 93,8 procent in de alectinibgroep en 63,0 procent in de chemotherapiegroep. Dit komt neer op een mediane DFS van niet bereikt versus 44,4 maanden, met een HR van 0,24 (95%-BI: 0,13-0,45; p < 0,001). In de ITT-populatie van 257 patiënten hadden 65 patiënten recidief ziekte, 15 in de alectinibgroep en 50 in de chemotherapiegroep. De tweejaarsoverleving was 93,6 procent en 63,7 procent respectievelijk, met een HR van 0,24 (95%-BI: 0,13-0,43; p < 0,001). Deze verschillen in DFS werden gezien in alle subgroepen. Een recidief in de hersenen kwam voor bij 4 patiënten behandeld met alectinib en 14 patiënten behandeld met chemotherapie. Bij een recidief kregen 13 patiënten (87 procent) in de alectinibgroep en 43 patiënten (88 procent) in de chemotherapiegroep een vervolgbehandeling. In de chemotherapiegroep kregen bij een recidief 37 patiënten (76 procent) een ALK-tyrosinekinaseremmer (29 patiënten alectinib en 11 een andere tyrosinekinaseremmer. Bij deze interim-analyse was de OS immatuur en niet gerapporteerd.
In de alectinibgroep startten 128 patiënten (98 procent) met behandeling en in de chemotherapiegroep waren dit 120 patiënten (94 procent). Behandelinggerelateerde bijwerkingen van graad 3 en 4 werden gezien bij respectievelijk 18,0 procent en 27,5 procent van de patiënten in de alectinibgroep en chemotherapiegroep. Er waren geen bijwerkingen van graad 3 of hoger die bij meer dan 10 procent van de patiënten voorkwamen.
De meest voorkomende bijwerkingen van alectinib waren een verhoogd creatininekinase (43 procent), obstipatie (42 procent), verhoogd ASAT (41 procent), ALAT (34 procent) en bilirubine (34 procent). Bijwerkingen met dosisreductie tot gevolg werd gezien in 25,8 procent in de alectinibgroep en 10,0 procent in de chemotherapiegroep. Bijwerkingen leidend tot het staken van de behandeling werd gezien in 5,5 procent bij de alectinibgroep en 12,5 procent bij de chemotherapiegroep. Graad 5 toxiciteit werd niet gerapporteerd.
Exploratief werd een verbetering in kwaliteit van leven gezien zowel mentaal als fysiek in de alectinibgroep, gedurende de hele twee jaar behandeling.6
5. Discussie
In de ALINA-studie werd een klinisch significante toename in DFS gezien bij adjuvante behandeling met alectinib bij stadium IB-IIIA NSCLC na resectie ten opzichte van adjuvante chemotherapie. Deze resultaten voldoen aan de PASKWIL2023-criteria voor adjuvante studies voor een voorlopig positief advies. OS is een secundair eindpunt en nog immatuur. Zodra de OS-resultaten bekend zijn zal de definitieve beoordeling plaatsvinden. Een groot deel van de patiënten ontvangt bij recidief een ALK-TKI. Dit zal invloed hebben op de OS, maar weerspiegelt wel de praktijk waarbij patiënten op het moment van recidief de best beschikbare behandeling krijgen. De toename in DFS werd gezien in alle subgroepen, waarbij met name ook het voorkomen van hersenmetastasen een stuk minder was. De toxiciteit lijkt acceptabel, wat ook weerspiegeld is in de betere kwaliteit van leven gedurende de hele behandelduur vergeleken met chemotherapie.
Een belangrijk verschil met de Nederlandse situatie is dat een aanzienlijk deel (bijna de helft) van de patiënten een longcarcinoom met N2-positieve klieren had, die in Nederland deels chemoradiotherapie en adjuvante immuuntherapie krijgen en deels resectie eventueel voorafgegaan door neoadjuvante chemo-immuuntherapie.
Verschillen met de ADAURA-studie waarin adjuvante behandeling met de EGFR-remmer osimertinib werd gegeven3 zijn zowel het open-labeldesign als de vergelijking met adjuvante chemotherapie in plaats van met placebo. Ook is de duur van de adjuvante behandeling in deze studie 2 jaar (bij osimertinib is gekozen voor 3 jaar), waarbij de optimale behandelduur niet bekend is. Als alectinib toegepast gaat worden in de dagelijkse praktijk betekent dit dat ook bij het resectabel NSCLC getest zal moeten worden of er sprake is van een ALK-translocatie (naast EGFR).
6. Kosten
De behandeling met alectinib kost per dag 196,16 euro (bron: medicijnkosten.nl d.d. 5-10-2024). De totale medicatiekosten bij een behandelduur van 2 jaar komen daarmee op 143.197 euro. Vier kuren adjuvante chemotherapie (met carboplatine en pemetrexed) kost ongeveer 7.500 euro.
7. Conclusie
In de hier besproken ALINA-studie werd een significante verlenging van het primaire eindpunt DFS gezien van adjuvante behandeling met alectinib gedurende 2 jaar ten opzichte van chemotherapie. De overleving was een secundair eindpunt en nog niet matuur.
Deze studie voldoet aan de PASKWIL2023-criteria voor adjuvante studies voor een voorlopig positief advies, in afwachting van de OS-cijfers.
Referenties
- Pignon J-P, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008;26:3552-9
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Adjuvante behandeling met atezolizumab na adjuvante chemotherapie bij patiënten met een stadium IB-IIIA NSCLC Med Oncol 2022;25(6):27-32.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Osimertinib als adjuvante therapie bij patiënten met een gereseceerd EGFR-gemuteerd niet-kleincellig longcarcinoom. Med Oncol 2023;26(8):33-4
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Alectinib als eerstelijns behandeling voor gemetastaseerd ALK-positief niet-kleincellig longcarcinoom. Med Oncol 2018;21(8):45-8.
- Wu Y-L, Dziadzuszko R, Ahn JS, et al. Alectinib in resected ALK-positive non-small-cell lung cancer. N Engl J Med 2024;390:1265-76.
- Nishio M, oral presentation ASCO 2024.