Inleiding
Met bijna 3.000 diagnoses per jaar behoort het pancreascarcinoom niet tot de veelvoorkomende kankersoorten. Het aantal diagnoses stijgt echter en de prognose is zeer slecht. Meer dan de helft van alle patiënten in Nederland heeft bij diagnose reeds gemetastaseerde ziekte. Slechts 1 op de 5 patiënten wordt geopereerd. De 5-jaarsoverleving van patiënten die tussen 2003 en 2014 in Nederland met curatieve intentie werden behandeld met chirurgie en chemotherapie was 20 procent.1
De Nederlandse richtlijn, in juni 2019 voor het laatst herzien, beveelt aan om bij patiënten met een WHO-performance-status van 0 of 1 binnen 12 weken na chirurgie te starten met 12 kuren adjuvant aangepast FOLFIRINOX (mFOLFIRINOX: een combinatie van 5-FU, irinotecan, oxaliplatine en leucovorine). De richtlijn adviseert verder om patiënten met een WHO-performance-status van 2 of patiënten ouder dan 75 jaar adjuvant te behandelen met 6 kuren gemcitabine, waarbij overwogen moet worden om capecitabine daaraan toe te voegen. Deze aanbevelingen zijn gebaseerd op de op dat moment bekende resultaten van de CONKO-001-studie2 (gemcitabine versus observatie), de ESPAC-4-studie3 (gemcitabine-capecitabine versus gemcitabine) en de PRODIGE 24-studie4 (m-FOLFIRINOX versus gemcitabine).
In 2008 concludeerde de commissie BOM op grond van de resultaten van de CONKO-001-studie dat adjuvante chemotherapie met gemcitabine voldoende meerwaarde heeft bij patiënten die in verband met pancreascarcinoom een in opzet curatieve operatie ondergingen.5 De CONKO-001-studie toonde na een mediane follow-up van 136 maanden een statistisch significant verschil in overleving (OS) aan tussen behandeling met 6 kuren gemcitabine en observatie (hazard ratio [HR]: 0,76 [95%-BI: 0,61-0,95]; P = 0,01). De 5- en 10-jaarsoverleving waren respectievelijk 20,7 en 12,2 procent in de gemcitabinegroep en 10,4 en 7,7 procent in de observatiegroep.2
In 2017 beoordeelde de commissie BOM de resultaten van de ESPAC-4-studie en concludeerde dat de mediane follow-up op grond van de op dat moment bekende resultaten onvoldoende was om de definitieve 5jaarsoverlevingscijfers van beide behandelingen (gemcitabine en gemcitabine-capecitabine) te kunnen beoordelen.6 De commissie BOM gaf in 2017 nog geen voorlopige adviezen op basis van data over ziektevrije overleving (DFS). Tijdens de 2020 ASCO Annual Meeting is een update van de data van de ESPAC-4- studie gepresenteerd na een mediane follow-up van 60 maanden. 7 De daar gepresenteerde data zullen in deze herbeoordeling worden besproken. Deze data zijn nog niet gepubliceerd in een peer-reviewed tijdschrift.
In 2019 gaf de commissie BOM op grond van de toen bekende resultaten van de PRODIGE 24-studie een voorlopig positief advies voor de adjuvante behandeling van patiënten met een in opzet curatief geopereerd pancreascarcinoom met een aangepast FOLFIRINOX-schema.8 De PRODIGE 24-studie toonde een significant verschil in DFS tussen adjuvante behandeling met mFOLFIRINOX en gemcitabine (HR: 0,58 [95%-BI: 0,46-0,73]; P < 0,001). De OS-data waren nog niet voldoende matuur om te kunnen beoordelen.3 Tijdens het ESMO Congress 2021 is een update van de data van de PRODIGE 24studie gepresenteerd na een mediane follow-up van 69,7 maanden.9 De daar gepresenteerde data zullen in deze herbeoordeling worden besproken. Ook deze data zijn nog niet gepubliceerd in een peer-reviewed tijdschrift.
Adjuvant gemcitabinecapecitabine
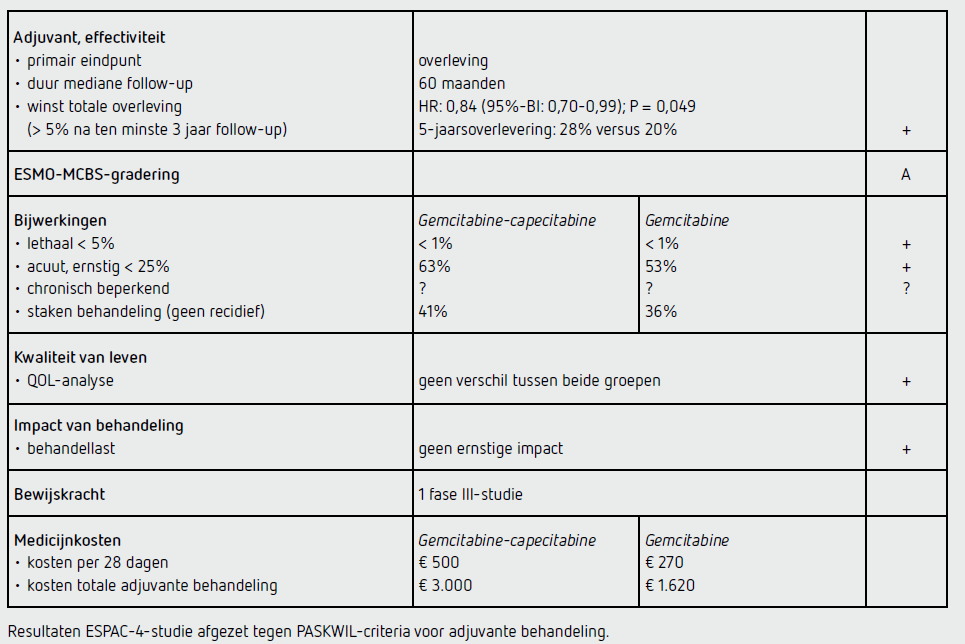
De waarde van adjuvant gemcitabine-capecitabine in vergelijking met adjuvant gemcitabine is onderzocht in de ESPAC-4- studie, die tussen november 2008 en september 2014 is uitgevoerd bij 732 patiënten in 92 Europese ziekenhuizen. De geïncludeerde patiënten hadden een macroscopisch complete resectie ondergaan (R0 of R1) van een adenocarcinoom van de pancreas en hadden een WHO-performancestatus van 0, 1 of 2. De behandeling startte binnen 12 weken na de operatie en bestond uit 6 cycli gemcitabine 1.000 mg/m2 i.v. op dag 1, 8 en 15 in een cyclus van 4 weken. In de combinatiearm werd dezelfde dosering gemcitabine gegeven in combinatie met capecitabine dagelijks 1.660 mg/m2 per o.s. van dag 1 tot en met 21, gevolgd door 7 dagen rust. Het primaire eindpunt van de studie was OS. De methoden en kwaliteit van de ESPAC-4-studie zijn meer in detail beschreven in het beoordelingsverslag van de commissie BOM uit 2017.6
De demografische gegevens van de geïncludeerde patiënten in de combinatiegroep en de gemcitabine-groep waren vergelijkbaar. Te benoemen is dat 61 procent van de patiënten een R1-resectie had ondergaan, de gemiddelde leeftijd 65 jaar was, 42 procent een WHO-performance-status 0 had en 3 procent een WHO-performancestatus 2. Verder had 80 procent van de patiënten lymfekliermetastasen.
De primaire analyse van de ESPAC-4-studie werd uitgevoerd na het sluiten van de database op 9 maart 2016. De mediane follow-up bedroeg op dat moment 43,2 maanden. De analyse toonde een statistisch significant verschil in OS tussen de combinatiegroep, mediaan 28,0 maanden (95%-BI: 23,5-31,5), en de gemcitabinegroep, mediaan 25,5 maanden (95%-BI: 22,7-27,9), met een HR van 0,82 (95%-BI: 0,68- 0,98; P = 0,032). De duur van de mediane follow-up was destijds onvoldoende lang om een oordeel volgens de toen geldende PASKWIL-criteria te kunnen geven.
Tijdens de 2020 ASCO Annual Meeting zijn data van de ESPAC-4-studie gepresenteerd na een mediane follow-up van 60 maanden. Er waren 531 patiënten overleden: 280 in de gemcitabine-groep en 251 in de combinatiegroep. De overleving in de combinatiegroep was significant beter dan de overleving in de gemcitabine-groep (HR: 0,84 [95%-BI: 0,70-0,99]; P = 0,049). De 5-jaarsoverleving was 28 procent (95%-BI: 23-33) in de combinatiegroep en 20 procent (95%- BI: 16-25) in de gemcitabine-groep.
Bijwerkingen van graad 3 of 4 kwamen voor bij 63 procent van de patiënten in de combinatiegroep en bij 53 procent van de patiënten in de gemcitabine-groep. Veel patiënten staakten hun behandeling vroegtijdig: 46 procent in de combinatiegroep en 35 procent in de gemcitabine-groep. Bij respectievelijk 41 en 26 procent was dit vanwege een reden anders dan ziekteprogressie. Kwaliteit van levenanalyses toonden geen significant verschil tussen beide behandelgroepen. Data over de veiligheid van adjuvante behandeling met gemcitabinecapecitabine in de ESPAC-4- studie zijn meer in detail beschreven in het beoordelingsverslag van de commissie BOM uit 2017.6
Adjuvant mFOLFIRINOX
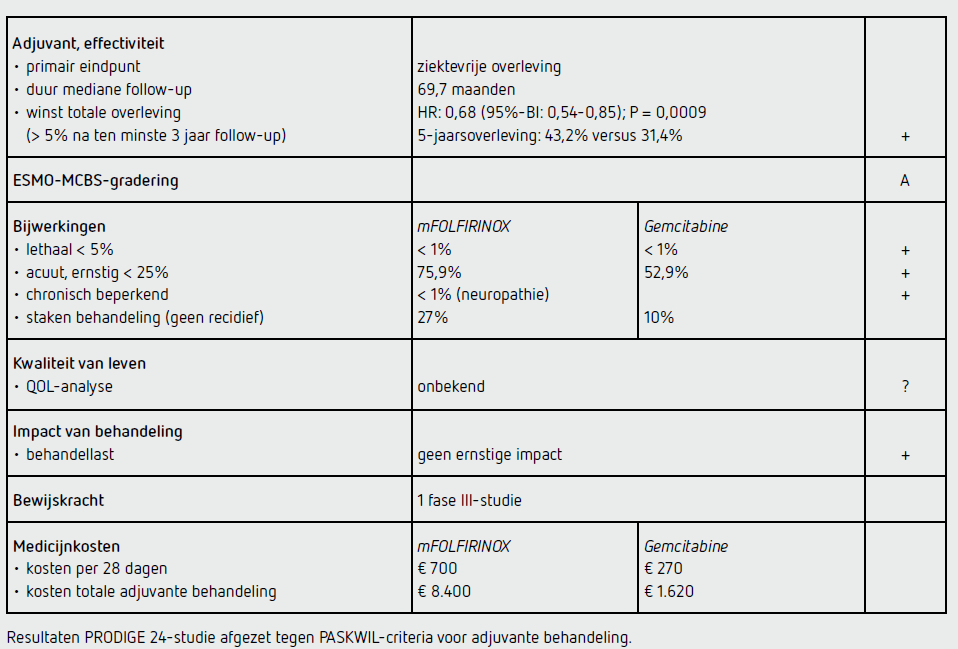
De waarde van adjuvant mFOLFIRINOX in vergelijking met gemcitabine is onderzocht in de PRODIGE 24-studie, die tussen april 2012 en oktober 2016 is uitgevoerd bij 493 patiënten in 77 ziekenhuizen in Canada en Frankrijk. De geïncludeerde patiënten hadden een macroscopisch complete resectie ondergaan (R0 of R1) van een adenocarcinoom van de pancreas en hadden een WHO-performancestatus van 0 of 1. De behandeling startte binnen 13 weken na de operatie en bestond in de gemcitabinegroep uit gemcitabine 1.000 mg/m2 i.v. op dag 1, 8 en 15 in een cyclus van 4 weken met een maximum van 6 cycli, en in de mFOLFIRINOX-groep uit oxaliplatine 85 mg/m2, leucovorine 400 mg/m2, irinotecan initieel 180 mg/m2 en na aanpassing 150 mg/m2, gevolgd door 5-FU 2.400 mg/m2 in een continu infuus gedurende 46 uur op dag 1 in een cyclus van 2 weken met een maximum van 12 cycli. Het primaire eindpunt van de studie was DFS. OS was een secundair eindpunt. De methoden en kwaliteit van de PRODIGE 24-studie zijn meer in detail beschreven in het beoordelingsverslag van de commissie BOM uit 2019.8
De demografische gegevens van de geïncludeerde patiënten in de mFOLFIRINOX-groep en de gemcitabine-groep waren vergelijkbaar. Te benoemen is dat 43 procent van de patiënten een R1-resectie had ondergaan, de gemiddelde leeftijd 63 jaar was en 51 procent een WHO-performance-status 0 had. Bij de patiënten in de mFOLFIRINOX-groep kwam lymfangio-invasie vaker voor dan bij de patiënten in de gemcitabine-groep (73 versus 63 procent; P = 0,02). De primaire analyse van de PRODIGE 24-studie werd uitgevoerd na het sluiten van de database op 13 april 2018. De mediane follow-up bedroeg op dat moment 33,6 maanden. De analyse toonde een statistisch significant verschil in DFS tussen de mFOLFIRINOX-groep en de gemcitabine-groep, met een HR van 0,58 (95%-BI: 0,46-0,73; P < 0,001). De mediane OS bedroeg 54,4 maanden (95%-BI: 41,8-niet bereikt) in de mFOLFIRINOX-groep en 35,0 maanden (95%-BI: 28,7-43,9) in de gemcitabine-groep (HR: 0,64 [95%-BI: 0,48-0,86]; P = 0,003). De duur van de mediane follow-up was destijds onvoldoende lang om de OS-data volgens de PASKWIL-criteria te kunnen beoordelen. Tijdens het ESMO Congress 2021 zijn data van de PRODIGE 24-studie gepresenteerd na een mediane follow-up van 69,7 maanden. De overleving in de mFOLFIRINOX-groep was significant beter dan de overleving in de gemcitabine-groep (HR: 0,68 [95%-BI: 0,54-0,85]; P = 0,0009). De 5-jaarsoverleving was 43,2 procent (95%-BI: 36,5-49,7) in de mFOLFIRINOX-groep en 31,4 procent (95%-BI: 25,5-37,5) in de gemcitabine-groep. Behandelgroep, inclusievolume van het behandelcentrum, tumorgradering en stadiëring, en leeftijd waren significante prognostische factoren voor OS in de multivariate analyse.
Bijwerkingen van graad 3 of 4 kwamen meer voor in de mFOLFIRINOX-groep (75,9 procent) dan in de gemcitabine-groep (52,9 procent). Neuropathie trad op bij 61 procent van de patiënten behandeld met mFOLFIRINOX. Na 3 jaar hadden 2 patiënten in de mFOLFIRINOX-groep nog aanhoudende oxaliplatinegeïnduceerde neurotoxiciteit. Van de patiënten in de mFOLFIRINOX-groep staakte 34 procent de behandeling voortijdig. Dit was 21 procent in de gemcitabine-groep. Bij respectievelijk 27 en 10 procent was dit vanwege een reden anders dan ziekteprogressie. Data over de veiligheid van adjuvante behandeling met mFOLFIRINOX in de PRODIGE 24-studie zijn meer in detail beschreven in het beoordelingsverslag van de commissie BOM uit 2019.8
Discussie
De ESPAC-4-studie toont bij patiënten met een gereseceerd pancreascarcinoom een significant betere 5-jaarsoverleving na behandeling met 6 kuren gemcitabine-capecitabine dan na behandeling met 6 kuren gemcitabine: respectievelijk 28 en 20 procent (HR: 0,84 [95%-BI: 0,70-0,99]; P = 0,049). Dit resultaat voldoet aan de PASKWIL-criteria voor adjuvante studies voor een positief advies.
De PRODIGE 24-studie toont bij patiënten met een gereseceerd pancreascarcinoom een significant betere 5-jaarsoverleving na behandeling met 12 kuren mFOLFIRINOX dan na behandeling met 6 kuren gemcitabine: respectievelijk 43,2 en 31,4 procent (HR: 0,68 [95%-BI: 0,54-0,85]; P = 0,0009). Ook dit resultaat voldoet aan de PASKWIL-criteria voor adjuvante studies voor een positief advies.
Adjuvante behandeling met gemcitabinecapecitabine is niet in een gerandomiseerde studie vergeleken met adjuvante behandeling met mFOLFIRINOX. Op het eerste oog zou behandeling met mFOLFIRINOX effectiever kunnen lijken dan behandeling met gemcitabine-capecitabine, maar deze indirecte vergelijking kan niet gemaakt worden. De in PRODIGE 24 geïncludeerde populatie is namelijk niet dezelfde als in ESPAC-4. In ESPAC-4 had 61 procent van de patiënten een R1resectie ondergaan tegenover 43 procent in PRODIGE 24. In ESPAC-4 had 42 procent van de patiënten een WHO-performancestatus 0 tegen 51 procent in PRODIGE 24. In ESPAC-4 mochten ook patiënten met een WHO-performance-status 2 worden geïncludeerd (dit betrof slechts 21 patiënten; 3 procent) en in PRODIGE 24 mocht dit niet. Deze verschillen tussen de studiepopulaties illustreren dat indirecte vergelijking van de behandelgroepen uit verschillende studies onzuiver is. Dit blijkt ook uit de uitkomsten van de controlegroepen. De 5-jaarsoverleving in de gemcitabine-groep in PRODIGE 24 is 31 procent, terwijl die van de gemcitabine-groep in ESPAC4 20 procent is, wat overigens realistischer lijkt op basis van de CONKO001- studie (21 procent) en real-world data.1 Daarnaast stopten in de PRODIGE 24-studie minder patiënten voortijdig met de gemcitabine-behandeling dan in de ESPAC-4-studie (21 versus 35 procent), terwijl de incidentie van toxiciteit graad 3 of 4 in de gemcitabine-groep in beide studies vergelijkbaar was (53 procent).
Adjuvante chemotherapie na resectie van een pancreascarcinoom geeft flinke toxiciteit. Zowel in ESPAC-4 als PRODIGE 24 stopt een aanzienlijk deel van de patiënten voortijdig met de adjuvante behandeling om een reden anders dan recidiefziekte, zowel in de experimentelegroep (respectievelijk 41 en 27 procent) als in de gemcitabine-groep (respectievelijk 36 en 10 procent). Bijwerkingen van graad 3 of 4 komen voor bij 53 procent van de patiënten behandeld met gemcitabine, bij 63 procent van de patiënten behandeld met gemcitabine-capecitabine en bij 76 procent van de patiënten behandeld met mFOLFIRINOX. De langetermijntoxiciteit lijkt beperkt.
Kosten
Bij een lichaamsoppervlak van 2,0 m2 kost 1.000 mg/m2 gemcitabine ongeveer 90 euro per toediening (afhankelijk van de fabrikant). De kosten bedragen dan 270 euro per cyclus van 28 dagen en 1.620 euro voor een volledige adjuvante behandeling. Bij een lichaamsoppervlak van 2,0 m2 kost 1.660 mg/m2 capecitabine ongeveer 11 euro per dag (afhankelijk van de fabrikant). De kosten bedragen dan 231 euro per cyclus van 28 dagen en 1.386 euro voor een volledige adjuvante behandeling.
Bij een lichaamsoppervlak van 2,0 m2 kost een cyclus mFOLFIRINOX ongeveer 700 euro (afhankelijk van de fabrikant). De kosten bedragen dan 1.400 euro per 28 dagen en 8.400 euro voor een volledige adjuvante behandeling (bron: medicijnkosten.nl d.d. 22 mei 2022).
Conclusie
Bij patiënten met een macroscopisch radicaal gereseceerd adenocarcinoom van de pancreas geeft adjuvante behandeling met zowel gemcitabine-capecitabine (HR: 0,84 [95%- BI: 0,70-0,99]; P = 0,049) als met mFOLFIRINOX (HR: 0,68 [95%-BI: 0,54-0,85]; P = 0,0009) een betere 5-jaars-overleving dan adjuvante behandeling met alleen gemcitabine: respectievelijk 28 versus 20 procent en 43 versus 31 procent.
Beide behandelingen voldoen aan de PASKWIL-criteria voor adjuvante behandeling voor een positief advies. Er is geen gerandomiseerd onderzoek waarin adjuvante behandeling met gemcitabinecapecitabine wordt vergeleken met mFOLFIRINOX.
Referenties
- Huang L, Balavarca Y, van der Geest L, et al. Development and validation of a prognostic model to predict the prognosis of patients who underwent chemotherapy and resection of pancreatic adenocarcinoma: a large international population-based cohort study. BMC Med 2019;17(1):66. doi: 10.1186/s12916019-1304y.
- Oettle H, Neuhaus P, Hochhaus A, et al. Adjuvant chemotherapy with gemcitabine and long-term outcomes among patients with resected pancreatic cancer: the CONKO001 randomized trial. JAMA 2013;310(14):1473-81. doi: 10.1001/jama.2013.279201
- Neoptolemos JP, Palmer DH, Ghaneh P, et al; European Study Group for Pancreatic Cancer. Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4): a multicentre, open-label, randomised, phase 3 trial. Lancet 2017;389(10073):1011-24. doi: 10.1016/S01406736(16)324096
- Conroy T, Hammel P, Hebbar M, et al; Canadian Cancer Trials Group and the Unicancer-GI–PRODIGE Group. FOLFIRINOX or gemcitabine as adjuvant therapy for pancreatic cancer. N Engl J Med 2018;379(25):2395-406. doi: 10.1056/NEJMoa1809775
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Herbeoordeling: adjuvante therapie met gemcitabine bij curatief geopereerd pancreascarcinoom. Med Oncol 2008;11(5):54-5.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Adjuvant gemcitabine in combinatie met capecitabine bij gereseceerd pancreascarcinoom. Med Oncol 2017;20(4):41-4.
- Neoptolemos JP, Palmer DH, Ghaneh P, et al. ESPAC-4: a multicenter, international, open-label randomized controlled phase III trial of adjuvant combination chemotherapy of gemcitabine (GEM) and capecitabine (CAP) versus monotherapy gemcitabine in patients with resected pancreatic ductal adenocarcinoma: five year follow-up. J Clin Oncol 2020;38(15):suppl 4516. doi: 10.1016/S01406736(16)324096
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Adjuvant aangepast FOLFIRINOX bij het gereseceerd pancreascarcinoom. Med Oncol 2019;22(3):41-4.
- Conroy T, Hammel P, Turpin A, et al. Unicancer PRODIGE 24/CCTG PA6 trial: updated results of a multicenter international randomized phase III trial of adjuvant mFOLFIRINOX (mFFX) versus gemcitabine (gem) in patients (pts) with resected pancreatic ductal adenocarcinomas (PDAC). Ann Oncol 2021;32(S5);S1283-46. doi:10.1016/j.annonc.2021.08.2137