
Inleiding
Jaarlijks wordt in Nederland bij bijna 13.000 patiënten de diagnose niet-kleincellig longcarcinoom (NSCLC) gesteld. Bij ongeveer de helft van de patiënten is er bij diagnose sprake van gemetastaseerde ziekte (2019, DLCA). Bij de diagnose wordt moleculaire diagnostiek verricht om drivermutaties op te sporen. Veranderingen in het epidermal growth factor receptor (EGFR)-gen zijn de meest voorkomende activerende mutaties. Binnen de groep van EGFR-mutaties is ongeveer 12 procent een exon 20-insertie, hetgeen overeenkomt met ongeveer 1 procent van alle longkankers. Een exon 20-insertiemutatie is meestal ongevoelig voor de bekende EGFR-tyrosinekinaseremmers (TKI) door de ontbrekende en veranderde bindingsplaats voor dit ligand. Vanwege deze resistentie is chemotherapie momenteel de eerste keus bij EGFR-exon 20-inserties, waarbij de mediane overleving bij deze mutatie korter is dan die voor andere EGFR-mutaties. Immuuntherapie lijkt, net als bij andere activerende EGFR-mutaties, niet effectief bij een exon 20-insertie.
Amivantamab is een EGFR- en MET-bispecifiek antilichaam dat middels diverse downstream-mechanismen een anti-tumoreffect heeft. In eerder onderzoek gaf amivantamab een responspercentage (ORR) van 40 procent in voorbehandelde NSCLC-patiënten met een exon 20-insertie.1 Ook de combinatie van amivantamab met platinum-doublet chemotherapie was effectief, met mogelijk een synergistisch effect.2 In de hier te bespreken PAPILLON-studie wordt eerstelijns palliatieve behandeling met amivantamab en chemotherapie vergeleken met alleen chemotherapie in patiënten met gemetastaseerd NSCLC met een EGFR-exon 20-insertie.3 EMA heeft de autorisatie van amivantamab uitgebreid met de indicatie als eerstelijnsbehandeling in combinatie met carboplatine en pemetrexed bij volwassenen met gemetastaseerd NSCLC met een activerende EGFR-exon 20-insertiemutatie.
1. Kankersoort en lijn van behandeling
Eerstelijns palliatieve behandeling met amivantamab en chemotherapie werd onderzocht bij patiënten met gevorderd of gemetastaseerd NSCLC met een EGFR-exon 20-insertiemutatie.
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland is momenteel platinum-doublet chemotherapie de standaard eerstelijnsbehandeling voor deze patiënten. Daarmee is de controlegroep in de studie vergelijkbaar met de Nederlandse situatie.
3. Methode en kwaliteit van de studie
De PAPILLON-studie is een internationale, gerandomiseerde fase III-studie (open label) voor eerstelijnsbehandeling van patiënten met gevorderd of gemetastaseerd NSCLC met een EGFR-exon 20-insertie. De belangrijkste inclusiecriteria waren leeftijd boven de 18 jaar, ECOG-performancestatus van 0 of 1, lokaal gevorderd of gemetastaseerd adenocarcinoom van de long en een lokaal aangetoonde activerende EGFR-exon 20-insertiemutatie, bepaald op weefsel of in plasma. Eerdere systeemtherapie voor gemetastaseerde ziekte was niet toegestaan, behalve bij progressie na minder dan 8 weken behandeling met één van de beschikbare EGFR-TKI-medicamenten zoals gefitinib of afatinib. Patiënten met behandelde hersenmetastasen waren toegestaan mits asymptomatisch en ten minste 2 weken zonder behandeling met glucocorticoïden.
Patiënten werden 1:1 gerandomiseerd tussen amivantamab met chemotherapie en chemotherapie alleen. De chemotherapie bestond uit 4 cycli van 21 dagen met op dag 1 van iedere cyclus carboplatine AUC 5 en pemetrexed 500 mg/m2 gevolgd door onderhoudsbehandeling met pemetrexed elke 21 dagen tot progressie of onacceptabele toxiciteit. Amivantamab werd gedurende de eerste 4 weken wekelijks intraveneus gegeven in een dosis van 1400 mg (of 1750 mg bij een gewicht van ≥ 80 kilo), waarbij de eerste dosering van cyclus 1 verdeeld werd over 2 dagen (dag 1 350 mg, dag 2 de resterende dosis). Vanaf dag 1 van cyclus 3 (week 7) werd amivantamab eens per 21 dagen gegeven in een dosering van 1750 mg (of 2100 mg bij een gewicht ≥ 80 kilo). Dosisreductie van zowel de chemotherapie als amivantamab was toegestaan volgens protocol. Bij progressie op chemotherapie was crossover naar amivantamab monotherapie toegestaan. Geplande stratificatiefactoren waren ECOG-performancestatus (0 versus 1), aanwezigheid hersenmetastasen (ja versus nee) en eerdere EGFR-TKI (ja versus nee), waarbij de laatste afviel omdat slechts 4 patiënten voorafgaand behandeld waren. Responsmetingen werden de eerste 18 maanden elke 6 weken en daarna elke 12 weken verricht tot aan progressie en onafhankelijk en geblindeerd beoordeeld volgens RECIST 1.1. Beeldvorming van de hersenen was verplicht bij baseline. Follow-up van hersenen werd gedaan volgens lokale afspraken. Toxiciteit werd beoordeeld volgens CTC-AE 5.0.
Het primaire eindpunt was progressievrije overleving (PFS), centraal en geblindeerd bepaald. De belangrijkste secundaire eindpunten waren responskans (ORR), totale overleving (OS), duur van respons en toxiciteit. Kwaliteit van leven, bepaald met patient reported outcomes (EQ-5D-5L, EORTC-QLQ-C30, PROMIS-PF), was een exploratief eindpunt. Effectiviteits-eindpunten werden bepaald met alle gerandomiseerde patiënten, toxiciteit voor alle behandelde patiënten.
Voor het bepalen van het primaire eindpunt PFS werd berekend dat er 300 patiënten nodig waren voor 200 events, waarbij er 90 procent power was als de werkelijke hazard ratio (HR) 0,625 is, met een tweezijdige alfa van 0,05. Deze HR zou neerkomen op een verbetering van de mediane PFS van 5 maanden met chemotherapie naar 8 maanden met toevoegen van amivantamab. ORR en daarna OS werden hiërarchisch getest met hergebruik van de alfa van 0,05 indien het eindpunt PFS positief was. Ten tijde van de primaire analyse van PFS werd ook een interim-analyse voor OS gepland. Bij een verwacht aantal sterfgevallen van 85 zou voor de interim-analyse van OS een significantieniveau van 0,0008 gebruikt worden volgens de O’Brien-Fleming-methode, zodat bij de eindanalyse van OS 0,0498 zal kunnen worden gebruikt.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen december 2020 en november 2022 werden 542 patiënten gescreend en werden 308 patiënten gerandomiseerd (de belangrijkste reden voor uitval was onbehandelde hersenmetastasen bij 56 patiënten); 153 patiënten in de amivantamabgroep en 155 in de controlegroep. De groepen waren goed gebalanceerd, met een mediane leeftijd van 61 jaar, 56-60 procent was vrouw en 58 procent had nooit gerookt. Van de deelnemers kwam 63 procent uit Azië, 23 procent uit Europa en 9 procent uit Noord-Amerika. 65 procent had ECOG-performancestatus 1 en 23 procent had behandelde hersenmetastasen. De EGFR-exon 20-insertie werd bij 92 procent vastgesteld op een weefselbiopt en bij 8 procent in plasma-DNA.
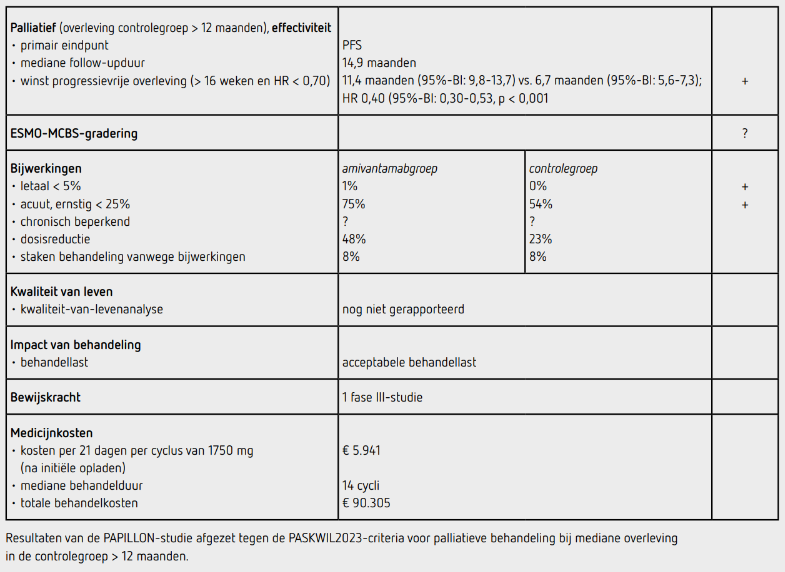
Bij een mediane follow-up van 14,9 maanden was de mediane behandelduur voor amivantamab met chemotherapie 9,7 maanden (14 cycli amivantamab) en voor chemotherapie 6,7 maanden. Bij de data-cutoff op 3 mei 2023 werd nog 46 procent van de patiënten in de amivantamabgroep behandeld en 15 procent in de controlegroep.
De mediane PFS was 11,4 maanden (95%-BI: 9,8-13,7) in de amivantamabgroep en 6,7 maanden (95%-BI: 5,6-7,3) in de controlegroep, met een HR van 0,40 (95%-BI: 0,30-0,53, p < 0,001). Na 18 maanden was 31 procent van de patiënten in de amivantamabgroep progressievrij en in leven en 3 procent in de controlegroep. De mediane PFS zoals beoordeeld door de onderzoeker zelf was met 12,9 maanden versus 6,9 maanden vergelijkbaar, met een HR van 0,38. Het verschil in mediane PFS was zichtbaar in alle vooraf gedefinieerde subgroepen, zoals geslacht, afkomst, aanwezigheid van hersenmetastasen en ECOG-performancestatus. De ORR was 73 procent (95%-BI: 65-80) in de amivantamabgroep en 47 procent (95%-BI: 39-56) in de chemotherapiegroep (RR: 1,50; p < 0,001). De mediane responsduur was 9,7 maanden (95%-BI: 8,2-13,5) in de amivantamabgroep en 4,4 maanden (95%-BI: 4,1-5,6) in de controlegroep, met een mediane tijd tot optreden van respons van respectievelijk 6,7 en 11,4 weken. Ten tijde van de interim-analyse voor OS waren er 70 overlijdens gerapporteerd (33 procent maturiteit). De mediane OS in de amivantamabgroep was niet bereikt, in de controlegroep was de mediane OS 24,4 maanden (95%-BI: 22,1-niet bereikt) met een HR van 0,67 (95%-BI: 0,42-1,09; p = 0,11).
De belangrijkste reden om de behandeling te stoppen was progressie, bij 33 procent in de amivantamabgroep en 69 procent in de controlegroep. Uiteindelijk ontvingen 71 van de 107 patiënten (66 procent) bij progressie op chemotherapie behandeling met amivantamab. 151 patiënten in de amivantamabgroep (98,7 procent) en 155 patiënten in de controlegroep (100 procent) ontvingen ten minste 1 behandeling.
Bijwerkingen van graad 3 of hoger traden op bij 114 patiënten (75 procent) in de amivantamabgroep en bij 83 patiënten (54 procent) in de controlegroep. In de amivantamabgroep waren de meest voorkomende bijwerkingen van graad 3 of hoger neutropenie (33 procent), huiduitslag (11 procent), anemie (11 procent), trombocytopenie (10 procent) en hypokaliëmie (9 procent). In de controlegroep waren de meest voorkomende bijwerkingen van graad 3 of hoger neutropenie (23 procent), anemie (12 procent) en trombocytopenie (10 procent). Infusiereacties werden gezien in 42 procent in de amivantamabgroep en bij 1 procent in de controlegroep. In de amivantamabgroep waren de percentages dosisonderbreking, dosisreductie en staken van een onderdeel van de behandeling 69 procent, 48 procent en 24 procent. Dit was respectievelijk 36 procent, 23 procent en 10 procent in de controlegroep. In beide groepen stopten 12 patiënten (8 procent) met alle middelen vanwege bijwerkingen. 11 procent van de patiënten staakte amivantamab vanwege bijwerkingen. Een overlijden was mogelijk gerelateerd aan amivantamab (hartstilstand bij cardiale tumoringroei).
5. Discussie
In de PAPILLON-studie werd een significante verbetering gevonden van het primaire eindpunt PFS bij amivantamab met chemotherapie ten opzichte van alleen chemotherapie bij patiënten met een NSCLC met een activerende EGFR-exon 20-insertiemutatie. Dit verschil werd in alle vooraf gedefinieerde subgroepen gezien en voldoet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waarin de mediane overleving in de controlegroep langer dan 12 maanden is. De OS-data zijn nog niet matuur. Een aanzienlijk deel van de patiënten in de controlegroep maakte bij progressie gebruik van de mogelijkheid tot behandeling met amivantamab, hetgeen de OS zal beïnvloeden. De respons trad sneller op en duurde langer bij patiënten behandeld met amivantamab dan in de controlegroep.
De bijwerkingen van amivantamab met chemotherapie zijn ernstiger dan van chemotherapie alleen en bestaan naast beenmergtoxiciteit grotendeels uit infusiegerelateerde reacties en huidtoxiciteit. Deze infusiereacties traden echter minder frequent op dan bij eerdere amivantamab-monotherapiestudies, mogelijk door de toediening van glucocorticoïden als anti-emetica bij de chemotherapie. Momenteel wordt een subcutane toedieningsvorm van amivantamab onderzocht, met mogelijk minder acute reacties en minder beslag op de dagbehandeling. De PAPILLON-studie had geen behandelgroep met amivantamab monotherapie, waardoor de optimale sequentie van behandelingen niet duidelijk is.
6. Kosten
De behandeling met amivantamab kost 1188,21 euro per 350 mg (bron: medicijnkosten.nl d.d. 2-8-2024). Het mediane aantal cycli is 14, waarbij tijdens de eerste 4 weken (2 cycli) 4 giften van 1400 mg worden gegeven bij een gewicht minder dan 80 kilo, nadien vervolgd met 1750 mg per cyclus, dus 1400 mg 4x en 1750 mg 12x amivantamab mediaan per patiënt. Dat komt neer op 90.305 euro per patiënt.
De kosten van de chemotherapie zijn min of meer gelijk behalve de iets langere pemetrexed-onderhoudsbehandeling in de amivantamabgroep. De kosten van de crossover naar amivantamab vanuit de controlegroep zijn niet meegenomen in deze berekening.
7. Conclusie
In de hier besproken PAPILLON-studie werd een significante verlenging van het primaire eindpunt PFS gezien met een verschil in de mediaan van 4,7 maanden (11,4 versus 6,7 maanden) met een HR van 0,40 (95%-BI: 0,30-0,53; p < 0,001) ten gunste van amivantamab met chemotherapie voor gemetastaseerd NSCLC met een activerende EGFR-exon 20-insertiemutatie. Dit gaat wel gepaard met meer bijwerkingen. De uitkomsten van deze studie voldoen aan een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waarin de mediane overleving in de controlegroep langer dan 12 maanden is. De kosten van de behandeling zijn aanzienlijk.
Referenties
- Park K, Haura EB, Leighl NB, et al. Amivantamab in EGFR exon 20 insertion mutated non-small-cell lung cancer progressing on platinum chemotherapy: initial results from the CHRYSALIS phase I study. J Clin Oncol 2021;39(30):3391-402.
- Nagasaka M, Goto K, Gomez JE,et al. Amivantamab in combination with chemotherapy in patients with advanced non-small cell lung cancer (NSCLC). Presented at: the 2021 World Conference on Lung Cancer, virtual, September 8, 2021.
- Zhou C, Tang KJ, Cho B, et al. Amivantamab plus chemotherapy in NSCLC with EGFR exon 20 insertions. N Engl J Med 2023;389(22):2039-51.