
Inleiding
Jaarlijks wordt in Nederland bij bijna 13.000 patiënten de diagnose niet-kleincellig longcarcinoom (NSCLC) gesteld. Bij diagnose komt meer dan 40 procent van de patiënten niet meer in aanmerking voor een curatieve behandeling. Daarnaast krijgt 40 tot 50 procent van de patiënten die eerder in opzet curatief zijn behandeld in de loop van de tijd afstandsmetastasen. Ongeveer 10 procent van de patiënten heeft bij diagnose een EGFR-mutatie als primaire oncogene driver. De standaard eerstelijnsbehandeling voor patiënten met gemetastaseerd EGFR-gemuteerd NSCLC is osimertinib.1 Uiteindelijk ontwikkelen alle patiënten hierop resistentie met progressie van ziekte tot gevolg.
In de hier te bespreken MARIPOSA-2-studie wordt het effect van amivantamab, een volledig humaan IgG1 EGFR-MET bispecifiek antilichaam, met chemotherapie bestudeerd na progressie op osimertinib bij patiënten met gemetastaseerd EGFR-gemuteerd NSCLC.2
EMA heeft amivantamab met carboplatine en pemetrexed goedgekeurd voor patiënten met gemetastaseerd NSCLC met een exon 19-deletie of een exon 21 L858R-substitutie na progressie op eerstelijnsbehandeling met een EGFR-tyrosinekinaseremmer. Aan de MARIPOSA-2-studie is een derde arm toegevoegd waarin de combinatie van amivantamab, chemotherapie en lazertinib onderzocht wordt. Lazertinib is een derde-generatie-EGFR-remmer en behoort tot de klasse van osimertinib. Voor deze combinatie is geen EMA-goedkeuring en daarom wordt deze behandelarm in dit rapport buiten beschouwing gelaten.
1. Kankersoort en lijn van behandeling
Palliatieve behandeling met amivantamab en chemotherapie werd onderzocht bij patiënten met gemetastaseerd NSCLC met een algemene EGFR-mutatie (EGFR-exon 21-L858R-substitutie-mutatie of exon 19-deletie) in de tweede of derde lijn na progressie op osimertinib.
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland is bij progressie op osimertinib bij gevorderd stadium NSCLC met een algemene EGFR-mutatie chemotherapie in de vorm van carboplatine en pemetrexed de standaardbehandeling. De controlegroep is dan ook vergelijkbaar met de Nederlandse situatie ten tijde van de studie.
3. Methode en kwaliteit van de studie
De MARIPOSA-2 is een gerandomiseerde, open-label, internationale multicenter fase III-studie voor patiënten met EGFR-gemuteerd NSCLC met progressie op eerste- of tweedelijns behandeling met osimertinib, waarbij osimertinib de meest recente behandeling moest zijn. De belangrijkste inclusiecriteria waren: leeftijd boven de 18 jaar, ECOG-performancestatus van 0 of 1, histologisch of cytologisch bewezen stadium IIIB/IV ziekte (8e IASLC TNM) met een bewezen EGFR-exon 19-deletie of exon 21 L858R-puntmutatie. De EGFR-mutatie moest bewezen zijn middels ctDNA of tumorweefsel in een ISO-gecertificeerd laboratorium. Hersenmetastasen waren toegestaan mits klinisch stabiel en asymptomatisch gedurende minimaal 2 weken voor randomisatie en op 10 mg of minder dagelijks prednisolon. Patiënten met interstitiële longafwijkingen, translocatie van adenocarcinoom naar kleincellige histologie, een andere maligniteit, een verlengde QT-tijd (> 480 msec), ongecontroleerde hypertensie of hartfalen werden geëxcludeerd. Patiënten werden 2:2:1 gerandomiseerd tussen amivantamab met lazertinib en chemotherapie (ALC), alleen chemotherapie, of amivantamab met chemotherapie (AC). De chemotherapie bestond uit 4 cycli carboplatine AUC 5 en pemetrexed 500 mg/m2 intraveneus elke 3 weken, met nadien continueren van pemetrexed tot aan progressie. Amivantamab werd intraveneus toegediend in een dosering van 1400 mg (1750 mg indien ≥ 80 kg) wekelijks gedurende de eerste 4 weken en daarna elke 3 weken in een dosis van 1750 mg (2100 mg indien ≥ 80 kg) tot aan progressie. Er werd gestratificeerd op behandellijn van osimertinib (eerste versus tweede), Aziatisch ras (ja versus nee) en hersenmetastasen (ja versus nee).
Er waren twee primaire eindpunten, namelijk progressievrije overleving (PFS) voor ALC versus chemotherapie en PFS voor AC versus chemotherapie. PFS werd centraal en geblindeerd vastgesteld volgens RECIST 1.1, vanaf randomisatie tot radiologische progressie of overlijden. Secundaire eindpunten waren onder andere objectieve responskans (ORR); responsduur (DoR), overleving (OS) en veiligheid. Responsevaluatie middels CT-scan van thorax, abdomen en pelvis (of blanco CT-thorax en MRI van abdomen en pelvis indien CT niet mogelijk was) vond plaats elke 6 weken in het eerste jaar en daarna elke 12 weken. MRI van de hersenen werd verricht bij randomisatie, na 6 weken, na 12 weken en daarna elke 12 weken.
Om 93 procent power voor de ALC-groep en 83 procent power voor de AC-groep en een geschatte PFS-toename van 5,5 naar 8,5 maanden ten opzichte van chemotherapie te verkrijgen om een hazard ratio (HR) van 0,65 aan te tonen met een tweezijdige alfa van 0,05 waren 350 PFS-events over de drie armen gecombineerd nodig hetgeen bereikt zou worden met de inclusie van 600 patiënten. Voor de vergelijking van ALC met chemotherapie was een alfa van 0,02 gereserveerd en voor de vergelijking van AC met chemotherapie een alfa van 0,03. De secundaire eindpunten zouden hiërarchisch getest worden als beide primaire eindpunten positief waren, met hergebruik van de alfa: eerst de ORR en daarna de OS. Er waren twee interim-analyses op OS gepland in de studie: de eerste interim-analyse (IA1) was gepland ten tijde van de PFS-analyse bij ongeveer 170 overleden patiënten (in de 3 armen). De tweede interim-analyse (IA2) was gepland ongeveer 32 maanden na randomisatie van de eerste deelnemer bij ongeveer 300 overlijdens. De finale OS-analyse wordt verricht 48 maanden na randomisatie van de eerste patiënt, als er ongeveer 400 verwachte overlijdens zijn. De hier gerapporteerde data zijn afkomstig van de finale analyse op het primaire eindpunt PFS (data-cutoff 10 juli 2023). Voor IA1 werd bij een positieve PFS en ORR een alfa van 0,000197 voor OS aangehouden voor de vergelijking van AC met chemotherapie. Op het ESMOcongres van september 2024 werden de resultaten van IA2 gepresenteerd.3 De alfa voor deze vergelijking was 0,0142.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
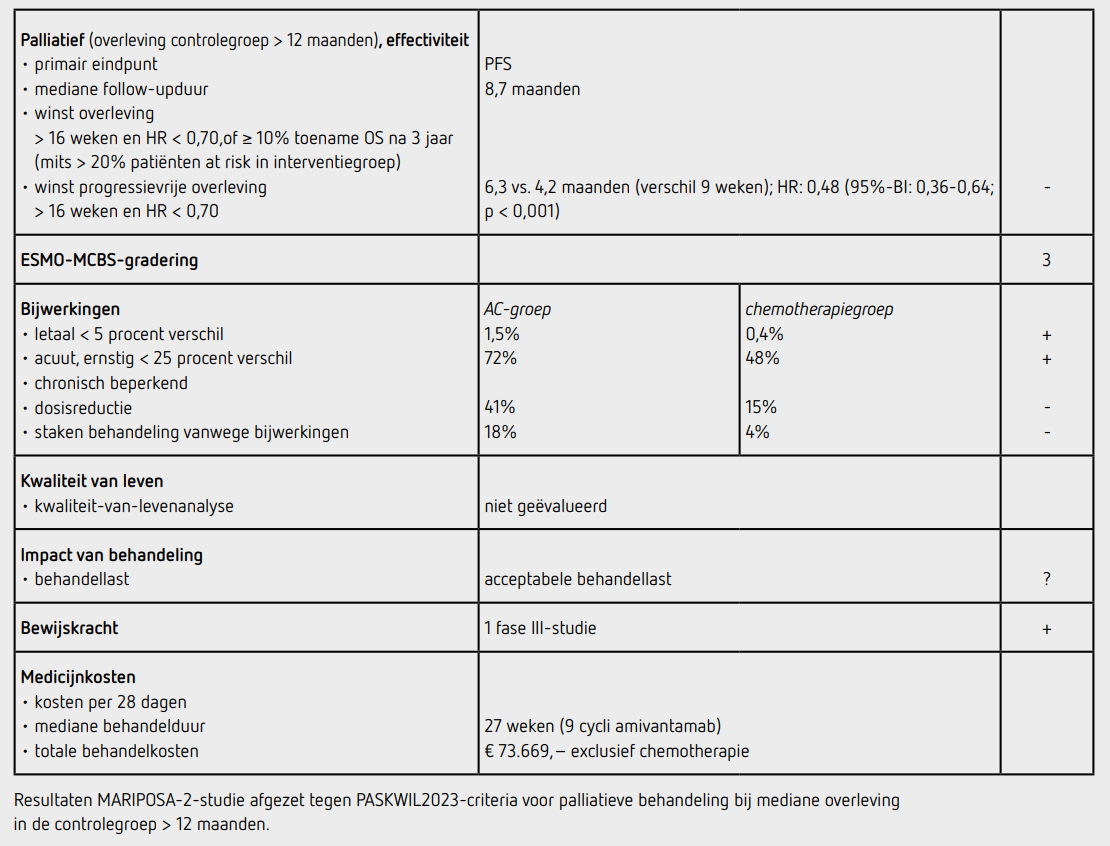
Tussen december 2021 en april 2023 werden 970 patiënten gescreend, waarvan 657 gerandomiseerd werden (131 in de AC-groep, 263 in de ALC-groep en 263 in de chemotherapiegroep). De patiëntkarakteristieken waren vergelijkbaar in de groepen. De mediane leeftijd was 62 jaar, 38 procent was man, 34 procent was (ex-)roker, de ECOG-performancestatus was 0 in 40 procent, 50 procent was Aziatisch en 45 procent had hersenmetastasen. Circa 67 procent van de patiënten had een EGFR exon 19-deletie. Osimertinib was bij 71 procent als eerste lijn gegeven. De mediane follow-up ten tijde van de analyse voor PFS was 8,7 maanden. De mediane PFS was 6,3 maanden (95%-BI: 5,6-8,4) voor patiënten in de AC-groep en 4,2 maanden (95%-BI: 4,0-4,4) voor patiënten in de chemotherapiegroep. De PFS was statistisch significant langer in de AC-groep dan in de chemotherapiegroep met een HR van 0,48 (95%-BI: 0,36-0,64; p < 0,001). Het PFS-verschil was consistent in vooraf gedefinieerde subgroepen inclusief hersenmetastasen, behandellijn en EGFR-mutatietype. ORR was 64 procent (95%-BI: 55-72) voor AC en 36 procent (95%-BI: 30-42) voor chemotherapie (odds ratio: 3,10 [95%-BI: 2,00-4,80; p < 0,001]).
Op het moment van IA1 was de HR voor OS 0,77 (95%-BI: 0,49-1,21) voor AC versus chemotherapie. Ten tijde van IA2 bedroeg de mediane follow-upduur 18,1 maanden. Er waren 65 patiënten (50 procent) in de AC-groep en 143 (54 procent) in de chemotherapiegroep overleden. De mediane OS bedroeg respectievelijk 17,7 maanden (95%-BI:16,0-22,4) en 15,3 maanden (95%-BI: 13,7-16,8) met een HR voor OS van 0,73 (95%-BI: 0,54-0,99;p = 0,039). Dit verschil was niet statistisch significant. De mediane intracraniale PFS was 12,5 maanden (95%-BI: 10,8niet bereikt) voor de AC-groep en 8,3 maanden (95%-BI: 7,3-11,3) voor de chemotherapiegroep met een HR van 0,55 (95%BI: 0,38-0,79).
De mediane duur van de behandeling was 6,3 maanden voor AC en 3,7 maanden voor chemotherapie. 130 patiënten (99 procent) in de AC-groep kregen ten minste 1 behandeling. Dosisonderbrekingen, -verlagingen en -stopzettingen als gevolg van bijwerkingen kwamen voor bij respectievelijk 84 (65 procent), 53 (41 procent ) en 24 (18 procent) patiënten. Bijwerkingen van graad 3 of hoger werden gerapporteerd bij 94 patiënten (72 procent) in de AC-groep. De meest voorkomende bijwerkingen van graad 3 of hoger waren neutropenie (45 procent), trombopenie (15 procent) en anemie (12 procent). Huiduitslag kwam voor bij 71 procent van de patiënten, waarvan bij 10 procent van graad 3 of hoger. 10 procent van de patiënten kreeg een veneuze trombo-embolie. 2 patiënten (1,5 procent) zijn overleden aan de behandeling. 243 patiënten (92 procent) in de chemotherapiegroep kregen ten minste 1 behandeling. Dosisonderbrekingen, -verlagingen en -stopzettingen als gevolg van bijwerkingen kwamen voor bij respectievelijk 81 (33 procent), 37 (15 procent) en 9 (4 procent) patiënten behandeld met chemotherapie. Bijwerkingen van graad 3 of hoger werden gerapporteerd bij 117 patiënten (48 procent) in de chemotherapiegroep. De meest voorkomende bijwerkingen van graad 3 of hoger waren neutropenie (21 procent), trombopenie (9 procent) en anemie (9 procent). Huiduitslag kwam voor bij 12 procent en bij niemand was dit graad 3 of hoger. Veneuze trombo-embolie kwam voor bij 5 procent van de patiënten. 1 patiënt (0,4 procent) is overleden aan de behandeling.
5. Discussie
In de MARIPOSA-2-studie werd een statistisch significante toename van mediaan 9 weken (6,3 versus 4,2 maanden) gevonden in het primaire eindpunt PFS na progressie op osimertinib van behandeling met amivantamab en chemotherapie ten opzichte van chemotherapie alleen (HR: 0,48 [95%-BI: 0,36-0,64]; p < 0,001). Dit verschil voldoet niet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling met mediane overleving in de controlegroep > 12 maanden. In IA2 werd nog geen statistisch significant overlevingsvoordeel aangetoond, maar de finale OS-analyse moet nog volgen. Er werd in deze studie ook nog een combinatie gegeven van amivantamab met chemotherapie en lazertinib, maar hier is geen EMA-goedkeuring voor en deze behandelarm wordt derhalve hier niet besproken.
De toevoeging van amivantamab aan chemotherapie leidt tot een aanzienlijke toename van de toxiciteit, met name beenmergtoxiciteit. Ook huiduitslag en veneuze trombo-embolieën werden vaker gezien bij patiënten behandeld met AC dan met chemotherapie. In de chemotherapiegroep heeft 8 procent van de patiënten geen behandeling gekregen, mogelijk omdat ze zich hebben teruggetrokken na loten voor de behandelgroep zonder amivantamab. Concluderend lijkt het voordeel van toevoeging van amivantamab aan chemotherapie na progressie op osimertinib bij EGFR-gemuteerd NSCLC beperkt. Of amivantamab met lazertinib in eerste lijn voordeel biedt boven behandeling met osimertinib wordt onderzocht in de MARIPOSA-studie. Voor de tweede lijn na progressie op osimertinib blijft chemotherapie de aangewezen behandeling.
6. Kosten
De behandeling met amivantamab kost 23.764 euro in de eerste 4 weken voor patiënten met een gewicht van 80 kg of hoger. Bij een mediaan van 9 cycli amivantamab komen de totale kosten van amivantamab op 73.669 euro (bron: medicijnkosten.nl d.d. februari 2025). Dit is exclusief de kosten van chemotherapie.
7. Conclusie
In de hier besproken MARIPOSA-2-studie wordt een toename van de mediane PFS van 9 weken met een HR van 0,48 gevonden bij behandeling met amivantamab met chemotherapie vergeleken met chemotherapie alleen bij patiënten met een EGFR-gemuteerd NSCLC na progressie op osimertinib. Hiermee voldoet deze studie niet aan de PASKWIL2023-criteria voor palliatieve behandeling met overleving in de controlegroep > 12 maanden voor een positief advies.
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Osimertinib als eerstelijns behandeling voor patiënten met EGFR-gemuteerd niet-kleincellig longcarcinoom. Med Oncol 2018;21(7):57-60.
- Passaro A, Wang J, Wang Y et al. Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: Primary results from the phase III MARIPOSA-2 study. Ann Oncol 2024;35(1):77-90.
- Popat S, Reckamp KL, Califano R et al. Amivantamab plus chemotherapy vs chemotherapy in EGFR mutated, advanced non-small cell lung cancer after disease progression on osimertinib: Second interim overall survival from MARIPOSA-2. Ann Oncol 2024;35;Suppl2:1244-5.