
Inleiding
Een activerende epidermale-groeifactorreceptormutatie (EGFR-mutatie) komt voor bij ongeveer 10-12 procent van de patiënten met een niet-kleincellig longcarcinoom (NSCLC). Binnen de groep van EGFR-mutaties komen de L858R-puntmutatie en de exon 19-deletie het meest voor, in 85-90 procent van alle EGFR-mutaties.
De huidige behandeling voor gemetastaseerd EGFR-gemuteerd NSCLC met één van deze mutaties is de derdegeneratietyrosinekinaseremmer (TKI) osimertinib, al dan niet gecombineerd met chemotherapie. In de respectievelijke FLAURA- en FLAURA2-studies gaf osimertinib als monotherapie een progressievrije overleving (PFS) van mediaan 19 maanden en totale overleving (OS) van 39 maanden en in combinatie met chemotherapie een PFS van mediaan 26 maanden (OS nog niet matuur).1,2
Amivantamab is een EGFR- en MET-bispecifiek antilichaam dat middels diverse downstream mechanismen een antitumoreffect heeft. In eerder onderzoek had amivantamab samen met chemotherapie een PFS van 6,3 maanden ten opzichte van 4,2 maanden met alleen chemotherapie na progressie op osimertinib in de MARIPOSA-2-studie.3 Dit verschil voldeed niet aan de PASKWIL-criteria voor een positief advies.4 Lazertinib is een selectieve derdegeneratie-EGFR-TKI met ook een goede hersenpenetratie, met een PFS van 20,6 maanden als eerstelijnsbehandeling in de LASER301-studie.5 In de fase I-studie CHRYSALIS werd een objectief responspercentage van 100 procent en een mediane PFS van ruim 33 maanden gezien bij behandeling met de combinatie van amivantamab en lazertinib.6 In de hier te bespreken MARIPOSA-studie wordt eerstelijnsbehandeling met amivantamab en lazertinib vergeleken met osimertinib bij EGFR-gemuteerd NSCLC.7 EMA heeft amivantamab goedgekeurd als eerstelijnstherapie in combinatie met lazertinib bij patiënten met een gemetastaseerd NSCLC met een EGFR exon 19-deletie of een exon 21 L858R-mutatie.
Kankersoort en lijn van behandeling
Eerstelijns palliatieve behandeling met amivantamab en lazertinib werd onderzocht bij patiënten met gevorderd of gemetastaseerd NSCLC met een EGFR exon 21 L858R-mutatie of exon 19-deletie.
Vergelijking met de referentiebehandeling in Nederland
In Nederland is momenteel osimertinib monotherapie de standaard eerstelijnsbehandeling voor patiënten met een NSCLC met een EGFR exon 21 L858R-mutatie of exon 19-deletie. Hiermee is de controlegroep vergelijkbaar met de Nederlandse situatie.
Methoden van de studie
De MARIPOSA-studie is een internationale gedeeltelijk open label, gerandomiseerde fase III-multicenterstudie voor patiënten met gevorderd of gemetastaseerd NSCLC. De belangrijkste inclusiecriteria waren: leeftijd boven de 18 jaar, ECOG-performancestatus van 0 of 1, lokaal gevorderde of gemetastaseerd adenocarcinoom en een lokaal aangetoonde EGFR exon 21 L858R-mutatie of exon 19-deletie, bepaald op weefsel of in plasma. Eerdere systeemtherapie voor gemetastaseerde ziekte was niet toegestaan. Hersenmetastasen waren toegestaan, mits asymptomatisch of behandeld en vervolgens minstens 2 weken stabiel met maximaal 10 mg prednisolon per dag (of een equivalent hiervan).
Patiënten werden 2:2:1 gerandomiseerd tussen amivantamab en lazertinib, osimertinib monotherapie en lazertinib monotherapie. Amivantamab werd gedurende de eerste 4 weken wekelijks intraveneus gegeven in een dosis van 1050 mg (of 1400 mg bij een gewicht van > 80 kg), waarbij de eerste dosis van cyclus 1 in 2 dagen werd toegediend (350 mg op dag 1 en de rest op dag 2). Na de eerste 4 toedieningen werd amivantamab eens per 14 dagen in dezelfde dosering gegeven. Osimertinib 80 mg of lazertinib 240 mg werd dagelijks oraal ingenomen. Amivantamab werd open-label toegediend en osimertinib of lazertinib werd dubbelblind gegeven. Dosisreductie en onderbreking van alle middelen was toegestaan volgens protocol. Stratificatiefactoren waren type EGFR-mutatie (exon 21 L858R-mutatie versus exon 19-deletie), aanwezigheid van hersenmetastasen (ja versus nee) en Aziatische afkomst (ja versus nee). Responsmetingen middels CT- of MRI-scan werden gedurende de eerste 30 maanden elke 8 weken verricht en daarna elke 12 weken tot aan ziekteprogressie. Beeldvorming van de hersenen met MRI was verplicht bij inclusie. Follow-up van hersenen werd gedaan bij aanwezigheid van hersenmetastasen op alle momenten van de responsmeting; bij afwezigheid van hersenmetastasen elke 24 weken. Toxiciteit werd beoordeeld volgens CTC-AE 5.0.
Het primaire eindpunt van de studie was PFS van de amivantamab-lazertinibgroep ten opzichte van de osimertinibgroep, onafhankelijk en geblindeerd beoordeeld volgens RECIST 1.1. Secundaire eindpunten waren OS, verschil in PFS tussen amivantamab en lazertinib en lazertinib monotherapie, het percentage objectieve respons (ORR), responsduur en toxiciteit. Kwaliteit van leven bepaald met patient reported outcomes was een exploratief eindpunt. Crossover na progressie was niet toegestaan.
Voor het bepalen van het primaire eindpunt PFS waren er 800 patiënten en 450 events nodig in de amivantamab-lazertinibgroep en de osimertinibgroep, waarbij er 90 procent power was om met een tweezijdige alfa van 0,05 een verschil aan te tonen als de hazard ratio (HR) 0,73 is. Deze HR zou dan neerkomen op een verbetering van mediane PFS van 19 maanden met osimertinib naar 26 maanden met amivantamab en lazertinib. Er waren 2 interim-analyses voor PFS gepland: een futiliteitsanalyse na 120 PFS-events en een superioriteitsanalyse na 280 PFS-events. Voor de finale PFS-analyse resteerde een alfa van 0,0472. Hoewel de IDMC adviseerde om de studie te deblinderen bij de tweede interim-analyse heeft het studieteam besloten om de studie te continueren en blindering te handhaven totdat het aantal benodigde PFS-events voor de finale analyse bereikt was. Als de analyse van de primaire uitkomstmaat positief was werd op dat moment ook een interim-analyse voor OS gedaan, nadat in totaal 270 patiënten in de amivantamablazertinibgroep en osimertinibgroep overleden waren. Hiervoor werd een tweezijdige alfa van 0,0140 gealloceerd. De finale OS-analyse was gepland nadat 390 patiënten overleden waren en hiervoor resteerde een alfa van 0,0484.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen november 2020 en mei 2022 werden 1375 patiënten gescreend en werden 1074 patiënten gerandomiseerd, 429 in de amivantamab-lazertinibgroep, 429 in de osimertinibgroep en 216 in de lazertinibgroep. De groepen waren goed gebalanceerd, met een mediane leeftijd van 64 jaar, 61 procent vrouw, 70 procent had nooit gerookt. 59 procent van de deelnemers kwam uit Azië en 38 procent was Kaukasisch. Twee derde had een ECOG-performancestatus 1, 40 procent hersenmetastasen en 97 procent een adenocarcinoom. De EGFR-mutatie was in 60 procent een exon 19-deletie en in 40 procent een exon 21 L585R-mutatie.
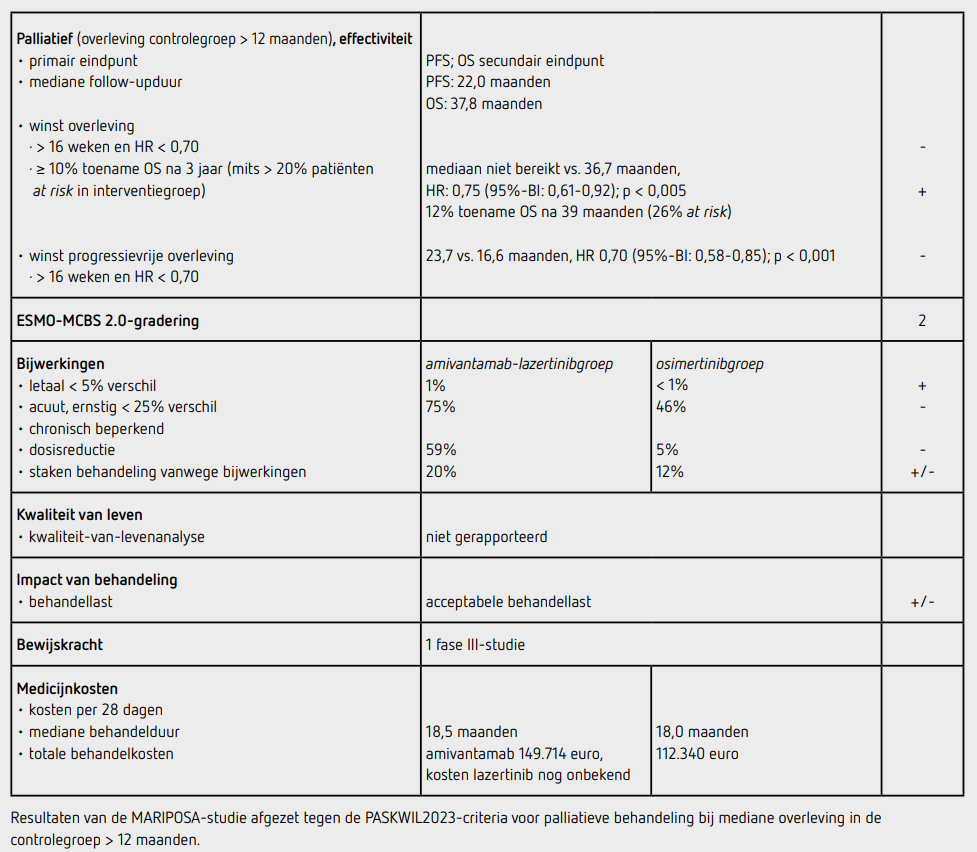
Bij een mediane follow up van 22,0 maanden was de mediane behandelduur voor amivantamab en lazertinib 18,5 maanden, die voor osimertinib 18,0 maanden. De mediane PFS was 23,7 maanden (95%-BI: 19,1-27,7) in de amivantamab-lazertinibgroep en 16,6 maanden (95%-BI: 14,818,5) in de osimertinibgroep, met een HR van 0,70 (95%-BI: 0,58-0,85; p < 0,001). De mediane PFS is de lazertinibgroep was 18,5 maanden (95%-BI: 14,8-20,1). De HR voor PFS in de lazertinib-amivantamabgroep vergeleken met de lazertinibgroep was 0,72 (95%-BI: 0,57-0,90). De verbeterde PFS van amivantamab en lazertinib ten opzichte van osimertinib was consistent in alle vooraf gedefinieerde subgroepen, inclusief de aanwezigheid van hersenmetastasen, etniciteit en type EGFR-mutatie.
De ORR was 86 procent in de amivantamab-lazertinibgroep en 85 procent in de osimertinibgroep. De mediane responsduur was 25,8 maanden in de amivantamab-lazertinibgroep en 16,8 maanden in de osimertinibgroep.
Tijdens het European Lung Cancer Congress (ELCC) in maart 2025 werden de finale OS-data gepresenteerd nadat 390 patiënten overleden waren, 173 in de amivantamab-lazertinibgroep en 217 in de osimertinibgroep, bij een mediane follow-up van 37,8 maanden.8 De mediane OS was niet bereikt (95%-BI: 42,9 maanden-niet bereikt) in de amivantamab-lazertinibgroep en 36,7 maanden (95%-BI: 33,4-41,0) in de osimertinibgroep. Het verschil in OS was statistisch significant (HR: 0,75 [95%-BI: 0,61-0,92]; p < 0,005). Na 36 maanden waren 168 patiënten in de amivantamab-lazertinibgroep (39,2 procent) at risk, waarbij de OS 60 procent was in amivantamab-lazertinibgroep en 51 procent in de osimertinibgroep (9 procent verschil). Na 42 maanden waren er 61 patiënten (14,2 procent) at risk in de amivantamab-lazertinibgroep, waarbij de OS 56 procent was in de amivantamab-lazertinibgroep en 44 procent in de osimertinibgroep (12 procent verschil). Na 39 maanden was het laatste moment waarop nog ten minste 20 procent van de patiënten in de amivantamab-lazertinibgroep at risk was. Op dit moment waren 111 patiënten beschikbaar voor analyse (25,9 procent). De OS op 39 maanden wordt niet gerapporteerd. Grondige visuele analyse van de curves, door verschillende personen en onafhankelijk van elkaar verricht, laat op dat tijdpunt een verschil in OS zien van 12 procent tussen de groepen. Hierbij moet enige onnauwkeurigheid in acht worden genomen als gevolg van het ontbreken van de ruwe cijfers.
De subgroepanalyse van OS laat zien dat het effect van amivantamab en lazertinib het grootst lijkt bij patiënten jonger dan 65 jaar (HR: 0,53), bij aanwezigheid van hersenmetastasen (HR: 0,67) en bij patiënten met een exon 19-deletie (HR: 0,66). In de amivantamab-lazertinibgroep kregen 421 patiënten (98 procent) ten minste één dosis medicatie en in de osimertinibgroep waren dit 428 patiënten (100 procent). Bijwerkingen van graad 3 of hoger werden gezien bij 316 patiënten (75 procent) in de amivantamab-lazertinibgroep en bij 183 patiënten (43 procent) in de osimertinibgroep. In de amivantamab-lazertinibgroep waren de meest voorkomende bijwerkingen van graad 3 of hoger paronychia (11 procent), infusiereacties (6 procent) en huiduitslag (15 procent). In de osimertinibgroep kwamen geen bijwerkingen van graad 3 of hoger bij minimaal 10 procent van de patiënten voor. Een opvallende bijwerking was longembolieën bij 17 procent van de patiënten in de amivantamab-lazertinibgroep, waarvan dit bij 8 procent van graad 3 of hoger was. In de osimertinibgroep kwam bij 5 procent longembolieën voor, waarvan bij 2 procent van graad 3 of hoger. Circa twee derde van de longembolieën in de amivantamab-lazertinibgroep ontstond in de eerste 4 maanden van de behandeling, terwijl dit in de osimertinibgroep vaak later optrad. In beide groepen ontwikkelde 3 procent een pneumonitis, waarvan bij 1 procent van graad 3. Er zijn 4 patiënten (1 procent) in amivantamab-lazertinibgroep overleden als gevolg van de behandeling en 2 patiënten (< 1 procent) in de osimertinibgroep.
In de amivantamab-lazertinibgroep stopte 20 procent van de patiënten met de hele behandeling vanwege bijwerkingen en bij 35 procent was 1 van de middelen vanwege bijwerkingen gestaakt. Een dosisreductie kwam voor bij 59 procent. In de osimertinibgroep stopte 12 procent de behandeling vanwege bijwerkingen en was bij 5 procent sprake van een dosisreductie. In de amivantamab-lazertinibgroep kregen 129 van de 175 patiënten (74 procent) na progressie een volgende lijn behandeling, waarvan dit bij 39 procent een TKI was. In de osimertinibgroep kregen 195 van de 258 patiënten (76 procent) na progressie een volgende lijn behandeling, waarvan dit bij 28 procent een TKI was.
Kwaliteit van de studie en interpretatie van de uitkomsten
Er is sprake van een goed uitgevoerde en gerandomiseerde studie naar het primaire eindpunt, waar over de arm met lazertinib monotherapie niet veel gepubliceerd is. Over de toegevoegde waarde van amivantamab aan lazertinib ten aanzien van de effectiviteit en toxiciteit zijn nog alleen indirecte data om de vraag te beantwoorden wat de toegevoegde waarde van amivantamab is in deze setting.
Omdat cross-over niet is toegestaan blijft bovendien onduidelijk wat de effectiviteit is van amivantamab met lazertinib in de eerste lijn ten opzichte van osimertinib in de eerste lijn gevolgd door amivantamab en lazertinib in de tweede lijn. De studie is deels geblindeerd. Dit kan invloed hebben gehad op de primaire uitkomst PFS. Dit zal minder van invloed zijn geweest op het secundaire eindpunt OS.
Discussie
In de MARIPOSA-studie wordt een statistisch significant verschil gevonden in het primaire eindpunt PFS bij eerstelijnsbehandeling met amivantamab en lazertinib ten opzichte van osimertinib bij patiënten met een NSCLC met een EGFR exon 21 L858R-mutatie of exon 19-deletie. Met een verschil in mediane PFS van 7 maanden en een HR van 0,70 voldoet dit verschil net niet aan de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep > 12 maanden. De OS is ook statistisch significant langer in de amivantamablazertinibgroep dan in de osimertinibgroep. In 2024 is het zogenoemde staartcriterium aan de PASKWIL-criteria toegevoegd. Om op basis van het staartcriterium tot een positief advies te komen dient het OS-verschil na ten minste 3 jaar (bij mediane OS in de controlegroep langer dan 12 maanden) ten minste 10 procent te zijn bij minimaal 20 procent van de patiënten at risk in de experimentele groep. Bij visuele inspectie bedraagt het verschil tussen de beide groepen 12 procent op tijdpunt 39 maanden waarbij 26 procent van de patiënten in de amivantamab-lazertinibgroep nog at risk is. Op basis hiervan komt cieBOM tot een positief advies volgens de PASKWIL2024-criteria voor palliatieve behandeling waarbij de overleving in de controlegroep langer dan 12 maanden is. Dit verschil werd in alle vooraf gedefinieerde subgroepen gezien maar lijkt het meest uitgesproken in de subgroepen jonger dan 65 jaar, bij aanwezigheid van hersenmetastasen en bij een exon 19-deletie.
De frequentie van graad 3 of hogere bijwerkingen bij amivantamab en lazertinib is hoger dan bij osimertinib en komen grotendeels op het conto van infusiereacties en huidtoxiciteit. Het percentage patiënten dat met de behandeling stopt was met 20 procent ook hoger dan bij osimertinib. In dit verband zijn ook de kwaliteit van leven-uitkomsten van belang die helaas nog niet gepubliceerd zijn. De subcutane toedieningsvorm van amivantamab wordt momenteel onderzocht, met mogelijk minder infusiereacties, trombose en ook huiduitslag en minder beslag op dagbehandeling.9 Opvallend was het hoge percentage longembolieën in de amivantamab-lazertinibgroep, meestal in de eerste 4 maanden. Dit is goed behandelbaar met antistolling en leidde niet vaak tot staken van therapie. Mogelijk wordt het verklaard door de trombogene status bij snelle tumorlyse. In de volgende studies met deze combinatie wordt dan ook gedurende de eerste 4 maanden profylactische antistolling aanbevolen.
De MARIPOSA-studie had ook een arm met alleen lazertinib. Hoewel dit helaas niet statistisch getoetst is, lijken de PFS van lazertinib monotherapie en osimertinib niet belangrijk verschillend. De verbetering in PFS van de combinatie van amivantamab en lazertinib lijkt dan ook grotendeels op conto te zijn van amivantamab, mogelijk doordat de resistentievorming tegen een TKI vertraagd wordt. Dit gaat echter wel ten koste van beduidend meer toxiciteit en hogere kosten.
Inmiddels zijn ook de resultaten van de FLAURA2-studie bekend waarbij chemotherapie toegevoegd aan osimertinib resulteert in een langere PFS.2 Hoe de effectiviteit van osimertinib met chemotherapie zich verhoudt tot amivantamab en lazertinib is onduidelijk en zal door de richtlijncommissie geadresseerd worden.
Kosten
De behandeling met amivantamab kost 1188 euro per 350 mg. Per gift wordt (bij een gewicht < 80 kilo) 1050 mg gegeven, de eerste 4 weken wekelijks, daarna 2-wekelijks. Bij een mediane behandelduur van 18,5 maanden worden er 42 giften gegeven. Dat komt neer op 149.714 euro per behandeling met amivantamab.
De prijs van lazertinib is nog niet bekend.
Osimertinib kost 205 euro per tablet van 80 mg, bij een mediane behandelduur van 18 maanden komt dat neer op 112.340 euro (bron: medicijnkosten.nl; d.d. juni 2025).
Conclusie
In de hier besproken MARIPOSA-studie wordt een significante verlenging van het primaire eindpunt PFS gezien van 7,1 maanden met een HR van 0,70 ten gunste van amivantamab en lazertinib ten opzichte van eerstelijnsbehandeling met osimertinib bij patiënten met gemetastaseerd NSCLC met een EGFR-mutatie. Na 39 maanden is nog meer dan 20 procent van de experimentele groep at risk en bedraagt het verschil in OS meer dan 10 procent. Dit verschil voldoet aan een positief advies op basis van de PASKWIL2024-staartcriteria. De combinatie amivantamab en lazertinib is echter wel toxischer en de kosten zijn erg hoog.
Referenties
- Soria JC, Ohe Y, Vansteenkiste J et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018;378(2):113-25.
- Planchard D, Janne PA, Cheng Y et al. Osimertinib with or without chemotherapy in EGFR-mutated advanced NSCLC. N Engl J Med 2023;389(21):1935-48.
- Passaro A, Wang J, Wang Y et al. Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. Ann Oncol 2024;35(1):77-90.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Amivantamab en chemotherapie bij EGFR-gemuteerd gemetastaseerd niet-kleincellig longcarcinoom na progressie op osimertinib. Med Oncol 2025;28(7):35-9.
- Cho BC, Ahn M-J, Kang JH et al. Lazertinib versus gefitinib as first-line treatment in patients with EGFR-mutated advanced non-small cell lung cancer (NSCLC): results from LASER301. J Clin Oncol 2023;41(26):4208-17.
- Lee S-H, Cho BC, Han J-Y et al. Amivantamab and lazertinib in treatment-naïve EGFR-mutated advanced non–small cell lung cancer (NSCLC): long-term follow-up and ctDNA results from CHRYSALIS. J Clin Oncol 2023;41(16suppl):9134.
- Cho BC, Lu S, Felip AI et al. Amivantamab plus lazertinib in previously untreated EGFR-mutated advanced NSCLC. N Eng J Med 2024;391(16):1486-98.
- Yang JC, Kim YJ, Lee S-H et al. Amivantamab plus lazertinib vs osimertinib in first-line (1L) EGFR-mutant (EGFRm) advanced NSCLC: Final overall survival (OS) from the phase III MARIPOSA study J Thorac Oncol 2025;20(3 suppl):S6-8.