Inleiding
In 2019 en 2020 beoordeelde de commissie BOM drie studies waarin patiënten met niet-gemetastaseerd castratieresistent prostaatcarcinoom (nmCRPC) werden gerandomiseerd tussen androgeendeprivatietherapie (ADT) en ADT en een antiandrogeen van de tweede generatie (apalutamide, darolutamide en enzalutamide).1-2 Het primaire eindpunt van deze studies was metastasevrije overleving (MFS). Door dit ongebruikelijke eindpunt van de studies en het ontbreken van mature data over de totale overleving (OS), konden deze destijds niet volgens de PASKWIL-criteria beoordeeld worden.
Recent zijn van deze drie studies aanvullende resultaten met OS-data gepubliceerd.3-5 Dit rapport is een aanvullende beoordeling van de nieuw gepubliceerde resultaten. Er is een EMA-autorisatie voor apalutamide, darolutamide en enzalutamide voor de behandeling van volwassen mannen met nmCRPC met een hoog risico op het ontwikkelen van metastasen.
1. Kankersoort en lijn van behandeling
In dit rapport worden de gerandomiseerde fase III-studies SPARTAN (apalutamide), ARAMIS (darolutamide) en PROSPER (enzalutamide) besproken. Deze studies zijn vergelijkbaar van opzet en evalueerden de toegevoegde waarde van respectievelijk apalutamide, darolutamide en enzalutamide, toegevoegd aan ADT, op de MFS bij mannen met een nmCRPC en een PSA-verdubbelingstijd van minder dan 10 maanden. Secundair eindpunt van deze studies was (onder andere) OS.
2. Vergelijking met de referentiebehandeling in Nederland
De huidige standaardbehandeling in Nederland voor patiënten met nmCRPC en een oplopend PSA zonder klachten is een expectatief beleid. De tijd tot ontwikkelen van metastasen kan meerdere jaren duren en bij vroegtijdige behandeling kunnen patiënten langdurig blootgesteld worden aan een behandeling met bijwerkingen.
Vroege behandeling met ADT heeft geen bewezen overlevingsvoordeel. 6 In Nederland komt slechts een zeer gering aantal patiënten met niet-gemetastaseerd hormoongevoelig prostaatcarcinoom in aanmerking voor ADT. Dit maakt dat de toepasbaarheid van deze studies voor de Nederlandse praktijk zeer beperkt is.
3. Methode en kwaliteit van de studie
De in- en exclusiecriteria en procedures van de studies zijn eerder beschreven.1-2 Alle patiënten, zowel in de placebogroepen als in de interventiegroepen, werden behandeld met ADT of hadden een orchidectomie ondergaan. Om radiologisch aantoonbare metastasen uit te sluiten kregen alle patiënten vooraf een botscan en CT- of MRI-scan. Er werd geen PSMA-PET-scan gemaakt, wat in de huidige Nederlandse praktijk wel gebruikelijk is. Daarmee zal in de Nederlandse praktijk het aantal patiënten dat voldoet aan de inclusie-criteria van de nu besproken studies nog verder afnemen. Data over vervolgbehandelingen zijn in alle drie de studies goed beschreven.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
SPARTAN-studie: apalutamide
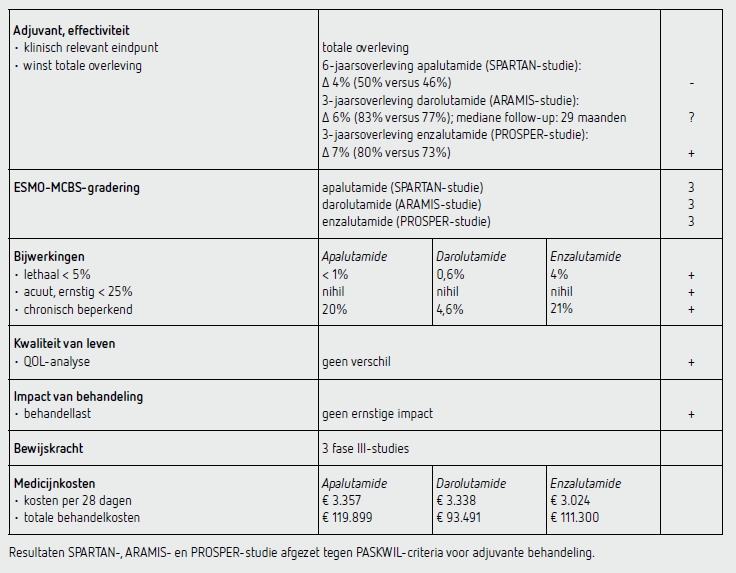
In de update was sprake van een mediane follow-up van 52 maanden. De mediane behandelduur was 32,9 maanden in de apalutamide-groep en 11,5 maanden in de placebogroep. Nadat in de finale analyse van het primaire eindpunt MFS een voordeel voor apalutamide werd aangetoond, werd de studiemedicatie gedeblindeerd. 19 procent van de patiënten in de placebogroep gebruikte nog het placebo. Vanaf deblindering werd de behandeling omgezet naar apalutamide. De mediane OS bedroeg 73,9 maanden in de apalutamide-groep en 59,9 maanden in de placebogroep (HR: 0,78 [95%-BI: 0,64-0,95]; P = 0,016). Volgens het statistisch plan was een P lager dan 0,046 benodigd voor significantie. Behandeling na progressie werd gegeven aan 46 procent van de patiënten in de apalutamide-groep en aan 84 procent van de patiënten in de placebogroep (waarvan 19 procent apalutamide na deblindering). Een OS-analyse na 6 jaar toonde een verschil van 4 procent: 46 procent in de intention-to-treatgroep (ITT-groep) voor placebo en 50 procent in de apalutamide-groep.
Bijwerkingen worden in de update van deze studie summier beschreven. Bijwerkingen die leidden tot het stoppen van de studiemedicatie traden op bij 122 patiënten (15 procent) in de apalutamide-groep en bij 27 patiënten (8,4 procent) in de placebogroep. Ernstige bijwerkingen (graad 3-4) traden op bij 56 procent van de patiënten in de apalutamide-groep en bij 36 procent van de patiënten in de placebogroep. Gecorrigeerd voor blootstelling was dit respectievelijk 51 procent (apalutamide-groep) en 68 procent (placebogroep). Er overleed 1 patiënt aan een myocardinfarct, waarbij dit toegeschreven is aan de behandeling met apalutamide. De resultaten van deze studie voldoen niet aan de PASKWIL-criteria voor adjuvante behandeling voor een positief advies.
ARAMIS-studie: darolutamide
De eindanalyse was gepland bij 240 overlijdens. In de update werd de eindanalyse gepresenteerd bij een mediane follow-up van 29 maanden met 254 overlijdens. De mediane behandelduur was 25,8 maanden in de darolutamide-groep en 11,6 maanden in de placebogroep. Nadat in de finale analyse van het primaire eindpunt MFS een voordeel voor darolutamide werd aangetoond, werd de studiemedicatie gedeblindeerd. Van de patiënten in de placebogroep gebruikte 31 procent nog placebo. Vanaf deblindering werd de behandeling omgezet naar darolutamide. De 3-jaarsoverleving was 83 procent (95%-BI: 80-86) in de darolutamide-groep en 77 procent (95%-BI: 72-81) (HR: 0,69 [95%-BI: 0,53-0,88]; P = 0,003) in de placebogroep. Volgens het statistisch plan was een P lager dan 0,0498 benodigd voor significantie van het secundaire eindpunt OS. Behandeling na progressie werd gegeven aan 15 procent van de patiënten in de darolutamide-groep en aan 55 procent in de placebogroep (waarvan 31 procent darolutamide na deblindering).
Bijwerkingen die leidden tot het stoppen van de studiemedicatie traden op bij 85 patiënten (8,9 procent) in de darolutamide-groep en bij 48 patiënten (8,7 procent) in de placebogroep. Ernstige bijwerkingen (graad 3-4) traden op bij 26,3 procent van de patiënten in de darolutamide-groep en bij 21,7 procent van de patiënten in de placebogroep. Er overleden (toxiciteit graad 5) 38 patiënten (4,0 procent) in de darolutamide-groep en 19 patiënten (3,4 procent) in de placebogroep. 2 patiënten overleden tijdens de cross-over-periode (1,2 procent). Oorzaak van overlijden was cardiovasculair (23 [2,4 procent] in de darolutamide-groep en 12 [2,3 procent] in de placebogroep), respiratoir (respectievelijk 10 [1,0 procent] en 10 (1,8 procent]), nieuwe primaire tumor (respectievelijk 3 [0,3 procent] en 1 [0,2 procent]), cerebrovasculaire ziekte (respectievelijk 2 [0,2 procent] en 6 [1,1 procent]) en variabele andere oorzaken (respectievelijk 31 [3,2 procent] en 20 [3,6 procent]). Er is in de resultaten van deze studie niet gecorrigeerd voor cross-over.
Omdat de mediane follow-up 29 maanden is, kunnen de resultaten van deze studie niet beoordeeld worden volgens de PASKWIL-criteria voor adjuvante behandeling. Hiervoor geldt een minimale mediane follow-up van 36 maanden.
PROSPER-studie: enzalutamide
In de update was de mediane follow-up 48 maanden. De mediane behandelduur was 33,9 maanden in de enzalutamide-groep (95%-BI: 0,2-68,8) en 14,2 maanden in de placebogroep (95%-BI: 0,1-51,3). Nadat in de finale analyse van het primaire eindpunt MFS een voordeel voor enzalutamide werd aangetoond, werd de studiemedicatie gedeblindeerd. 114 patiënten (24 procent) in de placebogroep gebruikten nog placebo. Vanaf deblindering werd de behandeling bij 87 patiënten (19 procent van het totaal) omgezet naar enzalutamide.
De mediane OS in de enzalutamide-groep was 67,0 maanden (95%-BI: 64,0-niet behaald) en in de placebogroep 56,3 maanden (95%-BI: 54,4-63,0) (HR: 0,73 [95%-BI: 0,61-0,89]; P = 0,001). Volgens het statistisch plan was er een P lager dan 0,021 benodigd voor statistische significantie. In een ongeplande OS-analyse na 3 jaar follow-up was er een OS-verschil van 7 procent: in de enzalutamide-groep 80 procent (95%-BI: 77-83) en in de placebogroep 73 procent (95%-BI: 69-77). Behandeling na progressie werd gegeven aan 33 procent van de patiënten in de enzalutamide-groep en aan 84 procent van de patiënten in de placebogroep (waarvan 19 procent enzalutamide na deblindering).
Bijwerkingen die leidden tot het stoppen van de studiemedicatie traden op bij 158 patiënten (17 procent) in de enzalutamide-groep en bij 41 patiënten (9 procent) in de placebogroep. Gecorrigeerd voor blootstelling was dit voor de enzalutamide-groep 6 events per 100 patiëntjaren en voor de placebogroep tevens 6 events per 100 patiëntjaren. Ernstige bijwerkingen (graad 3-4) traden op bij 48 procent van de patiënten in de enzalutamide-groep en bij 27 procent van de patiënten in de placebogroep. Gecorrigeerd voor blootstelling was dit respectievelijk 17 events (enzalutamide) en 20 events (placebo) per 100 patiëntjaren.
Tijdens de studiebehandeling overleden 51 patiënten in de enzalutamide-groep (5 procent) aan bijwerkingen. In de placebogroep overleden 3 patiënten (1 procent). Gecorrigeerd voor blootstelling was dit 2 events versus minder dan 1 event per 100 patiëntjaren. Oorzaken van overlijden in de enzalutamide-groep waren cardiovasculair (14 patiënten), nieuwe primaire tumor (7 patiënten), herseninfarct (4 patiënten), plotse dood (4 patiënten), ziekteprogressie (3 patiënten), pneumonie (3 patiënten), septische shock (3 patiënten), bloeding (2 patiënten), algemene achteruitgang (2 patiënten) en nog 13 andere lethale events met elk 1 overlijden tot gevolg.
In de placebogroep overleden 2 patiënten aan een cardiovasculair event en 1 patiënt aan een nieuwe primaire tumor. De resultaten van deze studie voldoen aan de PASKWIL-criteria voor adjuvante behandeling voor een positief advies.
Discussie
De populaties die in dit rapport beschreven worden zijn in Nederland vrijwel afwezig. Bij patiënten met nmCRPC die met ADT behandeld worden leidt toevoegen van een antiandrogeen van de tweede generatie tot verlenging van de OS. De afwezigheid van metastasen in deze populatie is vastgesteld met conventionele beeldvorming (botscan en CT/MRI-scan) en niet met PSMA-PET-scan. In de huidige Nederlandse praktijk wordt vaak een PSMA-PET-scan gemaakt ter (initiële) stadiering. In het geval dat metastasen aangetoond worden met een PSMA-PET-scan zal er sprake zijn van een gemetastaseerd CRPC en kan een indicatie ontstaan voor behandeling met ADT, eventueel gecombineerd met een antiandrogeen zoals eerder beschreven in studies met gemetastaseerd CRPC. Voor veel andere patiënten geldt dat er in de Nederlandse praktijk geen indicatie is voor het toepassen van ADT – en dus ook niet voor een antiandrogeen – voordat metastasen manifest worden.
Zorgelijk zijn de frequentie en de ernst van de bijwerkingen die door vroege behandeling geïntroduceerd worden in een populatie waarbij geen evidente behandelindicatie bestaat. Deze bijwerkingen zijn met name cardiovasculair van aard, passend bij het bijwerkingenprofiel van antiandrogenen en ook bij de populatie (mannen van ruim boven de 65 jaar). Ook zijn er neurologische bijwerkingen beschreven. De financiële toxiciteit is eveneens aanzienlijk met, naast ADT, een mediane behandelduur met antiandrogeen van meer dan 2 jaar in alle drie de studies (kosten elk ongeveer 3.500 euro per maand; dit is in totaal tussen de 93.000 en 119.000 euro per patiënt).
In deze studies is bij het nmCRPC aannemelijk gemaakt dat een (vroeg) eindpunt MFS voorspellend is voor OS, en men suggereert dit als surrogaat voor OS te (gaan) gebruiken. De EMA en FDA hebben dit reeds toegepast voor autorisatie van de hier onderzochte middelen. De PASKWIL-criteria van de NVMO voorzien hier niet in.
5. Kosten
De behandeling met apalutamide kost 119,88 euro per dag bij een dosis van 1 d.d. 240 mg (bron: medicijnkosten.nl d.d. 1 mei 2022). De totale medicatiekosten (32,9 maanden) van apalutamide komen daarmee op 119.899 euro. De behandeling met darolutamide kost 119,20 euro per dag bij een dosis van 2 d.d. 600 mg (bron: medicijnkosten.nl d.d. 1 mei 2022). De totale medicatiekosten (25,8 maanden) van darolutamide komen daarmee op 93.491 euro. De behandeling met enzalutamide kost 108 euro per dag bij een dosis van 1 d.d. 160 mg (bron: medicijnkosten.nl d.d. 1 mei 2022). De totale medicatiekosten (33,9 maanden) van enzalutamide komen daarmee op 111.300 euro.
Conclusie
In de hier besproken SPARTAN-studie wordt bij patiënten met een nmCRPC na een follow-up van mediaan 52 maanden een statistisch significant langere overleving gezien na behandeling met apalutamide toegevoegd aan ADT. De mediane OS in de apalutamide-groep bedroeg 73,9 maanden versus 59,9 maanden in de placebogroep (HR: 0,78 [95%-BI: 0,64- 0,95]; P = 0,016). Een OS-analyse na 6 jaar toonde een verschil van 4 procent: 46 procent in de ITT-groep voor placebo en 50 procent (95%-BI: 44-56) in de apalutamide-groep. Dit resultaat voldoet niet aan de PASKWIL-criteria voor adjuvante behandeling voor een positief advies.
In de hier besproken ARAMIS-studie wordt bij patiënten met een nmCRPC na een follow-up van mediaan 29 maanden een statistisch significant langere overleving gezien na behandeling met darolutamide toegevoegd aan ADT. De 3-jaarsoverleving bedroeg 83 procent (95%-BI: 80-86) in de darolutamide-groep en 77 procent in de placebogroep (95%- BI: 72-81) (HR: 0,69 [95%-BI: 0,53-0,88]; P = 0,003). Dit resultaat kan niet volgens de PASKWIL-criteria voor adjuvante behandeling beoordeeld worden in verband met een mediane follow-up van minder dan 36 maanden.
In de hier besproken PROSPER-studie wordt bij patiënten met een nmCRPC na een follow-up van mediaan 52 maanden een statistisch significant langere overleving gezien na behandeling met enzalutamide toegevoegd aan ADT. De mediane OS in de enzalutamide-groep was 67,0 maanden (95%-BI: 64,0- niet behaald) en in de placebogroep 56,3 maanden (95%-BI: 54,4-63,0) (HR: 0,73 [95%-BI: 0,61-0,89]; P = 0,001). Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL-criteria voor adjuvante behandeling.
De in dit rapport beschreven populatie mannen met een niet-gemetastaseerd castratieresistent prostaatcarcinoom is in Nederland vrijwel afwezig. Dit heeft onder andere te maken met de in de richtlijn voorgeschreven indicatie voor het verrichten van een PSMA-PET-scan bij de stadiëring. Deze PET-scan leidt ertoe dat veel vaker dan in de hier beschreven studies bekend is dat er bij patiënten met een oplopend PSA sprake is van metastasen. Patiënten met aangetoonde metastasen vallen niet onder de definitie nmCRPC. Daarnaast is het niet-gemetastaseerd prostaatcarcinoom, met oplopend PSA, vrijwel altijd asymptomatisch waardoor er geen indicatie is voor het starten van eerstelijns antihormonale behandeling (ADT noch anti-androgeen).
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Apalutamide of enzalutamide bij het niet-gemetastaseerd castratieresistent prostaatcarcinoom. Med Oncol 2019;22(1):3942.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Darolutamide bij het niet-gemetastaseerd castratieresistent prostaatcarcinoom. Med Oncol 2020;23(5):2931.
- Smith MR, Saad F, Chowdhury S, et al. Apalutamide and overall survival in prostate cancer. Eur Urol 2021;79(1):1508.
- Fizazi K, Shore N, Tammela TL, et al; ARAMIS Investigators. Nonmetastatic, castration-resistant prostate cancer and survival with darolutamide. N Engl J Med 2020;383(11):104049.
- Sternberg CN, Fizazi K, Saad F, et al; PROSPER Investigators. Enzalutamide and survival in nonmetastatic, castration-resistant prostate cancer. N Engl J Med 2020;382(23):2197206.
- Duchesne GM, Woo HH, Bassett JK, et al. Timing of androgen-deprivation therapy in patients with prostate cancer with a rising PSA (TROG 03.06 and VCOG PR 01-03 [TOAD]): a randomised, multicentre, nonblinded, phase 3 trial. Lancet Oncol 2016;17(6):72737.