
1. Inleiding
Ruim twee derde van de patiënten met een mammacarcinoom heeft hormoonreceptorpositieve (HR-positieve), humaan epidermaal groeifactorreceptor 2-negatieve (HER2-negatieve) ziekte.1 Bij patiënten met gemetastaseerd HR-positief, HER2-negatief mammacarcinoom bestaat in Nederland de standaard eerstelijnstherapie uit een aromataseremmer, gevolgd door fulvestrant met een CDK4/6-remmer in de tweede lijn. Resistentie tegen endocriene behandeling is een belangrijk probleem. Een van de mechanismen die hieraan bijdraagt, is overactivatie van de phosphatidylinositol 3-kinase (PI3K)-AKT– PTEN signaaltransductieroute. In ongeveer de helft van de HR-positieve, HER2-negatieve mammacarcinomen vindt overactivatie plaats door activerende mutaties in PIK3CA of AKT1 of inactiverende veranderingen in PTEN.2 Remming van deze route door middel van alpelisib, een PI3K-remmer, in combinatie met fulvestrant of door everolimus in combinatie met exemestaan heeft eerder een PFSwinst laten zien bij voorbehandelde hormoonreceptorpositieve mammacarcinoompatiënten.3,4
Capivasertib is een remmer van de drie AKT-kinase-isovormen. In de hier te bespreken CAPItello-291-studie wordt behandeling met capivasertib in combinatie met fulvestrant vergeleken met fulvestrant met placebo bij patiënten met een lokaal gevorderd of gemetastaseerd HR-positief, HER2-negatief mammacarcinoom die eerder behandeld werden met een aromataseremmer met of zonder een CDK4/6remmer.5 EMA heeft capivasertib in combinatie met fulvestrant geregistreerd voor de behandeling van het irresectabel of gemetastaseerd HRpositief, HER2negatief mammacarcinoom met een mutatie in PIK3CA, AKT1 of PTEN, met progressie na eerdere behandeling met endocriene therapie.
2. Kankersoort en lijn van behandeling
Behandeling met capivasertib in combinatie met fulvestrant werd onderzocht bij patiënten met een lokaal gevorderd of gemetastaseerd HR-positief, HER2-negatief mammacarcinoom die ziekteprogressie hadden tijdens of na behandeling met een aromataseremmer met of zonder CDK4/6-remmer.
3. Vergelijking met de referentiebehandeling in Nederland
In de CAPItello-291-studie wordt behandeling met capivasertib in combinatie met fulvestrant vergeleken met fulvestrant bij patiënten met een gemetastaseerd HR-positief, HER2-negatief mammacarcinoom. In deze studie bestond behandeling in de controlegroep uit fulvestrant. In Nederland wordt bij deze patiëntengroep in de eerste lijn vaak een aromataseremmer als monotherapie gestart. In de tweede lijn wordt in het algemeen een CDK4/6-remmer toegevoegd aan endocriene behandeling met fulvestrant. Na progressie op fulvestrant wordt gekozen voor endocriene therapie die de patiënt nog niet gehad heeft of chemotherapie. In geval van een PIK3CA-mutatie wordt fulvestrant gecontinueerd na progressie met hieraan toegevoegd alpelisib. Ten tijde van de looptijd van de studie was alpelisib nog niet beschikbaar in Nederland. Hiermee is de controlegroep grotendeels vergelijkbaar met de referentiebehandeling in Nederland.
4. Methode en kwaliteit van de studie
De CAPItello-291-studie is een dubbelblind gerandomiseerde placebogecontroleerde fase III-multicenterstudie voor patiënten met een gemetastaseerd HR-positief, HER2-negatief mammacarcinoom. In deze studie werden twee cohorten onderzocht: een cohort met een bewezen geactiveerde AKTsignaaltransductieroute en een cohort met alle patiënten, dus met en zonder een geactiveerde AKT-signaaltransductieroute, of met onbekende activatiestatus van deze route. Om voor inclusie in aanmerking te komen dienden patiënten (mannen en pre-, peri- of postmenopauzale vrouwen) 18 jaar of ouder te zijn (in Japan 20 jaar of ouder), een ECOG-performancestatus van 0 of 1 te hebben en een pathologisch bewezen HR-positief (gedefinieerd als een positieve oestrogeenreceptor op ten minste 1 procent van de tumorcellen met of zonder aanwezigheid van progesteronreceptorexpressie), HER2-negatief mammacarcinoom met afstandsmetastasen of een primaire tumor die niet voor lokale behandeling met curatieve intentie in aanmerking kwam. Daarnaast diende er ziekteprogressie na eerdere behandeling met een aromataseremmer met of zonder CDK4/6-remmer te zijn. Dit was gedefinieerd als progressie gedurende de behandeling met een aromataseremmer, of recidief ziekte tijdens of binnen 12 maanden na (neo)adjuvante behandeling met een aromataseremmer. Een aromataseremmer hoefde niet de meest recente therapie te zijn voor inclusie in de studie. Patiënten mochten maximaal twee eerdere lijnen endocriene therapie gehad hebben en 1 lijn chemotherapie in gemetastaseerde setting. Volgens het onderzoeksprotocol moest minimaal 51 procent van de geïncludeerde patiënten eerder behandeld zijn geweest met een CDK4/6-remmer.
Er moest meetbare ziekte zijn volgens RECIST 1.1 of ten minste een duidelijk lytische dan wel gemengde lytisch-sclerotische botmetastase met een weke-delencomponent die middels CT of MRI-scan meetbaar was. Er moest voldoende tumorweefsel aanwezig zijn voor centrale moleculaire analyse op activerende mutaties in PIK3CA, AKT1 en inactiverende veranderingen in PTEN-genen middels nextgeneration sequencing (NGS) met gebruik van de FoundationOneCDx-assay (Foundation Medicine) in alle landen, behalve in China (OncoScreen Plus, Burning Rock Biotech). Een geactiveerde AKT-signaaltransductieroute werd gedefinieerd als de aanwezigheid van ten minste 1 pathogene verandering in AKT of PIK3CA of PTEN. Exclusiecriteria waren eerdere behandeling met fulvestrant of een andere selectieve oestrogeenreceptorremmer, insulineafhankelijke diabetes mellitus of een baseline HbA1c van 63,9 mmol/mol of hoger, en eerdere behandeling met AKT, PI3K, of mTOR-remmers.
Er werd 1:1 gerandomiseerd tussen behandeling met fulvestrant met capivasertib of placebo. Het innameschema van capivasertib 400 mg of placebo is tweemaal daags gedurende 4 dagen gevolgd door 3 dagen pauze. De dosering van fulvestrant is 500 mg intramusculair en wordt eenmaal per 28 dagen gegeven met 1 aanvullende dosis van 500 mg 14 dagen na de initiële dosis. Bij pre- en perimenopauzale vrouwen diende een luteïniserend hormoon-releasing hormoon (LHRH)-agonist toegevoegd te worden. De randomisatie werd gestratificeerd naar de aanwezigheid van levermetastasen (ja versus nee), eerdere behandeling met een CDK4/6-remmer (ja versus nee) en geografische regio (Verenigde Staten, Canada, West-Europa, Australië en Israël versus Latijns-Amerika, Oost-Europa en Rusland versus Azië). De behandeling werd gecontinueerd tot ziekteprogressie, onacceptabele toxiciteit, intrekken van informed consent of overlijden.
Dosisreductie van capivasertib of placebo was toegestaan van tweemaal daags 400 mg naar tweemaal daags 320 mg en vervolgens tweemaal daags 200 mg. De dosering van fulvestrant kon niet gereduceerd worden. Het duale primaire eindpunt was progressievrije overleving (PFS) beoordeeld door de onderzoeker in alle patiënten en in patiënten met een geactiveerde AKT-signaaltransductieroute. Secundaire eindpunten waren overleving (OS), objectieve responskans, veiligheid en kwaliteit van leven.
Een CT- of MRI-scan voor responsevaluatie volgens RECIST 1.1 werd elke 8 weken gemaakt gedurende de eerste 18 maanden en daarna iedere 12 weken totdat er sprake was van ziekteprogressie (ook bij patiënten die om andere redenen dan progressie eerder gestopt waren met fulvestrant, capivasertib of placebo). Nuchtere glucosespiegels werden bepaald op dag 1 en 15 van de eerste cyclus en daarna iedere 4 weken. Bijwerkingen van de behandeling werden geëvalueerd volgens CTCAE 5.0. Kwaliteit van leven werd gemeten met de vragenlijst van de European Organization for Research and Treatment of Cancer (EORTC) Core Quality of Life Questionnaire (QLQ-C30). Volgens het ontwerp van de studie waren er in totaal 700 patiënten en 542 PFS-events nodig om met 99 procent power en een tweezijdige alfa van 0,035 een PFS-verschil vast te stellen in de hele populatie als de hazard ratio (HR) 0,64 is. Indien deze test significant was, dan waren er voor het cohort met geactiveerde AKT-signaaltransductie route 217 PFS-events nodig voor 91 procent power bij een tweezijdige alfa van 0,05 (met dezelfde aanname van HR 0,64). Aangezien er een interim-analyse van de PFS was geweest (in de hele populatie) met een alfa van 0,001 werd bij de eindanalyse van de PFS bij het AKT-positieve cohort een alfa van 0,049 gehanteerd. Als de primaire analyse voor PFS een significant verschil liet zien, dan werd OS hiërarchisch getest. Er was voorzien in een interim-analyse voor PFS bij 321 events en een interim-analyse voor OS na 394 events. De finale OS-analyse zal plaatsvinden zodra 492 patiënten (70 procent) zijn overleden.
5. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen juni 2020 en oktober 2021 werden 901 patiënten gescreend door 193 centra in 19 landen. Uiteindelijk werden 708 patiënten gerandomiseerd; 355 patiënten in de capivasertibgroep en 353 in de placebogroep. 289 patiënten (40,8 procent) hadden een tumor met geactiveerde AKT-signaaltransductie route, 155 in de capivasertibgroep en 134 in de placebogroep. Er waren 313 patiënten (44,2 procent) met een tumor waarin geen afwijkingen in de AKT-signaaltransductieroute zijn ontdekt en bij 106 (15 procent) kon de AKTsignaaltransductieroute niet getest worden wegens (kwalitatief) onvoldoende weefsel. De uitgangskarakteristieken in de beide behandelarmen waren vergelijkbaar: de mediane leeftijd was 58 jaar, 77 procent van de vrouwen was postmenopauzaal, 69 procent was eerder behandeld met een CDK4/6remmer, en 18 procent was eerder behandeld geweest met chemotherapie voor gemetastaseerde ziekte.
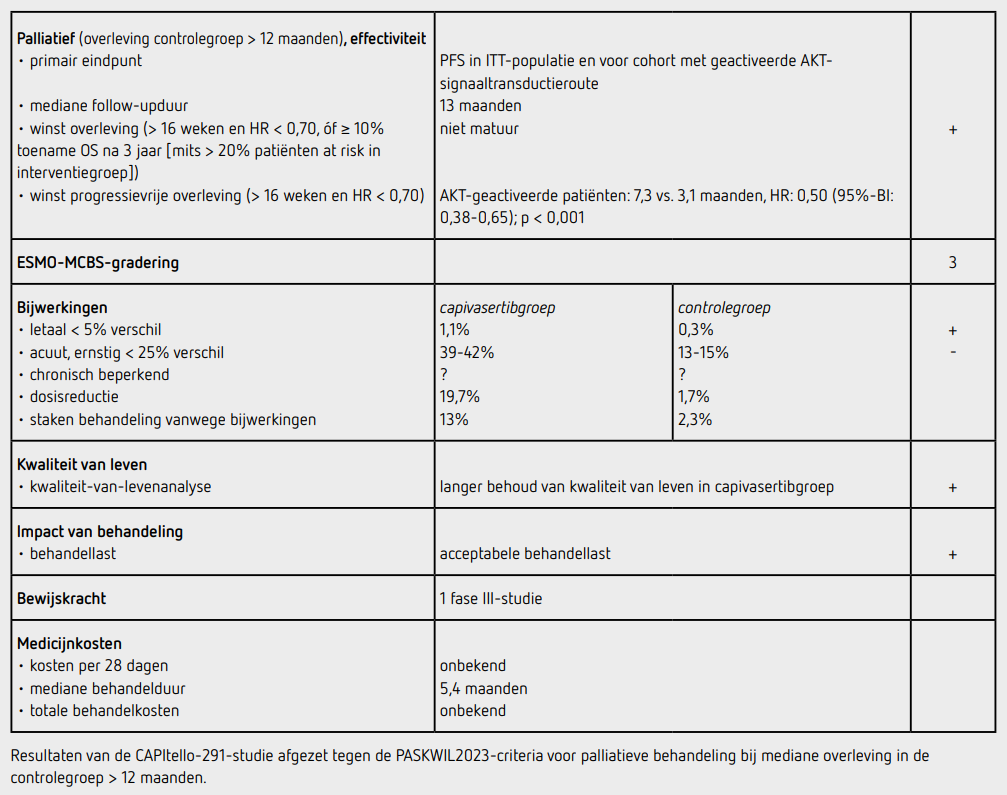
Ten tijde van de data-cutoff (15 augustus 2022) werden 63 patiënten (17,7 procent) nog behandeld met capivasertib en 43 patiënten (12,3 procent) kregen nog placebo. De mediane followup bedroeg 13 maanden. De mediane duur van behandeling met capivasertib was 5,4 maanden, voor placebo was dit 3,6 maanden. De mediane behandelduur met fulvestrant was 5,8 maanden in de capivasertibgroep en 3,7 maanden in de placebogroep.
Er waren 551 patiënten met een PFS-event in de totale populatie en 263 patiënten met een PFS-event in de groep met een geactiveerde AKT-signaaltransductieroute. De mediane PFS was in de totale patiëntenpopulatie 7,2 maanden (95%-BI: 5,5-7,4) in de capivasertibgroep en 3,6 maanden (95%-BI: 2,8-3,7) in de placebogroep (HR: 0,60 [95%-BI: 0,51-0,71]; p < 0,001). Bij de patiënten met geactiveerde AKT-signaaltransductieroute was de mediane PFS 7,3 maanden (95%-BI: 5,5-9,0) in de capivasertibgroep en 3,1 maanden (95%BI: 2,0-3,7) in de placebogroep (HR: 0,50 [95%-BI: 0,38-0,65]; p < 0,001). Er was geen duidelijk verschil tussen de vooraf gespecificeerde subgroepen.
Ten tijde van de analyse waren 195 patiënten (27,5 procent) overleden (87 in de capivasertibgroep en 108 in de placebogroep). Deze aantallen waren nog niet matuur voor een OS-analyse. In de totale populatie was de objectieve responskans 22,9 procent in de capivasertibgroep en 12,2 procent in de placebogroep. In de groep met geactiveerde AKT-signaaltransductieroute was de objectieve responskans 28,8 procent in de capivasertibgroep en 9,7 procent in de placebogroep.
Alle 355 patiënten in de capivasertibgroep (100 procent) kregen ten minste 1 gift capivasertib en 350 patiënten in de placebogroep (99 procent) kregen ten minste 1 gift placebo. 70 patiënten (19,7 procent) in de capivasertibgroep, kregen tenminste 1 dosisreductie, en 6 patiënten (1,7 procent) in de placebogroep. Capivasertib werd voortijdig gestaakt vanwege bijwerkingen door 46 patiënten (13 procent). Placebo werd vanwege bijwerkingen gestaakt door 8 patiënten (2,3 procent). In totaal hadden 139 patiënten (39 procent) behandeld in de capivasertibgroep ten minste 1 bijwerking van graad 3 en 9 patiënten (2,5 procent) een bijwerking van graad 4. In de controlegroep waren dit 44 patiënten (12,6 procent) met een bijwerking van graad 3 en 10 patiënten (2,9 procent) met een bijwerking van graad 4. De meest frequent voorkomende graad 3 of 4 bijwerking was huiduitslag bij 43 patiënten (12,1 procent) in de capivasertibgroep en bij 1 patiënt (0,3 procent) in de placebogroep, diarree bij respectievelijk 33 patiënten (9,3 procent) en 1 patiënt (0,3 procent), en hyperglycemie bij respectievelijk 8 patiënten (2,3 procent) en 1 patiënt (0,3 procent). In totaal kwam bij 58 patiënten (16,3 procent) in de capivasertibgroep hyperglycemie voor (alle graderingen). Er zijn in de capivasertibgroep 4 patiënten overleden, van wie 1 patiënt als gevolg van myocardinfarct, 1 patiënt door een cerebrale bloeding, 1 patiënt door een pneumonie en 1 patiënt door een sepsis. In de controlegroep is 1 patiënt overleden aan een COVID19-infectie. Deze overlijdens zijn door de lokale onderzoekers beoordeeld als niet gerelateerd aan de behandeling. In de capivasertibgroep bleef kwaliteit van leven langer behouden dan in de placebogroep. De mediane tijd tot verslechtering (gedefinieerd als een blijvende daling van 10 of meer punten in de QLQ-C30-vragenlijst) was 24,9 maanden in de capivasertibgroep en 12 maanden in de placebogroep (HR: 0,70 [95%-BI: 0,53-0,92]).
6. Discussie
De CAPItello-291-studie toont in het vooraf gedefinieerde cohort van patiënten met een lokaal gevorderd of gemetastaseerd HR-positief, HER2-negatief mammacarcinoom met een bevestigde activatie van de AKT-signaaltransductieroute, na eerdere behandeling met een aromataseremmer met of zonder een CDK4/6-remmer, die behandeld worden met capivasertib met fulvestrant ten opzichte van placebo met fulvestrant een verlenging van de mediane PFS van 4,2 maanden (HR: 0,50 [95%-BI: 0,38-0,65]; p < 0,001). De resultaten van dit eindpunt voldoen aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is. In de totale populatie werd een statistisch significante verlenging van de mediane PFS met 3,6 maanden gezien ten faveure van de capivasertibgroep. Dit eindpunt voldoet niet aan de PASKWIL2023-criteria en valt buiten de EMA-registratie. De OS is nog niet matuur.
In Nederland wordt naar aanleiding van de resultaten van de SONIA-studie meestal in de eerste lijn een aromataseremmer gegeven en wordt vervolgens in de tweede lijn een CDK4/6-remmer ingezet samen met fulvestrant.6 De controlebehandeling in de CAPItello-291-studie bestond uit monotherapie fulvestrant. In het huidige behandellandschap in Nederland zullen veel patiënten dit middel in de vorige lijn samen met een CDK4/6-remmer gehad hebben. In geval van een PIK3CAmutatie wordt fulvestrant gecontinueerd na progressie met hieraan toegevoegd alpelisib. Daarnaast zijn er inmiddels data die laten zien dat de PFS van fulvestrant monotherapie na CDK4/6-remmer beperkt is.6,7 Verder is onduidelijk hoe de resultaten van deze studie zich verhouden tot die van de SOLAR-1-studie, waarin patiënten met een PIK3CA-gemuteerd mammacarcinoom na eerdere behandeling met een aromataseremmer, behandeld zijn met de combinatie alpelisib en fulvestrant.3 Een belangrijk verschil is dat in de huidige studie een grotere groep patiënten is geïncludeerd met een CDK4/6-remmer als eerdere behandeling. In de subgroepanalyse lijkt er ook geen duidelijk verschil in uitkomst te zijn tussen wel of niet met een CDK4/6-remmer voorbehandelde patiënten. Het bijwerkingenprofiel van de combinatie capivasertib-fulvestrant lijkt gunstiger te zijn dan die van de combinatie alpelisib-fulvestrant, met name vanwege minder hyperglycemische ontregelingen, wat terug te zien is in het kleinere percentage patiënten dat de therapie moest staken door bijwerkingen. Desondanks kwamen er in de huidige studie een stuk meer bijwerkingen van graad 3 of hoger voor in de capivasertibgroep dan in de plabebogroep, waaronder huiduitslag en diarree. Opvallend genoeg kwam dit niet terug in de kwaliteit-van-levenresultaten, die juist beter waren voor de capivasertibgroep dan de placebogroep. De indicatie voor capivasertib is ruimer dan voor alpelisib, namelijk voor patiënten met een PIK3CA, AKT of PTEN-gemuteerde tumor. De mutatiestatus van de AKT-signaaltransductieroute kan middels NGS worden bepaald op tumormateriaal. Momenteel gebeurt dit ook reeds voor de PIK3CA-mutatiestatus. Capivasertib bevindt zich momenteel in de sluis.
7. Kosten
De kosten van deze behandeling zijn nog niet bekend (bron: medicijnkosten.nl, januari 2025).
8. Conclusie
In de hier besproken CAPItello-291-studie wordt bij patiënten met een lokaal gevorderd of gemetastaseerd HR-positief en HER2-negatief mammacarcinoom en een geactiveerde AKT-signaaltransductieroute, na voorbehandeling met een aromataseremmer met of zonder CDK4/6-remmer, een toename van de mediane PFS van 4,2 maanden gezien voor behandeling met capivasertib met fulvestrant ten opzichte van placebo met fulvestrant (HR: 0,50 [95%-BI: 0,38-0,65]; p < 0,001). Dit resultaat voldoet aan de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer is dan 12 maanden.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Burstein HJ. Systemic therapy for estrogen receptor-positive, HER2-negative breast cancer. N Engl J Med 2020;383(26):2557-70.
- André F, Rubovsky G, Campone M, et al; SOLAR-1 Study Group. Alpelisib for PIK3CA-mutated, hormone receptor-positive advanced breast cancer. N Eng J Med 2019;380(20):1929-40.
- Baselga J, Campone M, Piccart M, et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med 2012;366(6):520-9.
- Turner N, Oliveira M, Howell S, et al. Capivasertib in hormone receptor-positive breast cancer. N Engl J Med 2023;388:2058-70.
- Sonke G, van OmmenNijhof A, Wortelboer N, et al. Early versus deferred use of CDK4/6 inhibitors in advanced breast cancer. Nature 2024;636(8042):474-80.
- Bidard FC, Kaklamani VG, Neven P et al. Elacestrant (oral selective estrogen receptor degrader) versus standard endocrine therapy for estrogen receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: Results from the randomized phase III EMERALD trial. J Clin Oncol 2022;40(28):3246-56.