
Inleiding
De incidentie van het cervixcarcinoom in Nederland is de laatste decennia stabiel met 700 tot 800 diagnoses per jaar.1 Naar verwachting zal de incidentie door het ingestelde HPV-vaccinatieprogramma in de toekomst afnemen. Door radicale chirurgische en radio(chemo)therapeutische behandelmogelijkheden is de prognose in het vroege stadium van de ziekte (< FIGO IIa, tumor beperkt tot de cervix) goed. Zowel bij gerecidiveerde als bij gevorderde of gemetastaseerde ziekte is de prognose somber, met een 5-jaarsoverleving van 10 procent.2 Jaarlijks overlijden ruim 200 patiënten in Nederland aan cervixcarcinoom.
De behandelmogelijkheden bij het gevorderd of gemetastaseerd cervixcarcinoom bestaan uit chemotherapie (cisplatine gecombineerd met paclitaxel of topotecan3 of carboplatine met paclitaxel) in combinatie met bevacizumab. In de GOG 240-studie werd het toevoegen van bevacizumab aan chemotherapie onderzocht. De mediane overleving in de groep patiënten behandeld met chemotherapie en bevacizumab was 17 maanden, waarbij het toevoegen van bevacizumab aan een cisplatine-bevattend regime resulteerde in een mediane overlevingswinst van bijna 4 maanden.4 In de KEYNOTE-826-studie werd met het toevoegen van pembrolizumab aan platinumbevattende chemotherapie, met of zonder bevazicumab, bij patiënten met een persisterend, gerecidiveerd of gemetastaseerd cervixcarcinoom een langere PFS en OS bereikt.5 De EMA heeft het toevoegen van pembrolizumab aan eerstelijnsbehandeling geregistreerd voor patiënten met een tumor met een PD-L1-expressie met een combined positivity score (CPS) van 1 of hoger.
In de hier te bespreken studie werd cemiplimab vergeleken met chemotherapie bij patiënten na eerdere behandeling met platinumbevattende chemotherapie voor een gerecidiveerd of gemetastaseerd cervixcarcinoom. De EMA heeft cemiplimab geregistreerd voor de behandeling van volwassen patiënten met een gerecidiveerd of gemetastaseerd cervixcarcinoom en ziekteprogressie tijdens of na platinumbevattende chemotherapie.6
1. Kankersoort en lijn van behandeling
Cemiplimab werd vergeleken met chemotherapie naar keuze bij patiënten met een progressief gerecidiveerd of gemetastaseerd cervixcarcinoom tijdens of na platinumbevattende chemotherapie.
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland wordt aan patiënten met een cervixcarcinoom in de palliatieve setting systemische behandeling gegeven bestaande uit carboplatine of cisplatine in combinatie met paclitaxel. Bevazicumab kan toegevoegd worden aan een cisplatine-bevattend regime. Sinds kort kan bij patiënten met een tumor met een PD-L1-expressie met een CPS van 1 of hoger pembrolizumab aan de platinumbevattende behandeling toegevoegd worden. In Nederland is er geen standaard tweedelijnsbehandeling.
3. Methode en kwaliteit van de studie
De EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9-studie is een open label, gerandomiseerde fase III-multicenterstudie voor patiënten met een progressief gerecidiveerd of gemetastaseerd cervixcarcinoom na eerdere behandeling met een platinumbevattend regime. Patiënten met een adeno, adenosquameus of plaveiselcelcarcinoom konden geïncludeerd worden. Om voor inclusie in aanmerking te komen dienden patiënten behandeling met paclitaxel en bevacizumab te hebben gehad, tenzij zij behandeling hadden afgeslagen, de behandeling ongeschikt werd geacht of niet beschikbaar was (in het geval van bevacizumab). Patiënten mochten niet eerder behandeld zijn met een anti-PD-1 of anti-PD-L1t-herapie. Patiënten dienden een ECOG-performancestatus van 0 of 1 te hebben en goede orgaanfuncties. Er moest sprake zijn van meetbare ziekte op de beeldvorming. Exclusiecriteria waren: autoimmuunziekten in de afgelopen 5 jaar, actieve infectie waarvoor behandeling nodig was, of in de 4 weken voor start behandeling met immunosuppressiva of steroïden (gelijkwaardig aan > 10 mg prednisolon per dag). Tumor-PD-L1-expressie was geen inclusiecriterium in deze studie. Het aantal patiënten met een adeno- en adenosquameus carcinoom werd gemaximaliseerd om in de studie een populatie te includeren representatief voor de werkelijke distributie van de verschillende histologische subtypes.
Patiënten werden 1:1 gerandomiseerd tussen behandeling met cemiplimab en chemotherapie naar keuze. De behandeling werd gestratificeerd naar het histologisch subtype (plaveiselcarcinoom versus adeno- en adenosquameuscarcinoom), geografische regio (Noord-America versus Azië versus rest van de wereld), eerdere behandeling met bevacizumab (ja versus nee) en ECOG-performancestatus (0 versus 1).
Voorafgaand aan de randomisatie werd bepaald welke chemotherapie een patiënt zou gaan krijgen. Dit kon bestaan uit monotherapie pemetrexed 500 mg/m2 op dag 1 van een 3-wekelijkse cyclus, topotecan 1 mg/m2 op dag 1-5 van een 4-wekelijkse cyclus, irinotecan 100 mg/m2 op dag 1 van een wekelijkse cyclus, gemcitabine 1000 mg/m2 op dag 1 en 8 van een 3-wekelijkse cyclus of vinorelbine 30 mg/m2 op dag 1 en 8 van een 3-wekelijkse cyclus. Al deze behandelingen werden intraveneus toegediend. De behandeling werd gestaakt bij ziekteprogressie of bij protocollair gedefinieerde bijwerkingen. Cemiplimab (350 mg flat dose) werd iedere 3 weken i.v. toegediend gedurende maximaal 96 weken, waarbij 1 cyclus geteld werd als 6 weken behandeling. Indien patiënten behandeling 16 cycli (= 96 weken) met cemiplimab hadden afgerond zonder progressieve ziekte en nadien progressieve ziekte hadden, mocht cemiplimab herstart worden. Patiënten met een beeld van pseudoprogressie mochten behandeling met cemiplimab continueren indien de performancestatus niet verslechterd was. Dosisreductie van alle middelen werd toegestaan. De behandeling kon maximaal 12 weken uitgesteld worden. De behandeling werd gestaakt na het bereiken van het maximumaantal cycli cemiplimab, bij ziekteprogressie, om veiligheidsredenen of bij het intrekken van toestemming.
Het primaire eindpunt van de studie was overleving (OS). Secundaire eindpunten waren progressievrije overleving (PFS, volgens RECIST 1.1 vastgesteld door de onderzoeker), responskans (ORR), responsduur en kwaliteit van leven. Vooraf bepaalde exploratieve analyses betrof de relatie tussen behandeluitkomst en de tumor-PD-L1-expressie. De PD-L1-expressie werd vastgesteld met het monoklonaal antilichaam SP263 (VENTANA), waarbij er een onderscheid werd gemaakt in een expressie van ≥ 1 procent of < 1 procent.
Effectiviteit werd getest in de intention to treat-populatie (ITT-populatie) en veiligheid werd getest bij alle patiënten volgens verkregen studiebehandeling. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.03. Tumormeting werd gedaan met een CT-scan en/of MRI-scan bij start, vervolgens iedere 6 weken gedurende de eerste 24 weken, daarna iedere 12 weken tot aan ziekteprogressie of intrekken van toestemming. Kwaliteit van leven werd gemeten met de European Organization for Research and Treatment of Cancer Quality-of-Life Questionnaire Core 30 (QLQC30).
In het ontwerp van de studie waren ongeveer 460 patiënten met een plaveiselcelcarcinoom nodig met ongeveer 340 overleden patiënten om met 90 procent power en een eenzijdige alfa van 2,5 procent een ten minste 30 procent lagere kans op overlijden in de cemiplimabgroep ten opzichte van de chemotherapiegroep vast te kunnen stellen in deze subgroep (hazard ratio [HR]: 0,7). In totaal zouden ongeveer 590 patiënten geïncludeerd moeten worden om 460 patiënten met een histologisch subtype plaveiselcelcarcinoom in de studiepopulatie te hebben.
Binnen het eindpunten OS was er een hiërarchische analyse gepland: eerst OS bij patiënten met een plaveiselcelcarcinoom, dan OS in de ITT-populatie.
Het studieprotocol voorzag in twee interim-analyses. De eerste interim-analyse was gepland bij overlijden van ongeveer 70 procent van de patiënten met een plaveiselcelcarcinoom. De eenzijdig alfa van 0,025 werd verdeeld over de interim- en finale analyses. De alfa die voor de verschillende primaire eindpunten gebruikt werd bij de tweede interim-analyse, waarvan de resultaten hier gepresenteerd zijn, was 0,0129. Na deze tweede interim-analyse is de studie gestopt, op basis van de vooraf gespecificeerde effectiviteitscriteria in de subgroep van patiënten met een plaveiselcelcarcinoom.
Voor de analyse van de kwaliteit-van-levenvragenlijsten werd een mixed-effects model for repeated measures gebruikt, waarbij er tijdens de behandeling ten minste 10 patiënten in beide groepen de vragenlijsten ingevuld moesten hebben. Een klinisch relevant verschil werd gedefinieerd als een toename in 10 punten (op een 100-puntsschaal) tussen baseline en cyclus 8.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
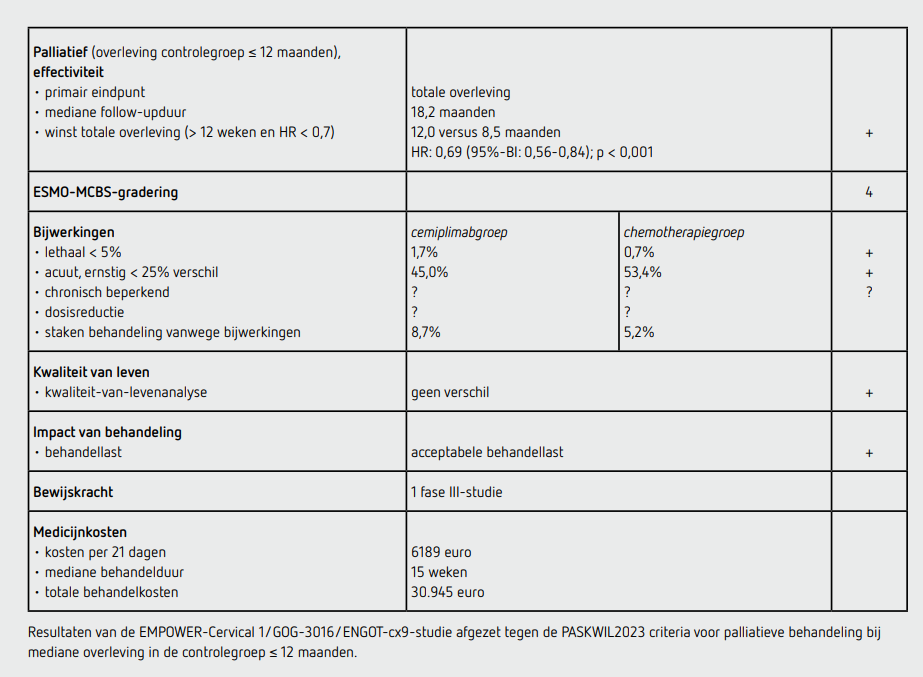
Tussen juli 2017 en augustus 2020 werden 608 patiënten geïncludeerd door 97 centra in 14 landen: 304 patiënten in de cemiplimabgroep en 304 patiënten in de controlegroep. Op het moment van deze analyse (data-cutoff 4 januari 2021) bedroeg de mediane follow-up 18,2 maanden (range: 6,0-38,2) van de intention-to-treat (ITT) populatie en 16,8 maanden van de subgroep met een plaveiselcelcarcinoom. 5 patiënten in de cemiplimabgroep en 33 patiënten in de controlegroep hebben geen behandeling gekregen. Op het moment van data-cutoff werden in de cemiplimabgroep 37 patiënten (12,2 procent) en in de controlegroep 7 patiënten (2,3 procent) nog behandeld.
De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 51 jaar, ongeveer 10 procent werd in Noord-Amerika geïncludeerd, 27 procent in Azië en 62 procent in de rest van de wereld, 46 procent had een ECOG-performancestatus van 0,78 procent had een plaveiselcelcarcinoom als histologisch subtype, 94 procent had gemetastaseerde ziekte, 42 procent had meer dan één lijn systemische behandeling gehad en bevacizumab was hier bij 49 procent onderdeel van en paclitaxel bij 92 procent. In de controlegroep werden 109 patiënten behandeld met pemetrexed, 118 met gemcitabine, 16 met topotecan, 19 met irinotecan en 28 met vinorelbine.
In de ITT-populatie was het primaire eindpunt OS significant beter in de cemiplimabgroep dan in de controlegroep (HR: 0,69 [95%-BI: 0,56-0,84]; p < 0,001). De mediane OS was in de cemiplimabgroep 12,0 maanden (95%-BI: 10,3-13,5) en in de controlegroep 8,5 maanden (95%-BI: 7,5-9,6). In de subgroep met een plaveiselcelcarcinoom was de mediane OS in de cemiplimabgroep statistisch significant langer dan in de controlegroep: 11,1 maanden (95%-BI: 9,2-13,4) versus 8,8 maanden (95%-BI: 7,6-9,8) met een HR van 0,73 (95%-BI: 0,58 0,91; p = 0,006).
In de vooraf gedefinieerde subgroepanalyses was er een verbetering in de cemiplimabgroep ten opzichte van de controlegroep voor patiënten met een ECOG-performancestatus van 0 en eerdere behandeling met bevacizumab.
In de ITT-populatie was de mediane PFS in de cemiplimabgroep 2,8 maanden en in de controlegroep 2,9 maanden (HR: 0,75 [95%-BI: 0,63-0,89]; p < 0,001). In de ITT-populatie was de responskans 16,4 procent in de cemiplimabgroep en 6,3 procent in de controlegroep met een mediane duur van de respons van 16,4 en 6,9 maanden, respectievelijk.
Van 254 patiënten (42 procent) was tumorweefsel beschikbaar voor het bepalen van de PD-L1-expressie: 126 patiënten in de cemiplimabgroep en 128 patiënten in de controlegroep. De uitkomsten van deze 254 patiënten waren vergelijkbaar met de uitkomsten van de totale populatie. Patiënten met een plaveiselcelcarcinoom hadden vaker een PD-L1-expressie van 1 procent of hoger dan patiënten met een adenocarcinoom, respectievelijk 70,7 en 32,6 procent. De mediane OS in patiënten met een PD-L1-expressie van 1 procent of hoger was in de cemiplimabgroep 13,9 maanden (95%-BI: 9,6-niet bereikt) en in de controlegroep 9,3 maanden (95%-BI: 7,0-11,4; HR: 0,70). In patiënten met een PD-L1-expressie van minder dan één procent was de mediane OS in de cemiplimabgroep 7,7 maanden (95%-BI: 4,3-12,3) en in de controlegroep 6,7 maanden (95%-BI: 3,9 9,5; HR: 0,98).
De kwaliteit-van-levenvragenlijsten werden door 95 procent van de patiënten bij baseline ingevuld en door ongeveer 90 procent van diegenen die de vragenlijsten nog konden invullen tijdens de behandeling. In de ITT-populatie was het verschil tussen baseline en cyclus 8 tussen de patiënten behandeld met cemiplimab en chemotherapie 7,8 punten voor de global health status. In de cemiplimabgroep verbeterde de kwaliteit van leven met 1 punt, in de controlegroep verslechterde deze met 6,8 punten.
In totaal 45,0 procent van de patiënten behandeld met cemiplimab en 53,4 procent van de patiënten behandeld met chemotherapie had ten minste 1 bijwerking van graad 3 of hoger. Bijwerkingen die resulteerden in het beëindigen van de behandeling traden op bij respectievelijk 8,7 en 5,2 procent van de patiënten behandeld met cemiplimab of chemotherapie. Ten gevolge van bijwerkingen overleed 1,7 procent in de cemiplimabgroep en 0,7 procent in de controlegroep. Geen van de overlijdens werd beschouwd als het gevolg van behandeling met cemiplimab. Immuuntherapie gerelateerde bijwerkingen van elke graad traden op bij 15,7 procent van de patiënten behandeld met cemiplimab.
De meest voorkomende bijwerkingen van graad 3 of hoger waren anemie (12,0 versus 26,9 procent) en neutropenie (1,0 versus 9,0 procent). In de cemiplimabgroep had 5,3 procent een aan immuuntherapie gerelateerde bijwerking van graad 3 of hoger, waarvan hepatitis het meest frequent voorkwam (2,3 procent).
Discussie
In de open-label gerandomiseerde fase III-multicenterstudie EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9-studie wordt een statistisch significant voordeel aangetoond voor OS bij behandeling met cemiplimab ten opzichte van chemotherapie, zowel bij patiënten met een plaveiselcelcarcinoom van de cervix als in de ITT-populatie. Het resultaat voldoet aan de PASKWIL2023-criteria voor palliatieve behandeling (bij mediane overleving in de controlegroep < 12 maanden) voor een positief advies. De chemotherapie die patiënten in de controlegroep kregen, is geen standaardbehandeling in Nederland. Deze behandeling zal waarschijnlijk ten minste even effectief zijn als best supportive care.
Het OS-voordeel voor cemiplimab werd gezien in meerdere geplande subgroepanalyses. De EMA heeft cemiplimab geautoriseerd voor patiënten met een cervixcarcinoom ongeacht het histologisch subtype. De PD-L1-expressie was een exploratief eindpunt in deze studie. Alhoewel de groepen te klein zijn om een betrouwbare uitspraak te kunnen doen, leek behandeling met cemiplimab bij patiënten met een tumor met een PD-L1-expressie van minder dan 1 procent nauwelijks tot een OS-verbetering te leiden (mediaan OS-verschil is 1 maand, HR: 0,98).
Patiënten met een cervixcarcinoom kunnen nu in eerste lijn behandeld worden met platinumbevattende chemotherapie, met of zonder bevacizumab, in combinatie met pembrolizumab indien er een PD-L1-expressie met een CPS van 1 of hoger is. Of gelijktijdige of sequentiële behandeling met immuuntherapie en platinumbevattende chemotherapie tot de langste OS leidt, is nog niet duidelijk.
Het in deze studie beschreven bijwerkingenprofiel van cemiplimab komt overeen met wat bekend is van andere studies. De behandeling wordt over het algemeen goed verdragen en de bijwerkingen zijn hanteerbaar.
5. Kosten
De behandeling met cemiplimab 350 mg kost 6.189 euro per behandelcyclus van 21 dagen (bron: medicijnkosten.nl d.d. juli 2023). De mediane behandelduur is 15 weken, oftewel 5 cycli. De kosten komen daarmee op 30.945 euro per patiënt.
Conclusie
In de hier besproken EMPOWER-Cervical 1/GOG-3016/ ENGOT-cx9-studie wordt bij patiënten met een progressief gerecidiveerd of gemetastaseerd cervixcarcinoom na platinumbevattende chemotherapie een statistisch significant langere OS gezien bij behandeling met cemiplimab in vergelijking tot chemotherapie. De EMA heeft deze behandeling geautoriseerd voor alle patiënten met cervixcarcinoom, ongeacht het histologisch subtype en de PD-L1-status. De mediane OS was in de cemiplimabgroep 12,0 maanden (95%-BI: 10,3-13,5) en in de controlegroep 8,5 maanden (95%-BI: 7,5-9,6; HR: 0,69 [95%-BI: 0,56-0,84]; p < 0,001). Deze resultaten voldoen aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling (bij mediane overleving in de controlegroep < 12 maanden).
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Wenzel HHB, Bekkers RLM, Lemmens VEPP, et al. No improvement in survival of older women with cervical cancer: a nationwide study. Eur J Cancer 2021;151:159-67.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Cisplatine in combinatie met topotecan bij gerecidiveerd of gemetastaseerd cervixcarcinoom. Med Oncol 2008;11(1):49-50.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Bevacizumab bij de palliatieve behandeling van het cervixcarcinoom. Med Oncol 2015;18(4):27-30.
- Colombo N, Dubot C, Lorusso D, et al; KEYNOTE-826 Investigators. Pembrolizumab for persistent, recurrent, or metastatic cervical cancer. N Engl J Med 2021;385(20):1856 67.
- Tewari KS, Monk BJ, Vergote I, et al. Survival with Cemiplimab in Recurrent Cervical Cancer. N Engl J Med 2022;386:544-55.