
Inleiding
De incidentie van het cervixcarcinoom in Nederland is de laatste decennia stabiel met 700 tot 800 diagnoses per jaar.1 Naar verwachting zal de incidentie door het HPV-vaccinatieprogramma in de toekomst afnemen. Door radicale chirurgische en radio(chemo)therapeutische behandelmogelijkheden is de prognose in het vroege stadium van de ziekte (< FIGO IIA, tumor beperkt tot de cervix) goed. Zowel bij gerecidiveerde als bij gevorderde of gemetastaseerde ziekte is de prognose somber, met een 5-jaarsoverleving van 10 procent.2 Jaarlijks overlijden ruim 200 patiënten in Nederland aan cervixcarcinoom.
Voor de FIGO stadia IA-IB1 bestaat de behandeling uit radicale chirurgie, eventueel gevolgd door radio(chemo)therapie op basis van de uitgebreidheid na pathologische beoordeling. FIGO stadia IB2-IVA worden in opzet curatief behandeld met radiochemotherapie, waarbij de chemotherapie uit 6 wekelijkse kuren cisplatine 40 mg/m2 bestaat indien mogelijk. Een alternatief kan carboplatine AUC2 zijn.
In de hier te bespreken INTERLACE-studie, een investigator initiated studie, wordt onderzocht of het toevoegen van inductiebehandeling met chemotherapie, bestaande uit 6 wekelijkse kuren carboplatine en paclitaxel, aan standaardbehandeling met radiochemotherapie bij patiënten met een lokaal gevorderd cervixcarcinoom (FIGO 2008 stadia IB1 met aangedane lymfeklieren, IB2-IVA, met uitzondering van stadium IIIA) leidt tot een betere overleving.3 Zowel carboplatine als paclitaxel zijn uit patent en onderdeel van de standaardbehandeling van het gerecidiveerde en gemetastaseerde cervixcarcinoom.
Kankersoort en lijn van behandeling
Inductiebehandeling met carboplatine en paclitaxel werd onderzocht bij patiënten met een lokaal gevorderd cervixcarcinoom (FIGO 2008 stadium IB1 met aangedane lymfeklieren of stadia IB2-IVA, met uitzondering van stadium IIIA), voorafgaand aan in opzet curatieve chemoradiatie.
Vergelijking met de referentiebehandeling in Nederland
In de INTERLACE-studie wordt inductiechemotherapie met 6 wekelijkse kuren carboplatine en paclitaxel voorafgaand aan radiochemotherapie vergeleken met alleen radiochemotherapie. De radiochemotherapie in de INTERLACE-studie bestaat uit 5 wekelijkse kuren cisplatine 40 mg/m2 in combinatie met 45-50,4 Gy uitwendige radiotherapie in 20-28 fracties gevolgd door brachytherapie om een totale dosis van 78-86 Gy te bereiken. In Nederland worden patiënten met een lokaal gevorderd cervixcarcinoom behandeld met radiochemotherapie, waarbij de chemotherapie uit maximaal 6 wekelijkse kuren cisplatine 40 mg/m2 (of eventueel carboplatine AUC2) bestaat. De radiotherapeutische behandeling wordt gegeven op basis van 3D-beeldgeleiding en er vindt optimalisatie voor het tumorvolume plaats. In de INTERLACE-studie werden oudere bestralingstechnieken ook toegelaten. Hiermee voldoet de controlegroep in beperkte mate aan de huidige Nederlandse praktijk.
Methoden van de studie
De INTERLACE-studie is een gerandomiseerde open-label fase III-multicenterstudie voor patiënten met een primair gediagnosticeerd lokaal gevorderd cervixcarcinoom, FIGO 2008 stadium IB1 met aangedane lymfeklieren of stadia IB2-IVA. Patiënten met een cervixcarcinoom stadium IIIA en patiënten met aangedane lymfeklieren boven de aorta-bifurcatie mochten niet deelnemen aan de studie, omdat het ten tijde van het ontwerp van de studie onduidelijk was of deze patiëntengroep curatief behandeld kon worden met radiochemotherapie. Een aangedane lymfeklier werd gedefinieerd als histologisch bevestigd, PET-positief of met een korte as van ten minste 15 mm op de CT- of MRI-scan. Er mocht sprake zijn van een plaveiselcelcarcinoom, adenocarcinoom of een adenosquameus carcinoom. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn, een ECOG-performancestatus van 0 of 1 en een goede nierfunctie te hebben (GFR ≥ 60 ml/min op basis van de Wright berekening). Patiënten met hydronefrose mochten deelnemen nadat een stent of nefrostomiekatheter was geplaatst of als de nier niet meer functioneel was. Patiënten met de ziekte van Crohn of colitis ulcerosa werden geëxcludeerd.
Patiënten werden 1:1 gerandomiseerd tussen inductiebehandeling met chemotherapie bestaande uit 6 wekelijkse giften intraveneus carboplatine AUC2 en paclitaxel 80 mg/m2 gevolgd door radiochemotherapie of alleen radiochemotherapie. De radiochemotherapie startte in de week volgend op de laatste gift inductiebehandeling. De radiochemotherapie bestond uit wekelijks cisplatine 40 mg/m2 gedurende 5 weken. De uitwendige radiotherapie werd in 20-28 fracties gedurende 5 weken gegeven met een dosis van 40-50,4 Gy. Brachytherapie werd 2- of 3-dimensionaal gegeven waarbij een 3D-beeldgeleide benadering aanbevolen was. De radiotherapie moest in 50 dagen gegeven worden, waarbij een uitloop tot 56 dagen geaccepteerd werd. De kwaliteit van de radiotherapie werd tijdens de studie beoordeeld. De behandeling werd gestratificeerd naar centrum, FIGO-stadium, aangedane lymfeklieren (ja versus nee), soort radiotherapie (three-dimensional conformal radiotherapy (3DCRT) versus intensity modulated radiation therapy (IMRT), leeftijd, tumorgrootte en histologie (squameus versus nietsquameus). Dosisaanpassing en behandelonderbreking van de chemotherapie was toegestaan.
De primaire eindpunten van de studie waren progressievrije overleving (PFS), beoordeeld door de onderzoeker, en overleving (OS). Secundaire eindpunten waren bijwerkingen, kwaliteit van leven, aard van recidief (lokaal en/of systemisch) en tijd tot eerstvolgende behandeling.
Een MRI, CT- of PET/CT-scan werd bij baseline gemaakt, vervolgens 12 weken na het afronden van de radiochemotherapie, daarna naar oordeel van de behandelaar. Lichamelijk onderzoek werd wekelijks verricht tijdens de behandeling, 4 en 12 weken na afronding van de radiochemotherapie en vervolgens elke 3 maanden in de eerste 2 jaar en elke 6 maanden in jaar 3-5. Kwaliteit van leven werd gemeten met de vragenlijsten EORTC QLQ-C30, QLQ-CX24 en EQ-5D-5L afgenomen bij baseline, week 1 en 3 van de radiochemotherapie en daarna bij elk controlebezoek. Patiënten die inductiebehandeling kregen werd ook in week 4 van deze behandeling gevraagd de vragenlijsten in te vullen. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.03.
Volgens het initiële ontwerp van de studie zouden 700 patiënten geïncludeerd worden. Omdat de inclusie trager ging dan verwacht is dit aantal verlaagd naar 500 op advies van de Independent Data Monitoring Committee (IDMC). Met 500 patiënten kan bij 192 tot 198 events een verschil in overleving worden vastgesteld als de werkelijke hazard ratio (HR) tussen de 0,65 en 0,70 ligt met een power tussen 70 en 84 procent bij een tweezijdige alfa van 5 procent uitgaande van een 5-jaars overleving van 60 procent in de controlegroep. Volgens het statistisch plan zou eerst PFS getest worden en vervolgens hiërarchisch OS met meenemen van de alfa. De berekening van het benodigd aantal patiënten was alleen gebaseerd op de OS. In een interim-analyse werd niet voorzien. De IDMC adviseerde op basis van vertrouwelijk beoordeelde resultaten al bij het bereiken van 132 PFS-events over te gaan tot analyse.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen november 2012 en november 2022 werden 500 patiënten geïncludeerd door 32 centra in 5 landen (Brazilië, India, Italië, Mexico en het Verenigd Koninkrijk), 250 patiënten per behandelgroep. Om deze 500 patiënten te includeren werden 1493 patiënten gescreend; 332 voldeden niet aan de inclusiecriteria, 473 zagen af van deelname en voor 188 patiënten waren er andere redenen om niet deel te nemen. De mediane follow-up (met een database lock op 1 maart 2024) bedroeg 67 maanden. Er waren 151 patiënten met een recidief en 114 patiënten (48 in de inductiegroep en 66 in de controlegroep) waren overleden. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 46 jaar, 87 procent van de patiënten had een ECOG-performancestatus van 0, 70 procent van de patiënten had een FIGO-stadium IIB, 2 procent had stadium IVA. 82 procent had een squameuze histologie en 43 procent had positieve lymfeklieren. De meeste patiënten werden in het Verenigd Koninkrijk (76 procent) en Mexico (20 procent) geïncludeerd.
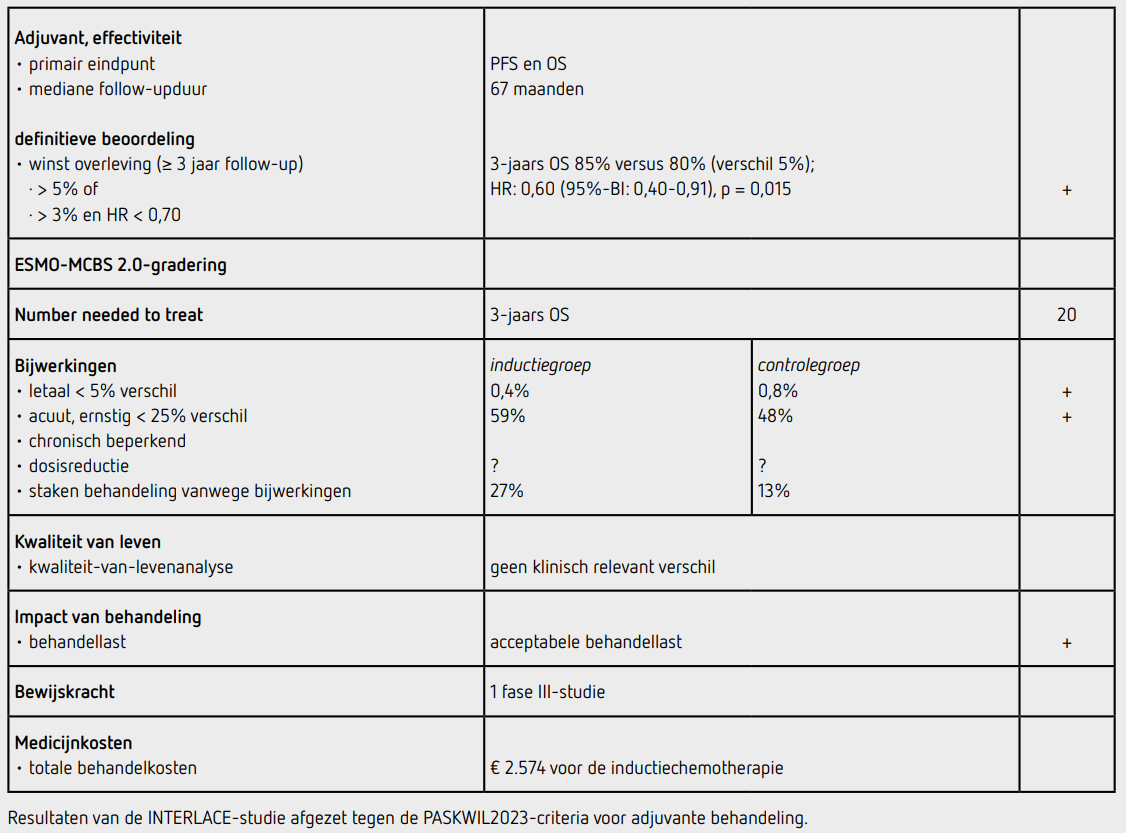
Het uiteindelijke primaire eindpunt OS was statistisch significant beter in de inductiegroep dan in de controlegroep (HR: 0,60 [95%-BI: 0,40-0,91]; p = 0,015). De 3-jaars OS was 85 procent in de inductiegroep en 80 procent in de controlegroep. Het OS-voordeel was min of meer consistent over de vooraf gespecifieerde subgroepen, maar meer uitgesproken bij patiënten zonder aangedane lymfeklieren. Naast de verbeterde OS werd ook een langere PFS in de inductiegroep dan in de controlegroep aangetoond (HR: 0,65 [95%-BI: 0,46-0,91]; p = 0,013). De 5-jaars PFS was 72 procent in de inductiegroep en 64 procent in de controlegroep. Van de 250 patiënten in de inductiegroep ontvingen 245 patiënten ten minste één gift chemotherapie, waarbij 211 patiënten (84 procent) alle 6 giften hebben gekregen en 230 patiënten (92 procent) ten minste 5 giften. Bij 29 patiënten (12 procent) waren bijwerkingen de reden om de chemotherapie vroegtijdig te staken. Tijdens de radiochemotherapie kregen 169 patiënten (68 procent) in de inductiegroep en 197 patiënten (79 procent) in de controlegroep 5 giften cisplatine. 212 patiënten (85 procent) in de inductiegroep en 224 patiënten (90 procent) in de controlegroep kregen ten minste 4 giften. Cisplatine werd vroegtijdig gestaakt vanwege bijwerkingen bij 68 patiënten (27 procent) in de inductiegroep en 33 patiënten (13 procent) in de controlegroep. Uitwendige radiotherapie werd binnen de studie gegeven aan 242 patiënten (97 procent) in de inductiegroep en aan 231 patiënten (92 procent) in de controlegroep. Daarnaast kregen enkele patiënten in beide groepen (4 versus 8 patiënten) uitwendige radiotherapie buiten de studie. Brachytherapie werd binnen de studie bij 238 patiënten (98 procent) in de inductiegroep en bij 224 patiënten (97 procent) in de controlegroep gegeven. Uitwendige radiotherapie werd binnen de studie met IMRT gegeven aan 102 patiënten (41 procent) in de inductiegroep en 93 patiënten (37 procent) in de controlegroep. 3D-beeldgeleide brachytherapie werd bij 72 patiënten (30 procent) in de inductiegroep en bij 68 patiënten (30 procent) in de controlegroep gegeven. De mediane behandelduur van de radiotherapie was 45 dagen (range 36-88) in de beide behandelgroepen. Bijwerkingen van graad 3 of hoger traden op bij 54 patiënten (22 procent) tijdens de inductiechemotherapie. Bijwerkingen van graad 3 of hoger tijdens de gehele behandeling traden op bij 147 patiënten (59 procent) in de inductiegroep en bij 120 patiënten (48 procent) in de controlegroep. De meest voorkomende bijwerkingen van graad 3 of hoger waren neutropenie (19 versus 5 procent), diarree (8 versus 12 procent) en vermoeidheid (11 versus 6 procent). Drie patiënten overleden binnen 30 dagen na het afronden van de behandeling, één patiënt in de inductiegroep (respiratoir falen) en twee patiënten in de controlegroep (sepsis en longembolie). Geen van de overlijdens werd gerelateerd aan de behandeling.
Zowel tijdens de inductiebehandeling als gedurende de gehele behandelperiode werd een klinisch niet-significant verslechterde kwaliteit van leven waargenomen in de inductiegroep vergeleken met de controlegroep (gedefinieerd als minder dan 5 punten afname op een schaal van 0-100 ten opzichte van baseline). Een jaar na behandeling was er helemaal geen verschil in kwaliteit van leven meer tussen beide groepen.
Kwaliteit van de studie en interpretatie van de uitkomsten
De INTERLACE-studie is een investigator initiated studie die in vijf landen is uitgevoerd. De meeste patiënten zijn in twee landen geïncludeerd, met name (76 procent) in het Verenigd Koninkrijk. De inclusieduur van de studie is erg lang (10 jaar) waarbij het aantal te includeren patiënten verlaagd is van 700 naar 500 patiënten. Veel patiënten (41 procent) hebben afgezien van deelname. Na een mediane follow-up van 67 maanden zijn 114 patiënten (23 procent) overleden, met een 5-jaars overleving in de controlegroep van 72 procent, terwijl de studie ontworpen was op 192 overlijdens met de aanname dat de 5-jaars overleving in de controlegroep 60 procent zou zijn. De betere overleving in de studie kan veroorzaakt zijn doordat patiënten met aangedane lymfeklieren boven de aorta-bifurcatie geëxcludeerd zijn voor studiedeelname. Daarnaast was het percentage patiënten met een lokaal zeer uitgebreid cervixcarcinoom (FIGO stadia III-IVA) relatief laag. Ook zal de gehele behandeling, ook na ontstaan van recidief of metastasen, sinds 2012 dusdanig zijn verbeterd dat dit tot een gunstiger overleving kan lijden dan van tevoren ingeschat. Ondanks het lagere aantal overlijdens is het overlevingsvoordeel statistisch significant en worden de data als voldoende matuur beschouwd. Uit de resultaten van de studie wordt niet duidelijk hoeveel patiënten na het ontstaan van een recidief systemische therapie ontvingen en welke therapie dit was.
Dit vergroot de onzekerheid van de bijdrage van inductiechemotherapie aan de uiteindelijke overlevingswinst. Of inductiechemotherapie van toegevoegde waarde is bij de huidige behandeling van het cervixcarcinoom is ook onduidelijk omdat sinds de start van de studie de radiotherapeutische behandeling veranderd is. Deze veranderingen zijn nauwelijks meegenomen in de INTERLACE-studie. In de studie is 70 procent van de patiënten behandeld zonder optimalisatie voor het tumorvolume, zoals nu gebruikelijk is. Daarnaast heeft maar 30 procent van de patiënten 3D-beeldgeleide behandeling gekregen, hetgeen nu ook standaard is.
Discussie
In de INTERLACE-studie wordt een statistisch significant overlevingsvoordeel aangetoond voor toevoegen van inductiebehandeling met chemotherapie aan standaard radiochemotherapie ten opzichte van radiochemotherapie alleen bij patiënten met een primair gediagnosticeerd lokaal gevorderd cervixcarcinoom (HR: 0,60 [95%-BI: 0,40-0,91]; p = 0,015). De 3-jaars OS verbetert van 80 procent naar 85 procent. De resultaten van dit eindpunt voldoen aan de PASKWIL2023-criteria voor adjuvante behandeling voor een positief advies. Ook de PFS was statistisch significant beter in de inductiegroep vergeleken met de controlegroep.
De behandeling met inductiechemotherapie gaat gepaard met extra toxiciteit, hoewel dat met name hematologisch van aard is en voornamelijk graad 1 en 2 bijwerkingen betreft. De meeste patiënten voltooiden de 6 cycli en vervolgens met de radiochemotherapie starten. Het is onduidelijk hoe de toevoeging van chemotherapie aan radiochemotherapie zich verhoudt tot het toevoegen van pembrolizumab aan chemoradiatie volgens de KEYNOTE-A18-studie.4 Daarnaast is het onduidelijk wat de meerwaarde is van inductiechemotherapie bij de huidige meer effectieve bestralingstechnieken. Deze onderwerpen worden in een separate plaatsbepaling geadresseerd.
Kosten
De behandeling met carboplatine AUC2 en paclitaxel 80 mg/m2 kost bij een lichaamsoppervlak van 2,0 m2 en een klaring van 90 ml/min 429 euro per gift (bron: medicijnkosten.nl d.d. augustus 2025). De totale medicatiekosten van 6 giften komen daarmee op 2.574 euro.
Conclusie
In de hier besproken INTERLACE-studie wordt bij patiënten met een primair gediagnosticeerd lokaal gevorderd cervixcarcinoom, FIGO 2008 stadium IB1 met aangedane lymfeklieren of stadia IB2-IVA (uitgezonderd stadium IIIA en aangedane lymfeklieren boven de aorta-bifurcatie) na een follow-up van mediaan 67 maanden een statistisch significant langere overleving gezien na toevoeging van inductiebehandeling met 6 wekelijkse giften carboplatine en paclitaxel aan standaardbehandeling met radiochemotherapie met 5 procent verschil in 3-jaars OS (HR: 0,60 [95%-BI: 0,40-0,91]; p = 0,015). Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor adjuvante behandeling. Opgemerkt dient te worden dat de radiotherapeutische behandeling in de studie niet conform de hedendaagse behandeling is.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Wenzel HH, Bekkers RL, Lemmens VE et al. No improvement in survival of older women with cervical cancer: a nationwide study. Eur J Cancer 2021;151:159-67.
- McCormack M, Eminowicz G, Gallardo D et al. Induction chemotherapy followed by standard chemoradiotherapy versus standard chemoradiotherapy alone in patients with locally advanced cervical cancer (GCIG INTERLACE): an international, multicentre, randomised phase 3 trial. Lancet 2024;404(10462):1525-35.
- Lorusso D, Xiang Y, Hasegawa K et al. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. Lancet 2024;403(10434):1341-50.