
Inleiding
Met ruim 2200 nieuwe gevallen in 2022 is het endometriumcarcinoom in Nederland de meest voorkomende gynaecologische maligniteit.1 Het endometroïde subtype komt met 85 procent het meest frequent voor. Vijf jaar na diagnose is 80 procent van de patiënten nog in leven en bij diagnose heeft ongeveer 20 procent van de patiënten FIGO-stadium III of IV ziekte. De gebruikelijke eerstelijns systemische behandeling van het primair gemetastaseerde of gerecidiveerde endometriumcarcinoom bestaat uit driewekelijkse toedieningen van carboplatine en paclitaxel.
Een hoge microsatellietinstabiliteit (MSI-H) of een mismatch repair-deficiëntie (dMMR), somatisch verworven of in het kader van het lynchsyndroom, komt voor in 28 procent van de endometriumcarcinomen.2 Mede in verband hiermee is veel onderzoek verricht naar het effect van behandeling met programmed death-1 (PD-1)-remmers.
In de RUBY ENGOT-EN6-studie gaf toevoeging van dostarlimab aan eerstelijns carboplatine en paclitaxel bij het gerecidiveerd of gevorderd (stadium III en IV) endometriumcarcinoom een verbetering in PFS en OS ten opzichte van placebo, waarbij met name patiënten met een dMMR-tumor baat leken te hebben van deze toevoeging.3 Deze verbetering leidde tot een positief cieBOM-advies.4 In de KEYNOTE-868/NRG-GY018-studie leidde toevoeging van pembrolizumab aan eerstelijns chemotherapie voor patiënten met een gerecidiveerd of gevorderd endometriumcarcinoom zowel bij patiënten met een MMR-proficiënte (pMMR) als een dMMR-tumor tot een winst in PFS die voldoet aan de PASKWIL2023-criteria voor een positief advies. Ook in deze studie lijkt het effect een stuk groter bij patiënten met een dMMR-tumor.5
In de hier te bespreken DUO-E-studie wordt behandeling met durvalumab toegevoegd aan carboplatine en paclitaxel gevolgd door onderhoudsbehandeling met durvalumab met of zonder olaparib onderzocht bij patiënten met een gevorderd of gerecidiveerd endometriumcarcinoom.6
Er zijn vroegklinische data die een synergistisch effect suggereren van PARP-remmers en immuuncheckpointremmers, mogelijk door verandering in de expressie van immuuncheckpointreceptoren door de PARP-geïnduceerde DNA-schade. Dit effect zou onafhankelijk van de MMR-status optreden. In de Nederlandse eenarmige fase II-studie DOMEC werd het effect onderzocht van de combinatie van olaparib en durvalumab bij 55 voorbehandelde patiënten met gemetastaseerd endometriumcarcinoom. De resultaten van deze studie voldeden met een PFS na 6 maanden van 34 procent en een mediane PFS van 3,4 maanden niet aan de vooraf vastgestelde grenzen voor effectiviteit.7 EMA heeft durvalumab geregistreerd in combinatie met carboplatine en paclitaxel als behandeling voor patiënten met een primair gevorderd of gerecidiveerd endometriumcarcinoom gevolgd door onderhoudsbehandeling met durvalumab monotherapie bij patiënten met een dMMR-tumor en onderhoudsbehandeling met durvalumab en olaparib bij patiënten met een pMMR-tumor.
1. Kankersoort en lijn van behandeling
Eerstelijnsbehandeling met durvalumab toegevoegd aan carboplatine en paclitaxel gevolgd door onderhoudsbehandeling met durvalumab met of zonder olaparib werd onderzocht bij patiënten met een gevorderd of gerecidiveerd endometriumcarcinoom.
2. Vergelijking met de referentiebehandeling in Nederland
In de Nederlandse praktijk bestaat de eerstelijnsbehandeling van het gevorderd of gerecidiveerd endometriumcarcinoom uit driewekelijkse toedieningen van carboplatine en paclitaxel. Hiermee komt de standaardbehandeling in de studie overeen met de huidige standaardbehandeling in Nederland. Dostarlimab toegevoegd aan eerstelijns chemotherapie wordt sinds eind april 2025 vergoed voor patiënten met een dMMR-endometriumcarcinoom en werd nog niet toegepast ten tijde van de uitvoering van deze studie.
3. Methoden van de studie
De DUO-E-studie is een dubbelblind, placebogecontroleerde, gerandomiseerde fase III-multicenterstudie voor patiënten met een gevorderd of gerecidiveerd endometriumcarcinoom. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn, een ECOG-performancestatus van 0 of 1 te hebben en een nieuw gediagnosticeerd FIGO-stadium III of IV of een gerecidiveerd endometriumcarcinoom. Patiënten met een sarcoom werden geëxcludeerd.
Patiënten werden 1:1:1 gerandomiseerd tussen behandeling met (1) chemotherapie in de vorm van carboplatine AUC 5 of 6 en paclitaxel 175 mg/m2 intraveneus elke 3 weken gedurende 6 cycli plus placebo gevolgd door onderhoudsbehandeling met dubbele placebo (controlegroep), (2) chemotherapie plus durvalumab 1120 mg elke 3 weken gedurende 6 cycli gevolgd door onderhoudsbehandeling met durvalumab 1500 mg elke 4 weken plus placebo (durvalumabgroep), en (3) chemotherapie plus durvalumab gevolgd door onderhoudsbehandeling met durvalumab plus olaparib 300 mg tweemaal daags per os (olaparibgroep). De behandeling werd gestratificeerd naar MMR-status (proficiënt versus deficiënt), ziektestatus (nieuwe diagnose versus recidief) en geografische regio (Azië versus de rest van de wereld).
Dosisaanpassing van carboplatine, paclitaxel en olaparib was toegestaan, van durvalumab niet. De toediening van alle middelen mocht worden uitgesteld of onderbroken. De behandeling kon vroegtijdig worden afgebroken op verzoek van de patiënt, bij klinische verslechtering van de conditie van de patiënt, om veiligheidsredenen of wegens het starten van een andere oncologische behandeling.
De primaire eindpunten van de studie waren progressievrije overleving (PFS) beoordeeld door de onderzoeker volgens RECIST 1.1 in de durvalumabgroep versus de controlegroep en in de olaparibgroep versus de controlegroep. Secundaire eindpunten waren onder andere overleving (OS), progressievrije overleving van de eerstvolgende behandeling (PFS2), objectieve responskans (ORR), kwaliteit van leven en veiligheid. Een CT-scan voor evaluatie werd in de eerste 18 weken elke 9 weken verricht en daarna elke 12 weken tot ziekteprogressie. Na ziekteprogressie werden patiënten elke 12 weken beoordeeld voor PFS2 en elke 2 maanden voor overleving. In de eerste 18 weken werd elke 3 weken kwaliteit van leven gemeten met de vragenlijsten EORTC QLQ-C30, EORTC QLQE-N24, EQ-5D-5L, PGIS en PGIC en daarna elke 4 weken tot aan PFS2. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0. Data over vervolgbehandelingen zijn niet verzameld in deze studie. MMR-status werd centraal bepaald voor randomisatie met immuunhistochemie met het Ventana MMR RxDx-panel (Roche Diagnostics).
Volgens het ontwerp van de studie waren er in totaal ongeveer 699 patiënten nodig, waarbij de tweezijdige alfa van 0,05 gesplitst werd. De twee vergelijkingen (durvalumabgroep versus controlegroep en olaparibgroep versus controlegroep) werden ieder in eerste instantie getest met een alfa van 0,025 volgens een gatekeeping-procedure. De verwachte mediane PFS in de controlegroep was 12 maanden. De vergelijking van de durvalumabgroep met de controlegroep had bij 299 events 80 procent power als de hazard ratio (HR) voor PFS 0,70 was; de vergelijking van de olaparibgroep met de controlegroep had bij 281 events meer dan 99 procent power als de HR voor de PFS 0,55 was. De primaire analyse was gepland als de follow-up voldoende matuur was voor beide vergelijkingen. Er was een interim PFS-analyse voor futiliteit gepland bij 50 procent van het geplande aantal events (grens voor futiliteit was een HR van 1,15). Er waren 2 geplande interim-analyses voor OS, waarvan de eerste plaatsvond op hetzelfde moment als de primaire PFS-analyse (bij een verwacht aantal overlijdens van 208). Voor deze interim-analyse werd een significantiegrens van 0,0011 voor de durvalumabgroep en van 0,0006 voor de olaparibgroep aangehouden volgens de O’Brien-Fleming-methode voor verdeling van de alfa. De tweede interim-analyse voor OS is gepland nadat 244 patiënten overleden zijn.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
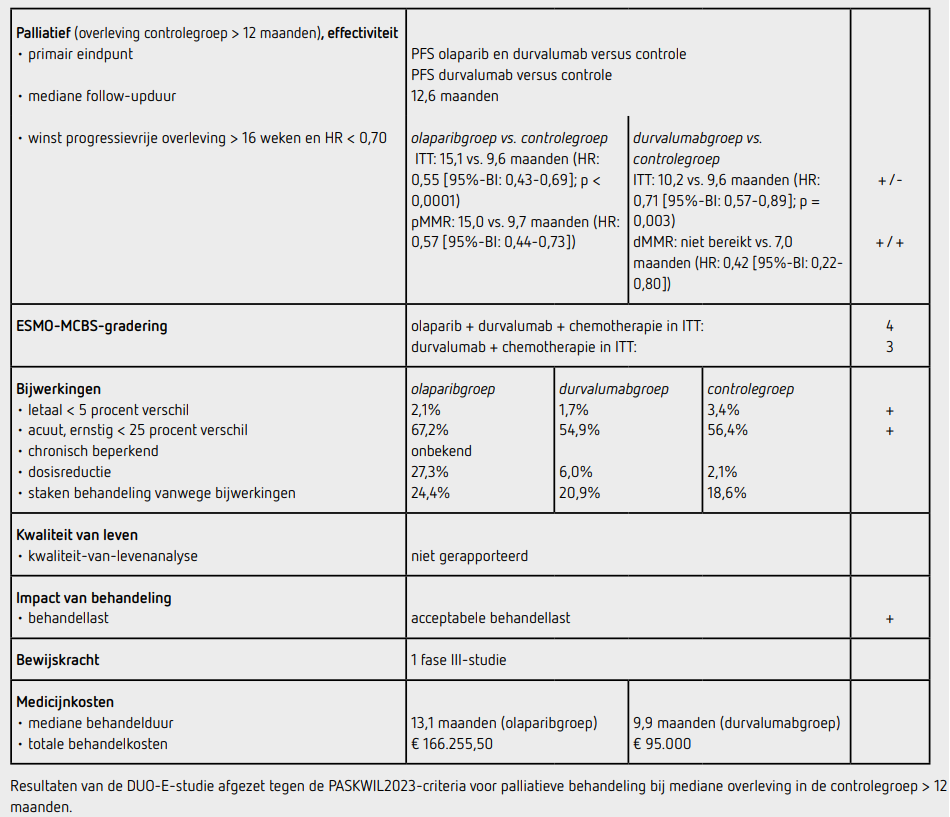
Tussen 2 juni 2020 en 20 april 2022 werden 718 patiënten geïncludeerd in 22 landen: 241 patiënten in de controlegroep, 238 patiënten in de durvalumabgroep en 239 patiënten in de olaparibgroep. Ten tijde van de data-cutoff bedroeg de mediane follow-up 12,6 maanden in de controlegroep en 15,4 maanden in de durvalumabgroep en de olaparibgroep. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar; ongeveer 80 procent van de patiënten had een pMMR-tumor, 28 procent van de patiënten kwam uit Azië en bij 48 procent van de patiënten betrof het een primaire diagnose. Er waren 173 patiënten in de controlegroep, 139 patiënten in de durvalumabgroep en 126 patiënten in de olaparibgroep met een recidief of overlijden. De PFS in de intention-to-treat (ITT) populatie was statistisch significant beter in de durvalumabgroep dan in de controlegroep (HR: 0,71 [95%-BI: 0,57-0,89]; p = 0,003). De mediane PFS bedroeg 10,2 maanden (95%-BI: 9,7 14,7) in de durvalumabgroep versus 9,6 maanden (95%-BI: 9,0 9,9) in de controlegroep. Het verschil in PFS in vooraf gespecificeerde, exploratieve subgroepanalyses was groter voor patiënten met een dMMR-endometriumcarcinoom in de durvalumabgroep versus de controlegroep (mediaan niet bereikt [95%-BI: niet bereiktniet bereikt] versus 7,0 maanden [95%-BI: 6,7-14,8]; HR: 0,42 [95%-BI: 0,22-0,80]), dan voor patiënten met een pMMR-endometriumcarcinoom in de durvalumabgroep versus de controlegroep (mediaan 9,9 [95%-BI: 9,4-12,5] versus 9,7 maanden [95%-BI: 9,2-10,1]; HR: 0,77 [95%-BI: 0,60-0,97]). De PFS in de ITT-populatie was ook statistisch significant beter in de olaparibgroep dan in de controlegroep (HR: 0,55; 95%-BI: 0,43-0,69; p < 0,0001). De mediane PFS bedroeg 15,1 maanden (95%-BI: 12,6-20,7) in de olaparibgroep versus 9,6 maanden (95%-BI: 9,0-9,9) in de controlegroep. De mediane PFS bij patiënten met een dMMR-tumor was mediaan 31,8 maanden (95%-BI: 12,4-niet bereikt) in de olaparibgroep en 7,0 maanden (95%-BI: 6,7-14,8) in de controlegroep (HR: 0,41; 95%-BI: 0,21 0,75). Bij patiënten met een pMMR-tumor was de mediane PFS 15,0 maanden (95%-BI: 12,4-18,0) in de olaparibgroep en 9,7 maanden (95%-BI: 9,2-10,1) in de controlegroep (HR: 0,57; 95%-BI: 0,44-0,73). Een exploratieve vergelijking tussen de olaparibgroep en de durvalumabgroep liet bij patiënten met een dMMR-tumor een HR voor PFS van 0,97 (95%-BI: 0,49-1,98) zien. Bij patiënten met een pMMR-tumor was de HR voor PFS 0,76 (95%-BI: 0,59-0,99) voor de olaparibgroep versus de durvalumabgroep. Behalve een verschil in PFS tussen de patiënten met een dMMR- en een pMMR-tumor leken niet-Aziatische patiënten (HR: 0,59 [95%-BI: 0,45-0,76]) meer baat te hebben bij behandeling met durvalumab dan patiënten van Aziatische komaf (HR: 0,98 [95%-BI: 0,65-1,49) en patiënten met een PDL-1-positieve tumor (HR: 0,63 [95%-BI: 0,48-0,83]) meer dan patiënten met een PDL-1-negatieve tumor (HR: 0,89 [95%-BI: 0,59-1,34]). De OS-data zijn nog niet matuur. 236 patiënten (97,9 procent) in de controlegroep, 235 patiënten (98,7 procent) in de durvalumabgroep en 238 patiënten (99,6 procent) in de olaparibgroep kregen ten minste 1 gift studiemedicatie. In controlegroep, de durvalumabgroep en de olaparibgroep was de totale incidentie van toxiciteit van graad 3 of hoger respectievelijk 56,4 procent, 54,9 procent en 67,2 procent. De totale incidentie van graad 3 of hogere neutropenie was respectievelijk 23,3 procent, 21,7 procent en 26,0 procent en de totale incidentie van graad 3 of hogere anemie respectievelijk 14,4 procent, 15,7 procent en 23,5 procent. Respectievelijk 3,4 procent, 1,7 procent en 2,1 procent van de patiënten overleed ten gevolge van de behandeling. Bijwerkingen leidden tot staken van (een deel van) de studiemedicatie in 44 patiënten (18,6 procent) in de controlegroep, 49 patiënten (20,9 procent) in de durvalumabgroep en 58 patiënten (24,4 procent) in olaparibgroep. Minimaal 1 dosisreductie van olaparib of placebo vanwege bijwerkingen werd gemeld bij 5 patiënten (2,1 procent) in de controlegroep, bij 14 patiënten (6,0 procent) in de durvalumabgroep en bij 65 patiënten (27,3 procent) in de olaparibgroep.
Kwaliteit van de studie en interpretatie van de uitkomsten
De keuze van de referentiebehandeling is conform het huidige behandellandschap. De studie is placebogecontroleerd en met adequate doseringen en adequate ondersteunende behandeling uitgevoerd zonder verschil tussen de 3 behandelarmen. Na progressie is er geen mogelijkheid tot crossover. In de DUO-E-studie worden de durvalumabgroep en de olaparibgroep formeel niet onderling met elkaar vergeleken waardoor de bijdrage van olaparib aan het effect in de olaparibgroep niet kan worden vastgesteld. Bij het ontwerp van de studie kon vermoed worden dat het effect van durvalumab verschillend was voor patiënten met een dMMR- en pMMR-tumor. Hier werd voor gestratificeerd, maar het was geen aanleiding om de inclusie te limiteren tot 1 van beide groepen of verschillende cohorten te genereren, zoals in de KEYNOTE-868-studie. In dat geval had een uitspraak over de effectiviteit voor de verschillende MMR-typen beter onderbouwd kunnen worden. Ten tijde van de eerste interim-analyse werd geen statistisch significant verschil in OS tussen de verschillende groepen gevonden. Een tweede interim-analyse voor OS is gepland nadat 244 patiënten overleden zijn. Analyses van kwaliteit van leven zijn nog niet beschikbaar.
Discussie
In de DUO-E-studie wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt PFS van palliatieve behandeling met durvalumab en olaparib in combinatie met carboplatine en paclitaxel ten opzichte van standaardbehandeling bij patiënten met een gevorderd of gerecidiveerd endometriumcarcinoom (HR: 0,55 [95%-BI: 0,43 0,69]; p < 0,0001) met een verschil in mediane PFS van 5,5 maanden. Dit resultaat voldoet aan de PASKWIL2023-criteria voor palliatieve behandeing bij een mediane overleving in de controlegroep van meer dan 12 maanden voor een positief advies. EMA heeft de combinatie van olaparib en durvalumab met chemotherapie alleen goedgekeurd voor patiënten met een pMMR-tumor.
Tevens wordt in de DUO-E-studie een statistisch significant voordeel aangetoond voor het primaire eindpunt PFS van palliatieve behandeling met durvalumab ten opzichte van standaardbehandeling bij patiënten met een gevorderd of gerecidiveerd endometriumcarcinoom (HR: 0,71 [95%-BI: 0,57 0,89]; p = 0,003) met een verschil in mediane PFS van 0,6 maanden. Dit resultaat voldoet niet aan de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep van meer dan 12 maanden voor een positief advies. Behandeling met durvalumab en chemotherapie voldoet voor de subgroep patiënten met een dMMR-tumor wel aan de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep van meer dan 12 maanden voor een positief advies (HR: 0,42 [95%-BI: 0,22 0,80], mediaan niet bereikt versus 7,0 maanden). EMA heeft voor deze subgroep een positief advies afgegeven voor de behandeling met durvalumab en chemotherapie. Hierbij dient opgemerkt te worden dat de dMMR-groep in de DUO-E-studie slechts uit 20 procent van de geïncludeerde patiënten bestaat. Het effect van durvalumab bij patiënten met een dMMRtumor is consistent met de eerder gevonden resultaten in deze patiëntengroep bij behandeling met dostarlimab en pembrolizumab toegevoegd aan eerstelijns chemotherapie.4,5 OS-data zijn nog niet matuur.
Graad 3 of hogere toxiciteit werd vaker gezien in de olaparibgroep, maar dit is consistent met de bekende bijwerkingen van de individuele componenten van dit behandelregime. In deze studie en de literatuur waarnaar verwezen wordt, ontbreekt een duidelijke biologische rationale voor de mogelijke effectiviteit van PARPremmers bij endometriumcarcinoom. Ook zijn er geen andere fase II of IIIstudies waaruit de effectiviteit van een PARP-remmer bij endometriumcarcinoom als monotherapie of in combinatie met immuuntherapie blijkt. De Nederlandse DOMEC-studie die deze combinatie (zonder chemotherapie) onderzocht was negatief. Recent zijn de resultaten van deel 2 van de RUBY-studie op een congres gepresenteerd.8 In deze studie werden patiënten gerandomiseerd tussen chemotherapie met dostarlimab gevolgd door onderhoudsbehandeling dostarlimab en niraparib of chemotherapie met placebo en placeboonderhoud. Het is niet bekend wat het aandeel in de gerapporteerde PFS-winst is van dostarlimab tijdens chemotherapie of onderhoudsbehandeling met niraparib. Het blijft dus onduidelijk wat de rol van PARP-remmers is bij het gemetastaseerd endometriumcarcinoom en welke bijdrage olaparib heeft aan de PFSwinst bij de pMMR-patiënten in de DUO-E-studie. De plaats van PARP-remmers in het Nederlandse behandellandschap bij gemetastaseerd endometriumcarcinoom zal nader bepaald moeten worden.
5. Kosten
De marktprijs van durvalumab bedraagt 609 euro per 2,4 ml ampul van 120 mg (bron: medicijnkosten.nl d.d. april 2025). Dit komt neer op 5.684 euro voor de 3-wekelijkse toediening tijdens de chemotherapie en 7.612 euro voor de 4-wekelijkse onderhoudsbehandeling. De marktprijs van olaparib bedraagt 45,72 euro per tablet van 150 mg. Dit komt neer op 5.121 euro voor 4 weken onderhoudsbehandeling. De mediane behandelduur in de olaparibgroep was 13,1 maanden met mediaan 9,8 maanden durvalumab onderhoud en mediaan 9,2 maanden olaparib onderhoud, wat neerkomt op 166.256 euro voor de gehele behandeling. De mediane behandelduur in de durvalumabgroep was 9,9 maanden met mediaan 7,4 maanden durvalumab onderhoud, wat neerkomt op een totale prijs van 95.000 euro.
Conclusie
In de hier besproken DUO-E-studie wordt bij patiënten met een gevorderd of gerecidiveerd endometriumcarcinoom een statistisch significant langere PFS gezien na palliatieve behandeling met durvalumab en olaparib toegevoegd aan chemotherapie dan na standaardbehandeling (HR: 0,55 [95%-BI: 0,43-0,69]; p < 0,0001). EMA heeft durvalumab met chemotherapie goedgekeurd voor patiënten met een dMMR-tumor en durvalumab in combinatie met olaparib met chemotherapie voor patiënten met een pMMR-tumor. Beide behandelingen voldoen voor deze subgroepen aan de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep van meer dan 12 maanden. De onderbouwing met biologische en vroegklinische data voor toevoeging van PARP-remmers bij endometriumcarcinoom is nog beperkt.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Levine DA. The Cancer Genome Atlas Research Network Integrated genomic characterization of endometrial cancer. Nature 2013;497:67-73.
- Mirza MR, Chase DM, Slomovitz BM et al. Dostarlimab for primary advanced or recurrent endometrial cancer. N Engl J Med 2023;388(23):2145-58
- NVMO-commissie ter beoordeling van Oncologische Middelen (BOM): Dostarlimab toegevoegd aan chemotherapie bij het gevorderd of gerecidiveerd endometriumcarcinoom. Med Oncol 2024;27(4):36-40.
- Eskander RN, Sill MW, Beffa, et al. Pembrolizumab plus chemotherapy in advanced endometrial cancer. N Engl J Med 2023;388(23):2159-70.
- Westin SN, Moore K, Chon HS et al. Durvalumab plus carboplatin/paclitaxel followed by maintenance durvalumab with or without olaparib as firstline treatment for advanced endometrial cancer: The phase III DUOE trial. J Clin Oncol 2023; 42(3):283-99.
- Post CC, Westermann AM, Boere IA et al. Efficacy and safety of durvalumab with olaparib in metastatic or recurrent endometrial cancer (phase II DOMEC trial). Gyn Oncol 2022; 165(2):223-9.
- Mirza MR, Ghamande S, Hanker LC et al. Progression-free survival (PFS) in primary advanced or recurrent endometrial cancer (pA/rEC) in the overall and mismatch repair proficient (MMR/MSS) populations and in histological and molecular subgroups: Results from part 2 of the RUBY trial. Ann Oncol 2024;9(suppl_5):1-8.