Inleiding
De behandelmogelijkheden bij het gevorderd of gemetastaseerd niercelcarcinoom (RCC) zijn in de laatste 10 jaar sterk toegenomen. De 5-jaarsoverleving van alle (dus ook niet-gemetastaseerde) RCC-patiënten in Nederland is tussen 2005 en 2015 gestegen van 54 naar 66 procent.1
De huidige standaard eerstelijnsbehandeling bij patiënten met een gevorderd of gemetastaseerd heldercellig RCC met een goede prognose volgens de risicoscore van het International Metastatic Renal Cell Carcinoma Database Consortium (IMDC) is een tyrosinekinaseremmer (TKI); meestal sunitinib of pazopanib. In 2020 zijn de combinaties van pembrolizumab plus axitinib en avelumab plus axitinib door de EMA als behandeling voor alle risicogroepen geregistreerd, en door de commissie BOM beoordeeld en voorzien van (voorlopig) positieve adviezen. De plaats van deze combinatiebehandelingen in de behandeling van patiënten met een goede IMDC-prognose is nog onduidelijk.2 Sinds begin 2019 worden patiënten met een intermediaire of slechte IMDC-prognose met duale immuuntherapie (ipilimumab en nivolumab) behandeld.3
Als tweedelijnsbehandeling wordt in Nederland meestal gekozen voor cabozantinib of nivolumab. Daarnaast is de combinatie van lenvatinib met everolimus beschikbaar. Bij het ontbreken van directe vergelijkingen zullen er voor therapiekeuze en keuze voor monotherapie of combinatiebehandeling verschillende argumenten zijn, waaronder het meest relevante behandeldoel (progressievrije overleving [PFS], totale overleving [OS], hazard ratio [HR], kans op complete respons), impact van toxiciteit en relevantie van primair twee versus één type medicament.
In de hier te bespreken CheckMate 9ER-studie wordt behandeling met nivolumab gecombineerd met cabozantinib vergeleken met sunitinib in de eerste lijn bij patiënten met een gevorderd of gemetastaseerd heldercellig RCC ongeacht de risicoscore.4 Nivolumab is een zogenaamde checkpointremmer en grijpt aan op de programmed death-1 receptor (PD-1-receptor). Deze interactie zorgt voor up-regulatie van T-celactivatie. Cabozantinib is een multitarget-TKI gericht op VEGFR-1, VEGFR-2, VEGFR-3, MET, TYRO3, MER en AXL, hetgeen mogelijk onderscheidend is ten opzichte van andere (smaller werkende) TKI’s. Cabozantinib is als monotherapie geregistreerd voor de eerstelijns- en tweedelijnsbehandeling van gemetastaseerd heldercellig RCC.
De veiligheid van deze combinatie werd eerst in een kleine dose finding study (fase I-studie) onderzocht en veilig bevonden.5 Er zijn geen klinische aanwijzingen voor synergie tussen cabozantinib en immuuntherapie, maar cabozantinib zou een aanvullend immuunmodulerend effect kunnen hebben. De EMA heeft de combinatie van nivolumab met cabozantinib geregistreerd voor eerstelijnsbehandeling bij volwassenen patiënten met een gevorderd RCC.
1. Kankersoort en lijn van behandeling
Combinatiebehandeling met nivolumab en cabozantinib werd in deze studie onderzocht bij patiënten met een niet eerder systemisch behandeld gevorderd of gemetastaseerd heldercellig RCC. Patiënten uit elke prognosecategorie volgens de IMDC-risicoscore konden deelnemen.
2. Vergelijking met de referentiebehandeling in Nederland
In de CheckMate 9ER-studie wordt eerstelijns palliatieve behandeling met nivolumab en cabozantinib vergeleken met sunitinib. In Nederland wordt aan patiënten met een gevorderd of gemetastaseerd heldercellig RCC in de eerste lijn een TKI gegeven (sunitinib of pazopanib) bij patiënten met een goede prognose volgens de IMDC-risicoscore, en een combinatie van nivolumab en ipilimumab bij patiënten met een intermediaire of slechte prognose, mits er geen contraindicatie is voor combinatie-immuuntherapie. Ook kan onafhankelijk van de IMDC-risicoscore gekozen worden voor pembrolizumab met axitinib. Ten tijde van de (start van) inclusie van deze studie was de standaard eerstelijnsbehandeling in Nederland voor patiënten met een gevorderd of gemetastaseerd heldercellig RCC een behandeling met sunitinib of pazopanib.
3. Methode en kwaliteit van de studie
CheckMate 9ER is een gerandomiseerde fase III-multicenterstudie (open label) voor patiënten met een gevorderd of gemetastaseerd heldercellig RCC. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn, meetbare ziekte (volgens RECIST 1.1) te hebben en een Karnofsky-index van 70 of hoger. Patiënten mochten geen eerdere behandeling voor gemetastaseerde ziekte hebben gehad. Er diende een tumorbiopt beschikbaar te zijn voor biomarkerevaluatie. De volgende patiëntencategorieën werden geëxcludeerd: symptomatische metastasen in het centraal zenuwstelsel, actieve auto-immuunziekten, slecht gereguleerde hypertensie (systolisch ≥ 150 mmHg of diastolisch ≥ 90 mmHg), NYHA III/IV hartfalen of een doorgemaakt ischemisch cerebrovasculair of cardiaal event korter dan 6 maanden voorafgaand aan screening, symptomatisch trombo-embolisch event korter dan 6 maanden voorafgaand aan screening en actieve behandeling met immuunsuppressiva of steroïden (gelijkwaardig aan > 10 mg prednisolon per dag).
Patiënten werden 1:1 gerandomiseerd tussen behandeling met nivolumab plus cabozantinib of sunitinib. De behandeling werd gestratificeerd naar IMDC-risicogroep (goed versus intermediair versus slecht), geografische regio (Noord-Amerika, West-Europa versus de rest van de wereld) en mate van de PD-L1-expressie (≥ 1 versus < 1 procent). De dosering nivolumab was 240 mg en werd iedere 2 weken i.v. toegediend en de dosering cabozantinib was eenmaal daags 40 mg p.o. in een continu schema. Dosisreductie voor nivolumab werd niet toegestaan. Cabozantinib kon bij bijwerkingen verlaagd worden naar 20 mg éénmaal daags en vervolgens 20 mg éénmaal per 2 dagen. Indien een van de twee middelen wegens bijwerkingen werd gestaakt, kon het andere middel gecontinueerd worden. De dosering van sunitinib was eenmaal daags 50 mg p.o. gedurende 4 weken in een 6-wekenschema. Er was dosisreductie naar 37,5 mg éénmaal daags en vervolgens naar 25 mg éénmaal daags toegestaan. De behandeling werd gecontinueerd tot ziekteprogressie of onacceptabele bijwerkingen. Nivolumab werd voor een maximale duur van 2 jaar gegeven. Cross-over was niet toegestaan.
Het primaire eindpunt van de studie was PFS volgens RECIST 1.1 vastgesteld volgens geblindeerde onafhankelijke centrale evaluatie. Secundaire eindpunten waren OS, responskans (ORR), responsduur en veiligheid. Effectiviteit werd getest in de intention-to-treat-populatie (alle gerandomiseerde patiënten) en veiligheid werd getest in alle behandelde patiënten. Tweede PFS (PFS2) van de eerstvolgende behandeling na progressie werd als exploratief eindpunt geanalyseerd.
Bijwerkingen van de behandeling werden geëvalueerd volgens CTCAE 4.03. Tumormeting werd gedaan met CT- of MRI-scan bij start en na 12 weken, vervolgens iedere 6 weken tot week 60 en nadien iedere 12 weken.
Initieel werd de studie als 3-armige studie ontwikkeld, maar kort na initiatie (december 2017) werd arm B (nivolumab plus ipilimumab plus cabozantinib, voor 4 cycli, gevolgd door nivolumab plus cabozantinib) gestopt in verband met de eerste resultaten van de CheckMate 214-studie en KEYNOTE-426-studie. Ook werd toen de inclusie gewijzigd naar alle IMDC-risicogroepen, inclusief patiënten met een goed risicoprofiel, waarbij die groep niet groter dan 25 procent van de totale studiepopulatie mocht zijn.
In het ontwerp van de studie waren er 638 patiënten en 350 events (ziekteprogressie of overlijden) nodig om met 95 procent power en een tweezijdige alfa van 0,05 een HR van 0,68 voor ziekteprogressie of overlijden (PFS) vast te kunnen stellen, wat zou resulteren in een PFS-verlenging van 12,4 naar 18,2 maanden voor nivolumab-cabozantinib. Er werd gebruikgemaakt van de gestratificeerde logranktest voor de verschillen tussen de combinatiebehandelingen en sunitinib; PFS en OS werden met de Kaplan-Meier-methode geëvalueerd, en HR en 95%-betrouwbaarheidsinterval (95%- BI) werden geschat middels een Cox-regressiemodel.
De secundaire eindpunten OS en ORR werden hiërarchisch geanalyseerd. Als de analyse voor PFS significant was, kon OS geanalyseerd worden met tweezijdige alfa van 0,05. Twee interim-analyses, uit te voeren na ongeveer 65 en 83 procent van het beoogd aantal overlijdens, en een finale analyse om, OS vast te kunnen stellen, werden gepland. De finale analyse voor het primaire eindpunt PFS en de eerste interim-analyse voor OS zouden plaatsvinden 29 maanden na randomisatie van de eerste patiënt. Kwaliteit van leven werd als exploratief eindpunt geanalyseerd met behulp van de vragenlijsten Functional Assessment of Cancer TherapyKidney Symptom Index-19 Item Version (NFKSI-19) en Functional Assessment of Cancer Therapy- Kidney Symptom Index-Disease related Symptoms (FKSI-DRS) van het National Comprehensive Cancer Network (NCCN). De in dit artikel gerapporteerde data zijn afkomstig van de finale analyse voor PFS en de eerste interim-analyse voor OS.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen september 2017 en mei 2019 werden 651 patiënten geïncludeerd door 125 centra in 18 landen: 323 patiënten in de nivolumab-cabozantinib-groep en 328 patiënten in de sunitinib-groep. Op het moment van de finale analyse van het primaire eindpunt (maart 2020) bedroeg de mediane follow-up voor overleving 18,1 maanden (range: 10,6-30,6) en kregen 178 van de 323 patiënten (55 procent) in de nivolumab-cabozantinib-groep en 92 van de 328 patiënten (30 procent) in de sunitinib-groep nog behandeling. In beide groepen kregen 320 patiënten minstens 1 dosis van de toegewezen behandeling en de mediane behandelduur was 14,3 maanden (range: 0,2-27,3) in de nivolumab-cabozantinib-groep en 9,2 maanden (range: 0,8-27,6) in de sunitinib-groep.
De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 62 jaar, driekwart van de patiënten was mannelijk, ongeveer 70 procent had eerder een nefrectomie ondergaan en ongeveer 80 procent van de patiënten had twee of meer metastatische locaties, waarvan 75 procent longmetastasen, 40 procent lymfekliermetastasen en 23 procent skeletmetastasen hadden. Ook de IMDC-risicoscores waren vergelijkbaar, waarbij 22 procent tot de groep met een goede prognose behoorde, 58 procent tot de groep met een intermediaire prognose en 20 procent tot de groep met een slechte prognose.
In de nivolumab-cabozantinib-groep kregen 61 van de 142 patiënten (43 procent) een vervolgbehandeling na staken van de studiemedicatie; meestal een TKI (21,8 procent). In de sunitinib-groep kregen 108 van de 228 patiënten (47,4 procent) een vervolgbehandeling; meestal een PD-1- of PD-L1-remmer (29,4 procent).
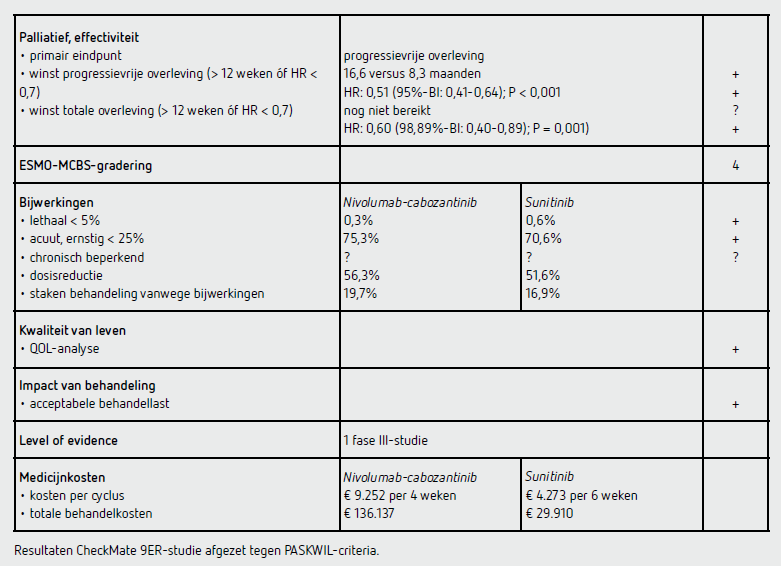
Het primaire eindpunt PFS was significant langer in de nivolumab-cabozantinib-groep dan in de sunitinib-groep (HR: 0,51 [95%-BI: 0,41-0,64]; P < 0,001). De mediane PFS bedroeg 16,6 maanden (95%-BI: 12,5-24,9) in de nivolumab-cabozantinib-groep en 8,3 maanden (95%-BI: 7,0-9,7) in de sunitinib-groep (Δ 8,3 maanden). De 1-jaars-PFS bedroeg 57,6 procent (95%-BI: 51,7-63,1) in de nivolumab-cabozantinib-groep en 36,9 procent (95%-BI: 31,1-42,8) in de sunitinib-groep. Het PFS-voordeel voor nivolumab-cabozantinib werd gezien in meerdere geplande subgroepen, maar het verschil was het grootst bij patiënten met botmetastasen (20,1 versus 4,4 maanden) en patiënten die eerder een nefrectomie hadden ondergaan (20,1 versus 9,2 maanden). Bij patiënten met een goede prognose volgens de IMDC-risicoscore (ruim 22 procent van alle patiënten) was het voordeel niet statistisch significant (HR: 0,62 [95%-BI: 0,38-1,01]). Patiënten met een PD-L1-expressie van 1 procent of hoger hadden een slechtere PFS (11,9 en 4,7 maanden) ten opzichte van patiënten met PD-L1-expressie lager dan 1 procent (17,7 en 9,3 maanden); het behandeleffect was onafhankelijk van PD-L1-expressie (HR voor PFS 0,49 [0,32-0,73] versus 0,52 [0,40-0,67]).
De mediane OS was nog niet bereikt in beide groepen, maar de geschatte overleving was langer in de nivolumab-cabozantinib-groep. De HR voor het secundair eindpunt OS in de nivolumab-cabozantinib-groep versus de sunitinib-groep was 0,60 (98,89%-BI: 0,40-0,89; P = 0,001) en de geschatte 1-jaarsoverleving bedroeg 85,7 procent (95%-BI: 81,3-89,1) versus 75,6 procent (95%-BI: 70,5-80,0).
De ORR was ook in het voordeel van nivolumab-cabozantinib: 55,7 procent (95%-BI: 50,1-61,2) versus 27,1 procent (95%-BI: 22,4-32,3; P < 0,001). In de nivolumab-cabozantinib-groep had 8,0 procent van de patiënten een complete respons versus 4,6 procent van de patiënten in de sunitinib-groep. De mediane tijd tot respons was 2,8 maanden in de nivolumab-cabozantinib-groep en 4,2 maanden in de sunitinib-groep. De mediane responsduur was 20,2 maanden (95%-BI: 17,3-niet bereikt) in de nivolumab-cabozantinib-groep versus 11,5 maanden (95%-BI: 8,3-18,4) in de sunitinib-groep.
In de nivolumab-cabozantinib-groep had 71,9 procent van de patiënten minstens eenmaal uitstel van nivolumab en 68,1 procent minstens eenmaal uitstel van cabozantinib. In de sunitinib-groep had 51,9 procent minstens éénmaal uitstel van sunitinib. Dosisreductie kwam veelvuldig voor in beide behandelgroepen: de dosering van cabozantinib werd bij 56,3 procent van de patiënten gereduceerd en de dosering van sunitinib werd bij 51,6 procent gereduceerd. Er werden geen data gegeven over mediane relatieve dosisintensiteit.
In de nivolumab-cabozantinib-groep had 99,7 procent van de patiënten een bijwerking (waarvan 75,3 procent graad 3-5). De behandeling van een van beide medicamenten werd bij 19,7 procent van hen in verband met bijwerkingen gestaakt en 5,6 procent van de patiënten staakte beide medicamenten. In de nivolumab-cabozantinib-groep overleed 1 patiënt (darmperforatie) ten gevolge van de behandeling.
In de sunitinib-groep had 99,1 procent van de patiënten een bijwerking (waarvan 70,6 procent graad 3-5). De behandeling met sunitinib werd bij 16,9 procent van de patiënten gestaakt in verband met bijwerkingen. In de sunitinib-groep overleden 2 patiënten ten gevolge van bijwerkingen (respectievelijk pneumonie en pneumonitis).
De meest voorkomende bijwerkingen (optredend bij meer dan 5 procent van de patiënten) van graad 3-5 in de nivolumab-cabozantinib-groep waren hypertensie (12,5 procent), hyponatriëmie (9,4 procent), handvoetsyndroom (7,5 procent), diarree (6,9 procent), lipasestijging (6,2 procent), hypofosfatemie (5,9 procent) en ALAT-stijging (5,3 procent). Immuuntherapiegerelateerde bijwerkingen kwamen bij ongeveer 60 procent van de patiënten voor. Hiervan was 24,7 procent hypothyroïdie. De meest voorkomende (graad 3-5 > 1 procent) immuuntherapiegerelateerde bijwerkingen waren hepatitis (2,5 procent), ALAT-stijging (2,2 procent), bijnierinsufficiëntie (1,9 procent) en diarree/colitis (1,6 procent). In totaal kreeg 19,1 procent van de patiënten in de nivolumab-cabozantinib-groep steroïden als behandeling voor immuuntherapiegerelateerde bijwerkingen en 3,8 procent voor langer dan 30 dagen. De meest voorkomende bijwerkingen van graad 3-5 in de sunitinib-groep waren hypertensie (13,1 procent), trombocytopenie (9,4 procent), hand-voetsyndroom (7,5 procent) en hyponatriëmie (5,9 procent).
Een kwaliteit van leven-analyse liet een vergelijkbare score in beide groepen, op het moment van initiatie van behandeling, zien. Tijdens en tot einde van de behandeling (91 weken) kon de kwaliteit van leven bij meer dan 80 procent van de patiënten geëvalueerd worden. Op basis van de vragenlijsten NFKSI-19 en FKSI-DRS was het kwaliteit van leven-profiel op alle meetmomenten significant beter in de nivolumab-cabozantinib-groep in vergelijking met sunitinib.
Discussie
In deze internationale gerandomiseerde fase III-studie werd voor de combinatiebehandeling met nivolumab-cabozantinib, in vergelijking met sunitinib, als eerstelijnsbehandeling voor patiënten met gevorderd of gemetastaseerd heldercellig RCC een statistisch significant en klinisch relevant voordeel aangetoond voor het primaire eindpunt PFS: 16,6 versus 8,3 maanden (HR: 0,51 [95%-BI: 0,41-0,64]; P < 0,001). De resultaten van deze studie voldoen aan de PASKWIL-criteria voor een positief advies. De PFS was significant beter in de nivolumab-cabozantinib-groep (HR: 0,62) voor patiënten met een intermediaire of slechte prognose volgens de IMDC-risicoscore, maar bij patiënten met een goede prognose was het voordeel (nog) niet statistisch significant. De vooraf gedefinieerde subgroepanalyse suggereert dat patiënten die eerder een nefrectomie hebben ondergaan en patiënten met botmetastasen een groter voordeel hebben van de combinatiebehandeling dan andere patiënten.
De combinatiebehandeling resulteerde ook in een verbeterde 1-jaarsoverleving (85,7 versus 75,6 procent) met een HR voor overlijden van 0,60, een grotere responskans (ORR: 55,7 versus 27,1 procent), een kortere tijd tot respons (2,8 versus 4,2 maanden), een langere responsduur (20,2 versus 11,5 maanden) en een betere kwaliteit van leven. De relatief korte follow-up maakt dat de mediane OS nog niet is bereikt. Een tweede interim-analyse en een finale analyse van de OS-data zijn gepland in het ontwerp van de studie.
Slechts 25,4 en 39,9 procent van de patiënten kreeg, na respectievelijk nivolumab-cabozantinib en sunitinib, een vervolgsysteembehandeling. Zoals was te verwachten kregen patiënten die een vervolgsysteemtherapie konden krijgen vaker een TKI na nivolumab-cabozantinib (21,8 versus 15,4 procent) en vaker een checkpointremmer na sunitinib (29,4 versus 6,3 procent).
Bijwerkingen kwamen in zowel de nivolumab-cabozantinib-groep als de sunitinib-groep frequent voor, maar het bijwerkingenprofiel van alle middelen is goed bekend. In de nivolumab-cabozantinib-groep waren geen onverwachte bijwerkingen. Het aantal immuuntherapiegerelateerde bijwerkingen bij de combinatiebehandeling lijkt niet anders te zijn dan in studies met nivolumab-monotherapie. De dosering van cabozantinib was lager (40 mg) dan gebruikelijk wanneer dit als monotherapie wordt gegeven, maar de ervaring leert dat de standaardbehandeling (60 mg) ook als monotherapie voor een groot deel van de patiënten te zwaar is. Ondanks de lagere dosering had 68,1 procent van de patiënten een uitstel van cabozantinib nodig, bij 56,3 procent van de patiënten was dosisreductie nodig en 7,5 procent van de patiënten staakte cabozantinib vanwege bijwerkingen.
In beide groepen kwam hypertensie van graad 3 of 4, hand-voetsyndroom, diarree, hyponatriëmie en hypothyroïdie vrij vaak voor, maar deze bijwerkingen zijn in ervaren handen meestal goed hanteerbaar. In de experimentele arm werd vaker lipasestijging, ALAT-stijging en hypofosfatemie gezien. In zowel de nivolumab-cabozantinib-groep als de sunitinib-groep werden dosisreducties, dosisinterrupties of definitief staken relatief frequent toegepast, wat suggestief is voor een beperkte tolerantie ondanks de strenge selectie van fitte patiënten. Een kwaliteit van leven-analyse laat zien dat de combinatiebehandeling resulteert in betere kwaliteit van leven en minder ziektegerelateerde klachten ten opzichte van sunitinib. Voor de eerstelijns palliatieve behandeling van gemetastaseerd heldercellig RCC zijn nu, naast nivolumab-cabozantinib, ook de combinaties nivolumab-ipilimumab en pembrolizumab-axitinib beschikbaar. Bij de combinatie nivolumab-cabozantinib en pembrolizumab-axitinib wordt gebruikgemaakt van twee middelen uit de twee groepen die aangetoond effectief zijn bij gemetastaseerd heldercellig RCC: VEGF-remming en PD-(L)1-blokkade. Het is bij progressie na een van deze combinatiebehandelingen niet duidelijk wat de meest effectieve vervolgbehandeling moet zijn, maar na falen van de combinatie van nivolumabipilimumab zijn diverse TKI’s beschikbaar.
De combinatiebehandeling resulteert in een langere ziektevrije overleving bij patiënten met gemetastaseerd heldercellig RCC ten koste van meer bijwerkingen en de vraag is of deze combinatiebehandeling betere overleving en kwaliteit van leven geeft ten opzichte van de meest optimale sequentiële behandeling. Voor de combinatie van nivolumab-cabozantinib lijkt het voordeel in PFS aan te houden (HR: 0,52 [95%-BI: 0,39-0,70]) tijdens tweedelijnsbehandeling na progressie (PFS2), wat suggereert dat de combinatiebehandeling voor een selecte groep patiënten beter is ten opzichte van sequentiële behandeling. Het bijwerkingenprofiel moet echter serieus meegenomen worden in de beoordeling van deze nieuwe palliatieve behandeloptie.
5. Kosten
De behandeling met nivolumab kost bij een vaste dosis van 240 mg 2.648,86 euro per toediening en 5.297,72 per behandelcyclus van 28 dagen (bron: medicijnkosten.nl d.d. 19 maart 2022). De kosten bij de mediane behandelduur van 13,3 maanden komen daarmee op 76.817 euro. De behandeling met cabozantinib kost 141,24 euro per dag en 3.954,72 euro per 28 dagen (bron: medicijnkosten.nl d.d. 19 maart 2022). De kosten bij de mediane behandelduur van 13,8 maanden komen daarmee op 59.320 euro. De totale kosten komen hiermee op 136.137 euro per patiënt.
Behandeling met sunitinib kost 152,60 euro per dag voor 50 mg (bron: medicijnkosten.nl d.d. 19 maart 2022). De totale kosten (mediane behandelduur 9,2 maanden) zijn dan 29.910 euro.
Conclusie
In de hier besproken CheckMate 9ER-studie wordt bij patiënten met een gevorderd of gemetastaseerd heldercellig RCC na een follow-up van mediaan 18,1 maanden een statistisch significant langere PFS gezien na eerstelijns palliatieve behandeling met nivolumab-cabozantinib dan na behandeling met sunitinib: mediaan 16,6 maanden (95%-BI: 12,5-24,9) versus 8,3 maanden (95%-BI: 7,0-9,7) (HR: 0,51 [95%-BI: 0,41-0,64]; P < 0,001). Bijwerkingen komen frequent voor, maar zijn in het algemeen hanteerbaar en kwaliteit van leven lijkt beter dan met sunitinib. Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL-criteria voor palliatieve behandeling. Er is bij deze behandeling sprake van zeer hoge kosten: ruim 130.000 euro per patiënt.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Richtlijncommissie Niercelcarcinoom. Opties voor eerstelijnsbehandeling bij gemetastaseerd RCC: plaats van avelumab-axitinib en pembrolizumab-axitinib in behandelarsenaal. Med Oncol 2020:23(3):31-2.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Eerstelijns combinatiebehandeling met nivolumab en ipilimumab bij gemetastaseerd heldercellig niercelcarcinoom. Med Oncol 2019;22(1):33-6.
- Choueiri TK, Powles T, Burotto M, et al; CheckMate 9ER Investigators. Nivolumab plus cabozantinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2021;384(9):829-41.
- Apolo AB, Nadal R, Girardi DM, et al. Phase I study of cabozantinib and nivolumab alone or with ipilimumab for advanced or metastatic urothelial carcinoma and other genitourinary tumors. J Clin Oncol 2020;38(31):3672-84.