
1. Inleiding
Patiënten met een irresectabel of gemetastaseerd urotheelcelcarcinoom (UCC) hebben een slechte prognose. De standaard eerstelijnsbehandeling is platinumbevattende chemotherapie. Deze is bij voorkeur met cisplatine, waarbij de mediane overleving bij deze patiënten 14 tot 15 maanden was in de tijd dat er geen vervolgbehandeling voorhanden was. Als patiënten een contra-indicatie hebben voor behandeling met cisplatine dan kunnen ze behandeld worden met carboplatinegebaseerde chemotherapie. In de JAVELIN Bladder-100studie werd aangetoond dat onderhoudsbehandeling met avelumab ten opzichte van observatie bij patiënten met een irresectabel of gemetastaseerd UCC in aansluiting op 4 tot 6 cycli eerstelijns platinumbevattende chemotherapie een statistisch significant overlevingsvoordeel oplevert.1 Tweedelijnsbehandeling met checkpointremmers kan overlevingswinst geven.2 Voor patiënten die progressief zijn na een platinumbevattend schema en een checkpointremmer is de huidige standaard derdelijns behandeling enfortumab vedotin.3
In de hier te bespreken EV-302-studie wordt behandeling met enfortumab vedotin in combinatie met pembrolizumab vergeleken met platinumbevattende chemotherapie bij patiënten met een niet eerder behandeld, lokaal gevorderd of gemetastaseerd UCC.4 EMA heeft enfortumab vedotin in combinatie met pembrolizumab goedgekeurd voor de eerstelijnsbehandeling van volwassenen met een irresectabel of gemetastaseerd UCC die fit genoeg zijn voor platinumbevattende chemotherapie.
2. Kankersoort en lijn van behandeling
Eerstelijnsbehandeling met enfortumab vedotin en pembrolizumab werd onderzocht bij patiënten met een irresectabel of gemetastaseerd UCC.
3. Vergelijking met de referentiebehandeling in Nederland
In Nederland wordt aan fitte patiënten met een irresectabel of gemetastaseerd UCC platinumbevattende chemotherapie gegeven in de eerste lijn. De referentiebehandeling voldoet daarmee aan de Nederlandse praktijk.
4. Methode en kwaliteit van de studie
De EV-302-studie is een gerandomiseerde fase IIImulticenterstudie voor patiënten met een irresectabel lokaal gevorderd of gemetastaseerd UCC. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0-2 te hebben. Inclusie van alle histologische subtypen was toegestaan. Geëxcludeerd werden patiënten die eerder behandeld waren met systemische therapie (behalve neoadjuvante of adjuvante chemotherapie na chirurgie met recidief ziekte langer dan 12 maanden na afronding van de therapie), waaronder PD(L)-1-remmers, patiënten met neuropathie van graad 2 of hoger, met onvoldoende gereguleerde diabetes mellitus en patiënten met een autoimmuunziekte die in de afgelopen 2 jaar hiervoor systemische therapie hadden gehad.
Patiënten werden 1:1 gerandomiseerd tussen behandeling met enfortumab vedotin in een dosis van 1,25 mg/kg intraveneus (maximaal 125 mg per dosis) op dag 1 en 8 in combinatie met pembrolizumab 200 mg intraveneus op dag 1 van een 3wekelijkse cyclus of chemotherapie, die bestond uit gemcitabine 1000 mg/m2 op dag 1 en 8 in combinatie met cisplatine 70 mg/m2 op dag 1 in een 3-wekelijkse cyclus. Patiënten met een eGFR tussen 30 en 60 ml/min/1,73m2, gehoorschade van graad 2 of hoger, een ECOG van 2 of hartfalen NYHA 3 werden behandeld met carboplatine (AUC 4,5-5) in plaats van cisplatine. Randomisatie werd gestratificeerd naar geschiktheid voor behandeling met cisplatine (geschikt versus ongeschikt), PD-L1-status (CPS < 10 versus CPS ≥ 10) en levermetastasen (aanwezig versus afwezig). Dosisaanpassing was niet toegestaan voor pembrolizumab, maar wel voor enfortumab vedotin tot 0,75 mg/kg. Dosisonderbreking vanwege toxiciteit was toegestaan tot maximaal 12 weken voor pembrolizumab, en maximaal 6 weken voor enfortumab vedotin. Enfortumab vedotin mocht gecontinueerd worden tot aan progressie of onacceptabele toxiciteit, pembrolizumab werd maximaal 35 maal toegediend. Er werden maximaal 6 cycli chemotherapie gegeven met de mogelijkheid tot onderhoudsbehandeling met bijvoorbeeld avelumab (tijdens de looptijd van de studie middels amendement toegestaan) als dit standaardzorg betrof.
De twee primaire eindpunten van de studie waren overleving (OS) en onafhankelijk volgens RECIST 1.1 beoordeelde progressievrije overleving (PFS). Initieel was er een derde behandelgroep in de studie (enfortumab vedotin en pembrolizumab gecombineerd met cisplatine of carboplatine), waarbij de alfa verdeeld werd over OS en PFS voor de vergelijking tussen de verschillende interventies. Deze derde behandelgroep is later verwijderd in een amendement. Het aantal benodigde patiënten werd verhoogd van 760 naar 860 om rekening te kunnen houden met onderhoudsbehandeling na chemotherapie. Secundaire eindpunten waren responskans volgens RECIST 1.1, responsduur, tijd tot progressie van pijn en veiligheid. Een CT-scan voor responsevaluatie werd verricht voor start van de behandeling, daarna elke 9 weken gedurende de eerste 18 maanden, en vervolgens elke 12 weken tot aan ziekteprogressie. Kwaliteit van leven werd gemeten met de vragenlijsten EQ 5D-5L en EORTC QLQ-C30. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.03. Data over vervolgbehandelingen werden verzameld. Volgens het uiteindelijke ontwerp van de studie waren 860 patiënten en 489 overlijdens nodig om met 93 procent power en een tweezijdige alfa van 0,045 een hazard ratio (HR) van 0,73 voor overlijden vast te kunnen stellen. Voor de PFS-analyse waren 526 PFSevents nodig om met 90 procent power en een tweezijdige alfa van 0,005 een HR van 0,70 voor PFS vast te stellen. Er werden één analyse voor PFS en twee analyses voor OS gepland, een interimanalyse en een eindanalyse. De interim-OS-analyse was gepland op het moment van de PFS-analyse. Wanneer PFS statistisch significant was kon de alfa worden hergebruikt voor de OSanalyse. In dat geval is de alfa voor de hier gerapporteerde interim-OS-analyse 0,01548. De secundaire eindpunten konden statistisch getest worden indien beide primaire eindpunten positief waren.
5. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
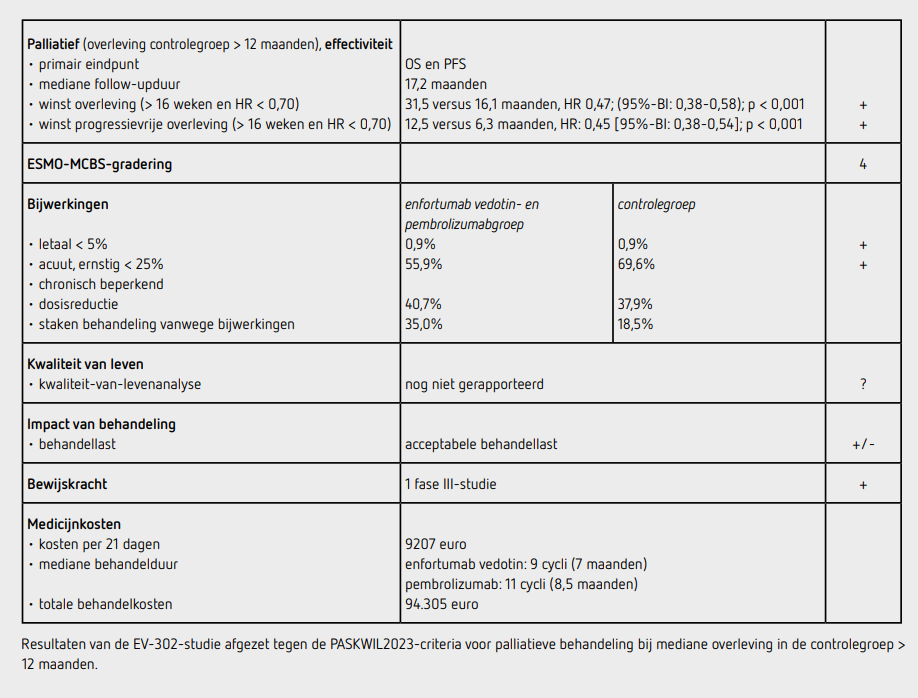
In totaal werden 886 patiënten geïncludeerd door 185 centra in 25 landen: 442 patiënten in de enfortumab vedotinpembrolizumabgroep (EVP-groep) en 444 patiënten in de controlegroep met chemotherapie. De uitgangskarakteristieken in de beide behandelgroepen waren goed vergelijkbaar: de mediane leeftijd was 69 jaar, ongeveer 27 procent van de patiënten had een tumor uitgaande van de hogere urinewegen, ongeveer 5 procent had een irresectabel lokaal gevorderd UCC, 23 procent had alleen lymfkliermetastasen, 54 procent was geschikt voor cisplatine en 58 procent had een CPS ≥ 10. Ten tijde van de data cut off op augustus 2023 bedroeg de mediane followup voor overleving 17,2 maanden. Er waren op dat moment 530 patiënten die een recidief hadden of waren overleden (223 in de EVP-groep en 307 in de controlegroep).
Het coprimaire eindpunt PFS was in de EVP-groep statistisch significant beter dan in de controlegroep (HR: 0,45 [95%-BI: 0,38-0,54]; p < 0,001). De mediane PFS was 12,5 maanden (95%-BI: 10,4-16,6) in de EVP-groep en 6,3 maanden (95%BI: 6,2-6,5) in de controlegroep. Op het moment van analyse waren 359 patiënten overleden (133 in de EVP-groep en 226 in de controlegroep).
Het coprimaire eindpunt OS was ook statistisch significant beter in de EVP-groep dan in de controlegroep (HR: 0,47 [95%-BI: 0,38 0,58]; p < 0,001). De mediane OS bedroeg 31,5 maanden (95%-BI: 25,4niet bereikt) in de EVP-groep en 16,1 maanden (95%-BI: 13,9-18,3) in de controlegroep. De geschatte 1jaars overleving was 78 procent in de EVP-groep en 61 procent in de controlegroep.
Het voordeel van enfortumab vedotin-pembrolizumab met betrekking tot OS en PFS werd gezien in alle vooraf gedefinieerde subgroepen. In de EVP-groep hadden meer patiënten een objectieve respons dan in de controlegroep, namelijk 67,7 procent versus 44,4 procent (p < 0,001).
De mediane behandelduur met enfortumab vedotin was 7,0 maanden (9 cycli) en met pembrolizumab 8,5 maanden (11 cycli), in de controlegroep was dit 4,1 maanden (6 cycli). In de EVP-groep kregen 140 patiënten (31,7 procent) en in de controlegroep kregen 313 patiënten (70,5 procent) een volgende lijn systemische antikankerbehandeling. 110 patiënten (78,6 procent van de patiënten met vervolgbehandeling en 24,9 procent van de totale groep) in de EVP-groep kregen platinumbevattende chemotherapie. In de controlegroep kregen 260 patiënten (83,1 procent van de patiënten met vervolgbehandeling en 58,6 procent van de totale controlegroep) een antiPD(L)1bevattende behandeling als eerstvolgende lijn, dit is inclusief onderhoudsbehandeling met avelumab (135 van de 444 patiënten [30,4 procent]).
In de EVP-groep kregen 440 patiënten (99,5 procent) ten minste één behandeling en in de controlegroep waren dit 433 patiënten (97,5 procent). In totaal hadden 246 patiënten (55,9 procent) patiënten behandeld met enfortumab vedotinpembrolizumab ten minste één bijwerking van graad 3 of hoger en in de controlegroep waren dit 301 (69,5 procent) patiënten. De meest voorkomende bijwerkingen van graad 3 of hoger in de EVP-groep en in de controlegroep waren maculopapuleuze uitslag (7,7 versus 0 procent), hyperglycemie (5,0 versus 0 procent), neutropenie (4,8 versus 30,0 procent) en trombocytopenie (0,5 en 19,4 procent).
Behandelingsgerelateerde bijwerkingen die leidden tot overlijden kwamen voor bij 4 patiënten (0,9 procent) in de EVPgroep (multiorgaanfalen, immuungemedieerde longziekte, diarree en asthenie; elk bij 1 patiënt) en ook bij 4 patiënten (0,9 procent) in de controlegroep (sepsis, febriele neutropenie, neutropene sepsis en myocardinfarct; elk bij 1 patiënt). Behandelingsgerelateerde bijwerkingen die resulteerden in dosisverlaging van 1 of meer geneesmiddelen in de EVP-groep en in de controlegroep kwamen voor in respectievelijk 40,7 procent en 37,9 procent van de patiënten; onderbreking of stopzetting van 1 van de behandelingen als gevolg van bijwerkingen kwam voor in respectievelijk 35,0 procent en 18,5 procent. In de EVP-groep werd enfortumab vedotin bij 29,5 procent van de patiënten gestaakt vanwege bijwerkingen en pembrolizumab bij 21,4 procent van de patiënten. Er is kwaliteit van leven (patient reported outcomes) gemeten, maar de analyse hiervan is nog niet gerapporteerd.
6. Discussie
In de EV-302-studie wordt een statistisch significant voordeel aangetoond voor beide coprimaire eindpunten PFS en OS van palliatieve behandeling met enfortumab vedotin en pembrolizumab ten opzichte van standaardbehandeling met platinumbevattende chemotherapie bij patiënten met een irresectabel lokaal gevorderd of gemetastaseerd urotheelcelcarcinoom van de urinewegen. Het verschil in OS was 15,4 maanden (31,5 maanden [95%-BI: 25,4niet bereikt] in de EVP-groep en 16,1 maanden [95%-BI: 13,9-18,3] in de controlegroep) met een HR: 0,47 (95%BI: 0,38-0,58); p < 0,001.
Deze resultaten voldoen aan de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is. Opgemerkt dient te worden dat een relatief beperkt percentage (30 procent) van de patiënten in de controlegroep een onderhoudsbehandeling heeft gekregen met avelumab; deze behandeling werd gedurende de inclusie van de EV-302s-tudie de nieuwe standaardbehandeling bij deze patiëntengroep. Bijwerkingen van graad 3 of hoger kwamen minder frequent voor in de EVP-groep dan in de controlegroep (55,9 procent versus 69,5 procent), maar het profiel van de bijwerkingen was substantieel anders met meer neuropathie, uitslag en diarree ten opzichte van de controlegroep waar het met name hematologische toxiciteit betrof. Er waren ook meer patiënten in de EVP-groep dan in de controlegroep die vanwege bijwerkingen de behandeling staakten. Hier zal in de dagelijkse praktijk met patiënten die meer comorbiditeit hebben rekening mee gehouden moeten worden. Omdat zowel pembrolizumab als enfortumab vedotin geen onderdeel zijn van de standaard eerstelijnsbehandeling is op basis van de uitkomsten van deze studie niet te bepalen wat de bijdrage van de twee afzonderlijke middelen is op het overlevingsvoordeel. De kosten van deze combinatiebehandeling zijn erg hoog.
7. Kosten
De behandeling met enfortumab vedotin en pembrolizumab kost bij een lichaamsgewicht van 80 kilo respectievelijk 3486 euro en 5721 euro per behandelcyclus van 21 dagen (bron: medicijnkosten.nl d.d. oktober 2024). De totale medicatiekosten van 9 cycli enfortumab vedotin (31.373 euro) en 11 cycli pembrolizumab (62.932 euro) komen daarmee op 94.305 euro.
8. Conclusie
In de hier besproken EV-302-studie wordt bij patiënten met een irresectabel lokaal gevorderd of gemetastaseerd urotheelcelcarcinoom na een followup van mediaan 17,2 maanden een statistisch significant langere overleving gezien na palliatieve behandeling met enfortumab vedotin en pembrolizumab dan na standaardbehandeling met platinumbevattende chemotherapie (verschil van 15,4 maanden; HR: 0,47 [95%-BI: 0,38-0,58]; p < 0,001). Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep langer dan 12 maanden is.
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Avelumab als onderhoudsbehandeling bij het urotheelcelcarcinoom van de urinewegen. Med Oncol 2021:24(3):37-40.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab als tweedelijnsbehandeling bij het urotheelcelcarcinoom. Med Oncol 2017;20(8):43-6.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Enfortumab vedotin als derdelijnsbehandeling bij het lokaal gevorderd of gemetastaseerd urotheelcelcarcinoom. nvmo.org/bom/enfortumab-vedotin-als-derdelijnsbehandelingbij-het-lokaal-gevorderd-of-gemetastaseerd-urotheelcelcarcinoom/.
- Powels T, Valderrama BP, Gupta S, et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024;390(10):875-88.