Inleiding
Fusie-eiwitten met een ROS proto-oncogen 1, tyrosinekinasereceptor (ROS1) bevorderen het tumorverwekkende potentieel via hyperactivatie van daaronder gelegen signaaltransductieroutes, wat leidt tot ongeremde celproliferatie.
De huidige Nederlandse richtlijn voor niet-kleincellig longcarcinoom (NSCLC) adviseert patiënten met een gemetastaseerd NSCLC met een ROS1-translocatie in de eerste lijn te behandelen met de tyrosinekinaseremmer (TKI) crizotinib. Behandeling met crizotinib geeft op basis van niet-gerandomiseerd onderzoek een responskans (ORR) van ongeveer 70 procent en een progressievrije overleving (PFS) van rond de 10 tot 19 maanden.1-2
Tot 36 procent van de patiënten met een ROS1-positief NSCLC heeft hersenmetastasen ten tijde van het vaststellen van gemetastaseerde ziekte en veel andere patiënten ontwikkelen later hersenmetastasen. Crizotinib heeft een matige penetratie in het centraal zenuwstelsel (CZS). Bijna de helft van de ROS1-positieve NSCLC-patiënten behandeld met crizotinib heeft (groei van) CZS-metastasen als eerste en enige plaats van ziekteprogressie.
Entrectinib is een potente remmer van ROS1, anaplastisch lymfoomkinase (ALK), en de tropomyosinereceptorkinasen (TRK) TRKA, TRKB en TRKC. In dierproeven is aangetoond dat entrectinib de bloedhersenbarrière kan passeren en resulteert in substantiële concentraties in het CZS.
Er zijn 3 klinische studies verricht naar de veiligheid en activiteit van entrectinib bij volwassen patiënten met een gevorderd of gemetastaseerd carcinoom: 2 fase I-studies (ALKA-372-001 en STARTRK-1) en 1 niet-gerandomiseerde fase II-studie (STARTRK-2). De effectiviteit van entrectinib is onderzocht in een gepoolde analyse met patiënten vanuit deze 3 studies met een gemetastaseerd, TKI-naïef, ROS1-positief NSCLC.3
1. Kankersoort en lijn van behandeling
Entrectinib is door de EMA geregistreerd als monotherapie bij volwassenen met een gevorderd ROS1-positief NSCLC die niet eerder behandeld zijn met een ROS1-remmer. Entrectinib is door de EMA geregistreerd in het kader van een zogeheten ‘voorwaardelijke toelating’. Dit betekent dat aanvullende data over de effectiviteit van dit geneesmiddel wordt vereist.
2. Onderbouwing voor een niet-gerandomiseerde studie
Entrectinib is onderzocht in nietgerandomiseerd onderzoek bij volwassen patiënten met een gevorderd, ROS1-positief, TKI-naïef NSCLC. Een ROS1-genfusie wordt aangetoond bij 1 à 2 procent van de NSCLC-patiënten. De Nederlandse richtlijn adviseert patiënten met een ROS1-positief NSCLC in de eerste lijn te behandelen met crizotinib. Er wordt gesteld dat entrectinib een betere penetratie in het CZS heeft dan crizotinib.
3. Methode en kwaliteit van de studie
De werkzaamheid en veiligheid van entrectinib is onderzocht in een gepoolde analyse met volwassen patiënten met een gemetastaseerd of lokaal uitgebreid ROS1-genfusiepositief NSCLC afkomstig uit de volgende 3 studies:
- ALKA-372-001: een fase I-studie verricht in 2 centra in Italië;
- STARTRK-1: een fase I-studie verricht in 10 centra in Korea, Spanje en de Verenigde Staten;
- STARTRK-2: een fase II-studie, ten tijde van de analyse nog lopende in meer dan 150 centra in 15 landen.
De aanwezigheid van een ROS1-genfusie werd lokaal en/of centraal bepaald. In de studies werden ook patiënten met een solide maligniteit met een herschikking van de genen NTRK, ALK of ROS1 (non-NSCLC) geïncludeerd. Deze patiënten zijn niet geïncludeerd in de nu te bespreken effectiviteitsanalyses.
Om voor inclusie in de gepoolde effectiviteitsanalyse in aanmerking te komen, dienden patiënten een ECOG-performancestatus van 0 tot 2 te hebben, een levensverwachting van ten minste 3 maanden (ALKA-372-001 en STARTRK-1) of ten minste 4 weken (STARTRK-2), goede orgaanfuncties en meetbare ziekte volgens RECIST 1.1. Geïncludeerde patiënten mochten niet eerder zijn behandeld met een ROS1-remmer en moesten ten minste 1 dosis entrectinib van ten minste 600 mg hebben ontvangen. Er moest een follow-up zijn van ten minste 12 maanden vanaf de start van behandeling met entrectinib. Patiënten met een CZS-lokalisatie konden worden geïncludeerd als zij asymptomatisch waren of als de symptomen onder controle waren na behandeling. Geëxcludeerd werden patiënten met een tweede maligniteit, een verlengde QTc-tijd, actieve infecties, gastro-intestinale ziekte, interstitiële longziekte, interstitiële fibrose, perifere neuropathie graad 2 of hoger, of in het verleden een tyrosinekinaseremmer-geïnduceerde pneumonitis.
Ook de veiligheid van entrectinib is onderzocht in een gepoolde analyse met NSCLC-patiënten uit de eerder genoemde 3 studies. In deze analyse werden ook patiënten met een performancestatus van 2 of meer, met een follow-up korter dan 12 maanden, met een onbekende ROS1-status en patiënten die eerder waren behandeld met een ROS1-remmer meegenomen.
Entrectinib werd initieel, in de 2 fase I-studies, gegeven in een continue of intermitterende eenmaal daagse dosering variërend van 100 tot 1.600 mg. De gekozen continue dosering in de fase II-studie STARTRK-2 was eenmaal daags 600 mg per os. De behandeling met entrectinib werd gecontinueerd tot aan gedocumenteerde radiografische progressie, onaanvaardbare toxiciteit of terugtrekken uit de studie door de patiënt. Dosisreducties (maximaal 2 keer met 200 mg) werden toegestaan.
De coprimaire eindpunten van de geïntegreerde analyse waren objectieve responskans (ORR) en responsduur (DoR) bepaald middels geblindeerde, onafhankelijke centrale beoordeling. Secundaire eindpunten waren PFS bepaald middels geblindeerde, onafhankelijke centrale beoordeling, totale overleving (OS) en veiligheid. Vooraf gedefinieerde aanvullende secundaire eindpunten voor de groep patiënten met CZS-ziekte bij inclusie waren intracraniële responskans, intracraniële responsduur, intracraniële PFS en tijd tot CZS-progressie bepaald middels geblindeerde, onafhankelijke centrale beoordeling. Bij de evaluatie van deze CZS-eindpunten werd elke patiënt met progressie buiten het brein gecensored, tenzij de behandeling werd gecontinueerd beyond progression.
Responsevaluatie met CT of MRI (inclusief hersenscans) vond plaats voor start van de behandeling, na 4 weken behandeling en vervolgens elke 8 weken tot ziekteprogressie. Bij patiënten zonder CZS-lokalisatie bij start van de behandeling werd nadien alleen op indicatie een hersenscan gemaakt. Alle beeldvorming werd lokaal en centraal (geblindeerd en onafhankelijk) beoordeeld volgens RECIST 1.1. Toxiciteit werd gemeten bij elk patiëntencontact met CTCAE 4.03.
Bij een verwachte ORR van 70 procent waren ten minste 50 patiënten nodig om een ondergrens van het tweezijdige 95%-betrouwbaarheidsinterval (95%-BI) voor ORR van ten minste 50 procent te kunnen aantonen. Een ORR van meer dan 50 procent werd beschouwd als klinisch relevant. DoR is een tweede primair eindpunt, maar er wordt niet vermeld welke responsduur statistisch dan wel klinisch significant wordt geacht.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
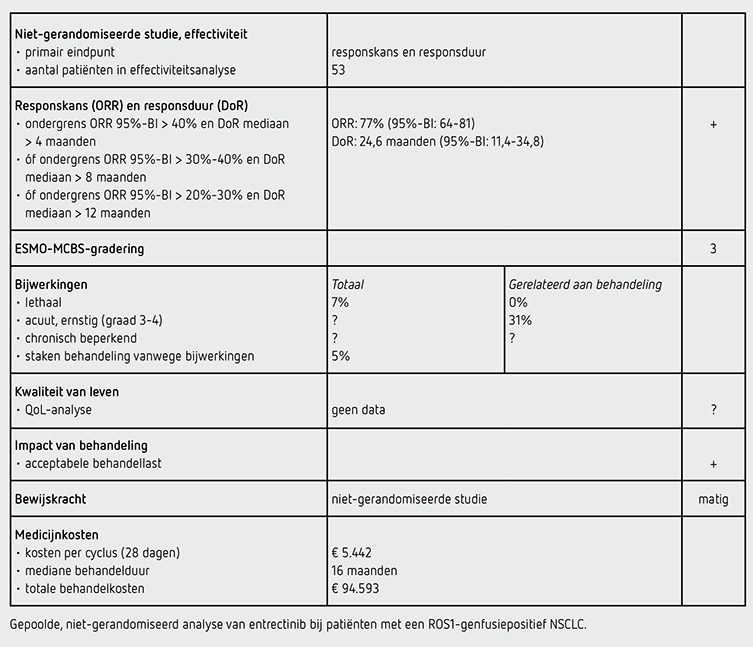
Vanuit de 3 genoemde studies werden 53 patiënten met een ROS1-positief NSCLC geïncludeerd voor de geïntegreerde effectiviteitsanalyse en 134 patiënten voor de veiligheidsanalyse. Inclusie van patiënten in ALKA-372-001 werd gestart in oktober 2012, in STARTRK-1 in augustus 2014 en in STARTRK-2 in november 2015. Data tot 31 mei 2018 werden meegenomen in de effectiviteitsanalyse. De mediane follow-upduur was 15,5 maanden. De mediane behandelduur varieerde tussen de 14,6 maanden (bij patiënten met een CD74-ROS1-fusie), 14,2 maanden (bij patiënten met een non-CD74-ROS1-fusie) en 21,5 maanden (bij patiënten bij wie het type genfusie niet bekend was). De mediane leeftijd van de geïncludeerde patiënten was 53 jaar, 47 patiënten (89 procent) hadden een performancestatus van 0 of 1 en 36 patiënten (68 procent) kregen voorafgaand 1 of meer lijnen systeemtherapie (waaronder 2 patiënten crizotinib). In totaal 23 patiënten (43 procent) hadden bij lokale beoordeling CZS-gelokaliseerde ziekte bij start van de behandeling. Bij centrale beoordeling hadden 20 patiënten CZS-gelokaliseerde ziekte; 12 hiervan hadden evalueerbare CZS-gelokaliseerde ziekte (laesies groter dan 1 cm).
In de effectiviteitsanalyse hadden 41 van de 53 patiënten respons middels onafhankelijke centrale beoordeling (ORR: 77 procent [95%-BI: 64-81]). Een complete respons hadden 3 patiënten (6 procent) en 38 patiënten (72 procent) een partiële respons. Stabiele ziekte als beste respons had 1 patiënt (2 procent). De responsen traden vroeg op, meestal al bij de eerste evaluatie. Respons trad onafhankelijk van type genfusie op. De mediane responsduur middels onafhankelijke centrale beoordeling was 24,6 maanden (95%-BI: 11,4-34,8). De mediane PFS was 19,0 maanden (95%-BI: 12,2-36,6). De mediane OS was niet te bepalen (95%-BI: 15,1-niet bereikt). Van de 20 patiënten met volgens centrale beoordeling in het CZS gelokaliseerde ziekte bij aanvang van de behandeling hadden 11 patiënten (55 procent) een CZS-respons met een mediane intracraniële responsduur van 12,9 maanden (95%-BI: 5,6-niet bereikt). Eerder gegeven radiotherapie beïnvloedde de kans op CZS-respons niet. De totale PFS van deze subgroep was mediaan 13,6 maanden (95%-BI: 4,5-niet bereikt) en de mediane intracraniële PFS was 7,7 maanden (95%-BI: 3,8-19,3).
De veiligheidsanalyse werd verricht bij 134 patiënten met een ROS1-positief NSCLC behandeld met ten minste 1 dosis entrectinib. De mediane behandelduur in deze populatie was 8,3 maanden. Bij alle 134 patiënten is ten minste één bijwerking gerapporteerd, meestal mild van aard (graad 1-2). Het aantal patiënten met ernstige bijwerkingen (graad 3-4), onafhankelijk van de oorzaak, wordt niet gerapporteerd. Bijwerkingen van graad 3 gerelateerd aan de behandeling traden op bij 41 patiënten (31 procent) en 5 patiënten (4 procent) hadden bijwerkingen van graad 4 gerelateerd aan de behandeling. De meest gerapporteerde ernstige bijwerkingen gerelateerd aan de behandeling met entrectinib waren toename van gewicht (n = 10) en neutropenie (n = 5). Tijdens behandeling met entrectinib zijn 9 patiënten (7 procent) overleden. Bij geen van deze patiënten werd het overlijden gerelateerd aan de entrectinib. Bij 46 patiënten (34 procent) werd de dosis entrectinib verlaagd vanwege bijwerkingen. Bij 7 patiënten (5 procent) werd de entrectinib gestaakt vanwege bijwerkingen.
Discussie
Bij 1 tot 2 procent van de NSCLC-patiënten is een ROS1-genfusie de oncogene driver. De huidige Nederlandse richtlijn adviseert om deze patiënten, op basis van resultaten van een fase I-studie, te behandelen met de ROS1-tyrosinekinaseremmer crizotinib. Behandeling met crizotinib geeft een ORR van ongeveer 70 procent en een PFS van rond de 10 tot 19 maanden.2 Crizotinib heeft een matige CZS-penetratie en bijna de helft van de patiënten behandeld met crizotinib heeft (groei van) metastasen in het CZS als eerste en enige plaats van ziekteprogressie. Entrectinib is een tyrosinekinaseremmer van onder andere ROS1 en passeert de bloed-hersenbarrière met substantiële concentraties in het CZS. De effectiviteit van entrectinib is, niet-gerandomiseerd, onderzocht in een gepoolde analyse bij 53 patiënten met een ROS1-genfusiepositief NSCLC, afkomstig uit 2 fase I-studies en 1 niet-gerandomiseerde fase II-studie. De analyse toont een ORR van 77 procent (95%-BI: 64-81), een mediane DoR van 24,6 maanden (95%-BI: 11,4-34,8) en een mediane PFS van 19,0 maanden (95%-BI: 12,2-36,6). Deze uitkomsten lijken niet substantieel te verschillen van de uitkomsten bereikt met behandeling met crizotinib.
Entrectinib lijkt ook effectief bij patiënten met in het CZS gelokaliseerde ziekte. Van de 20 geanalyseerde patiënten met intracraniële metastasen bij start van de behandeling hadden 11 patiënten (55 procent) een respons met een mediane intracraniële responsduur van 12,9 maanden (95%-BI: 5,6-niet bereikt). Dit zou kunnen duiden op een meerwaarde van entrectinib ten opzichte van crizotinib bij deze groep patiënten. De EMA heeft entrectinib geregistreerd in het kader van een zogeheten ‘voorwaardelijke toelating’. Om de werkzaamheid van entrectinib verder te karakteriseren bij patiënten met CZS-ziekte op baseline moet de vergunninghouder een gerandomiseerd, gecontroleerd onderzoek versus crizotinib bij behandelingsnaïeve NSCLC-patiënten met ROS1 uitvoeren en indienen voor 31 december 2027. Dit onderzoek loopt. Clinicaltrials.gov maakt melding van een gerandomiseerde studie met 220 patiënten met een ROS1-positief NSCLC met of zonder hersenmetastasen waarin crizotinib zal worden vergeleken met entrectinib (NCT04603807). De planning is dat deze studie patiënten gaat includeren tussen november 2021 en januari 2027. Het is echter de vraag of deze studie voldoende patiënten zal kunnen includeren nu entrectinib op de Europese en Amerikaanse markt is toegelaten.
De veiligheid van entrectinib werd onderzocht in een cohort van 134 patiënten met een ROS1-fusiepositief NSCLC behandeld met ten minste 1 dosis entrectinib. De mediane behandelduur met entrectinib in dit cohort was 8,3 maanden. De mediane behandelduur in het cohort patiënten behandeld met entrectinib in de effectiviteitsanalyse varieerde van mediaan 14,2 tot 21,5 maanden (afhankelijk van het type ROS1-genfusie); gemiddeld 16 maanden. Dat is twee keer zo lang. Het is aannemelijk dat de incidentie van toxiciteit in de klinische praktijk hoger zal zijn dan de toxiciteit gerapporteerd in deze veiligheidsanalyse. Behandeling met entrectinib wordt goed verdragen. In de veiligheidsanalyse trad aan de behandeling gerelateerde toxiciteit van graad 3 tot 4 op bij 35 procent van de patiënten. Bij 34 procent van de patiënten werd dosisreductie toegepast en 5 procent van de patiënten staakte de behandeling vanwege bijwerkingen.
5. Kosten
Behandeling met entrectinib 600 mg eenmaal daags kost 5.442 euro per 28 dagen (bron: medicijnkosten.nl d.d. 19 december 2021). De mediane behandelduur in de effectiviteitsanalyse van de populatie ROS1-positieve NSCLC-patiënten was (gewogen gemiddelde van de 3 medianen) 16 maanden. De totale kosten bij deze mediane behandelduur bedragen daarmee 94.593 euro. Ter vergelijking: behandeling met crizotinib 250 mg tweemaal daags (de huidige standaard) kost 4.822 euro per 28 dagen (bron: medicijnkosten.nl d.d. 19 december 2021) en heeft een mediane behandelduur van 64,5 weken.2 De totale kosten bij deze mediane behandelduur bedragen daarmee 77.726 euro. Entrectinib is in de sluis voor dure geneesmiddelen geplaatst. Er is nog geen vergoeding vanuit het basispakket.
Conclusie
Bij patiënten met gevorderd ROS1-positief NSCLC die niet eerder behandeld zijn met een ROS1-remmer, geeft behandeling met entrectinib een kans op respons van 77 procent (95%-BI: 64-81) met een responsduur van mediaan 24,6 maanden (95-%BI: 11,4-34,8). Deze uitkomsten voldoen aan de PASKWIL-criteria voor niet-gerandomiseerde studies voor een voorlopig positief advies. Dit advies is voorlopig in afwachting van de resultaten van een gerandomiseerde studie waarin entrectinib wordt vergeleken met crizotinib bij patiënten met hersenmetastasen. De EMA heeft gevraagd om de resultaten voor 31 december 2027 aan te leveren.
Dit advies is tot stand gekomen op basis van de uitkomsten van niet-gerandomiseerd onderzoek. De kwaliteit van het bewijs is matig. Het is waarschijnlijk dat met verder onderzoek de schatting van de grootte van het effect van de behandeling zal veranderen.
Referenties
- Mazières JG, Zalcman G, Crin L, et al. Crizotinib therapy for advanced lung adenocarcinoma and a ROS1 rearrangement: results from the EUROS1 cohort. J Clin Oncol 2015;33(9):992-9.
- Shaw AT, Ou SHI, Bang YJ, et al. Crizotinib in ROS1rearranged non-small-cell lung cancer. N Engl J Med 2014;371(21):1963-71.
- Drilon A, Siena S, Dziadziuszko R, et al. Entrectinib in ROS1 fusion-positive non-small-cell lung cancer: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020;21(2):261-70.