
Inleiding
Patiënten met een irresectabel of gemetastaseerd urotheelcelcarcinoom van de urinewegen (UCC) hebben een slechte prognose. De standaard eerstelijnsbehandeling is platinumbevattende chemotherapie. Deze is bij voorkeur met cisplatine, waarbij de mediane overleving bij deze patiënten 14 tot 15 maanden was in de tijd dat er geen vervolgbehandeling voorhanden was. Als patiënten een contra-indicatie hebben voor behandeling met cisplatine dan kunnen ze behandeld worden met carboplatine-gebaseerde chemotherapie. Recent werd een significante verbetering van de progressievrije en totale overleving aangetoond met eerstelijnsbehandeling met enfortumab vedotin en pembrolizumab vergeleken met platinumbevattende chemotherapie.1 Tweedelijnsbehandeling met checkpointremmers kan overlevingswinst geven.2 In de JAVELIN Bladder 100-studie werd aangetoond dat onderhoudsbehandeling met avelumab ten opzichte van observatie bij patiënten met een irresectabel of gemetastaseerd UCC in aansluiting op 4 tot 6 cycli eerstelijns platinumbevattende chemotherapie een statistisch significant overlevingsvoordeel oplevert.3 Voor patiënten die progressief zijn na een platinumbevattend schema en een checkpointremmer is de huidige standaard derdelijnsbehandeling enfortumab vedotin.4
Veranderingen in het gen dat codeert voor fibroblast growth factor receptor (FGFR) worden gezien bij ongeveer 20 procent van de patiënten met een lokaal gevorderd of gemetastaseerd UCC van de blaas en bij ongeveer 36 procent van de patiënten met een UCC van de hogere urinewegen. Deze veranderingen fungeren als oncogene drivers.5,6
Erdafitinib is een orale selectieve pan-FGFR-tyrosinekinaseremmer die in een eerdere eenarmige fase II-studie een responspercentage van 40 procent en een mediane progressievrije overleving (PFS) en overleving (OS) van respectievelijk 5,5 en 11,3 maanden heeft laten zien bij patiënten met een gemetastaseerd UCC die eerder zijn behandeld met een platinumbevattend chemotherapieschema.7
In het hier te bespreken cohort 1 van de THOR-studie is de meerwaarde onderzocht van erdafitinib in vergelijking met docetaxel of vinflunine bij patiënten met een irresectabel of gemetastaseerd UCC met een pathogene verandering in FGFR die eerder met maximaal twee lijnen systemische therapie zijn behandeld, waarvan ten minste 1 lijn uit een anti-PD-(L)1 antilichaam bestond.8 In cohort 2 van deze studie werden patiënten gerandomiseerd tussen pembrolizumab en erdafitinib. De resultaten van dit cohort zijn reeds gepubliceerd en hieruit bleek geen verschil in PFS en OS tussen beide behandelgroepen.9
EMA heeft erdafitinib als monotherapie goedgekeurd voor de behandeling van volwassen patiënten met een irresectabel of gemetastaseerd UCC, met pathogene veranderingen in het FGFR3-gen, die eerder ten minste 1 therapielijn met een PD-(L)1-remmer hebben gekregen in de irresectabele of gemetastaseerde behandelsetting.
1. Kankersoort en lijn van behandeling
Tweede- of derdelijns palliatieve behandeling met erdafitinib werd onderzocht bij patiënten met een irresectabel of gemetastaseerd UCC en een pathogene verandering in FGFR3.
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland worden fitte patiënten met een irresectabel of gemetastaseerd UCC na platinumbevattende chemotherapie behandeld met een checkpointremmer en in de derde lijn met enfortumab vedotin. Patiënten die niet fit genoeg zijn voor een platinumbevattend schema kunnen in de eerste lijn behandeld worden met pembrolizumab indien de PD-L1 combined positive score (CPS) ≥ 10 is. Vinflunine en docetaxel hebben geen plaats in de behandeling van het UCC in Nederland. Beide middelen worden niet vergoed voor deze indicatie. Ten tijde van inclusie van deze studie was enfortumab vedotin als derdelijns behandeling nog niet beschikbaar, en in die periode werd in Nederland op basis van fase II-data regelmatig paclitaxel als derdelijns behandeling voorgeschreven. De controlearm voldoet hiermee deels aan de destijds geldende Nederlandse praktijk.
3. Methode en kwaliteit van de studie
De THOR-studie is een gerandomiseerde, open-label, fase III-multicenterstudie voor patiënten met een irresectabel of gemetastaseerd UCC met een mutatie of fusie in FGFR3. Patiënten werden onderverdeeld in 2 cohorten. In cohort 1 werd erdafitinib vergeleken met docetaxel of vinflunine bij patiënten die eerder progressief waren na 1 of 2 eerdere systemische behandelingen waaronder een checkpointremmer. In cohort 2 werd erdafitinib vergeleken met pembrolizumab bij patiënten die nog niet eerder zijn behandeld met een checkpointremmer.9 In dit rapport worden de data besproken van cohort 1. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0, 1 of 2 te hebben. Patiënten moesten progressieve ziekte hebben tijdens of na een checkpointremmer en mochten niet meer dan 2 lijnen systemische therapie gehad hebben. Eerdere behandeling met (platinumbevattende) chemotherapie was niet vereist. Moleculaire analyse werd lokaal of door een centraal laboratorium verricht. Toegestane tests waren next generation sequencing (NGS), direct digital counting methodes of de Qiagen Therascreen FGFR RotorGene Q reverse-transcriptase– polymerase-chainreaction assay. Tumoren moesten een of meerdere mutaties hebben in FGFR3 (R248C, S249C, G370C of Y373C) of een of meerdere van de volgende fusies: FGFR2– BICC1, FGFR2–CASP7, FGFR3–TACC3_V1, FGFR3–TACC3_V3 of FGFR3–BAIAP2L1. Exclusiecriteria waren onder andere eerdere behandeling met een FGFR-remmer, hersenmetastasen of ernstige afwijkingen van de cornea of retina. Patiënten werden 1:1 gerandomiseerd tussen behandeling met erdafitinib eenmaal daags 8 mg in tabletvorm (op dag 14 van cyclus 1 kon de dosering opgehoogd worden naar 9 mg op geleide van de serum fosfaatspiegels) of chemotherapie naar keuze van de onderzoeker, die bestond uit docetaxel 75 mg/m2 of vinflunine 320 mg/m2 intraveneus op dag 1 van een 3-wekelijkse cyclus. Randomisatie werd gestratificeerd naar ECOG-performancestatus (0 en 1 versus 2), aanwezigheid van viscerale metastasen (ja versus nee), en geografische regio (Noord-Amerika versus Europa versus overig). De patiënten werden behandeld tot aan ziekteprogressie of onacceptabele toxiciteit. Dosisaanpassing was toegestaan voor erdafitinib tot 4 mg per dag, voor docetaxel tot 50 mg/m2 en voor vinflunine tot 250 mg/m2.
Dosisonderbreking vanwege toxiciteit was maximaal toegestaan gedurende 4 weken voor erdafitinib. Herstart van therapie na die periode mocht alleen na overleg met de medisch monitor. Het primaire eindpunt van de studie was overleving (OS). Secundaire eindpunten waren door de onderzoeker beoordeelde responskans volgens RECIST 1.1, progressievrije overleving (PFS), responsduur, veiligheid en kwaliteit van leven. Een CT-scan voor evaluatie werd verricht voor start van de behandeling en daarna elke 6 weken gedurende 6 maanden, vervolgens iedere 12 weken tot aan ziekteprogressie. Vanwege de associatie met diverse oogheelkundige bijwerkingen werd voor start van de behandeling oogheelkundig onderzoek verricht, inclusief een Amsler-test en optisch coherentie tomografie (OCT). De Amsler-test werd iedere 3 weken herhaald. Kwaliteit van leven werd gemeten met de vragenlijsten Functional Assessment of Cancer Therapy–Bladder Cancer, Patient Global Impression of Severity, en de EuroQol Group 5-Dimension 5-Level. Bijwerkingen van de behandeling werden geëvalueerd volgens CTCAE 4.03. Data over vervolgbehandelingen werden verzameld.
Volgens het ontwerp van de studie waren 280 patiënten en 208 overlijdens nodig om met 85 procent power en een tweezijdige alfa van 0,05 een hazard ratio (HR) van 0,65 vast te kunnen stellen in de intention to treat (ITT)-populatie. Er was een interim-analyse gepland voor effectiviteit en futiliteit nadat ongeveer 136 patiënten waren overleden. Voor deze interim-analyse werd een significantieniveau van 0,019 gebruikt volgens de O’Brien-Fleming-methode voor verdeling van de alfa bij 155 overleden patiënten. Futiliteit zou worden aangetoond bij een HR groter dan 1,0. De secundaire eindpunten werden hiërarchisch getest. Na de interim-analyse werd de studie op advies van de onafhankelijke centrale beoordelaars gestopt en werd crossover van chemotherapie naar erdafitinib toegestaan.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
8733 patiënten werden gescreend voor deelname aan de studie (zowel cohort 1 als 2). Bij 7293 patiënten was het tumormateriaal van voldoende kwaliteit voor FGFR-alteratie analyse. Bij 1212 patiënten (16,6 procent) was een FGFR-verandering aanwezig. Tussen augustus 2018 en januari 2023 werden 266 patiënten geïncludeerd in cohort 1: 136 patiënten in de erdafitinibgroep en 130 patiënten in de controlegroep. In de controlegroep kreeg 62 procent van de patiënten docetaxel en 38 procent vinflunine. Ten tijde van de data-cutoff bedroeg de mediane followup 15,9 maanden. De uitgangskarakteristieken in de beide behandelgroepen waren in grote lijnen vergelijkbaar. Wel leek in de controlegroep een iets groter percentage 65 jaar of ouder te zijn (65,4 versus 56,6 procent), minder fit te zijn (60,8 procent versus 53,7 procent ECOG-performancestatus > 0) en meer tumoren van de hogere urinewegen te hebben (36,9 versus 30,1 procent). 25 patiënten (18,4 procent) in de erdafitinibgroep hadden een FGFR-fusie en 108 patiënten (79,4 procent) hadden een FGFR-mutatie. Er waren geen patiënten met een FGFR2-verandering. In totaal hadden 157 van de 175 patiënten (89,7 procent) van wie de PD-L1-status bekend was, een CPS < 10. In beide groepen had iets meer dan de helft de checkpointremmer als monotherapie gehad in de tweede lijn. In de erdafitinibgroep hadden 45 patiënten (33,1 procent) maximaal 1 lijn systemische therapie gehad, in de controlegroep waren dit 33 patiënten (25,4 procent). Het merendeel van de patiënten (90 procent in de erdafitinibgroep en 85 procent in de controlegroep) had ten minste 1 lijn chemotherapie gehad (cisplatine in 50,8 procent en carboplatine in 29,3 procent).
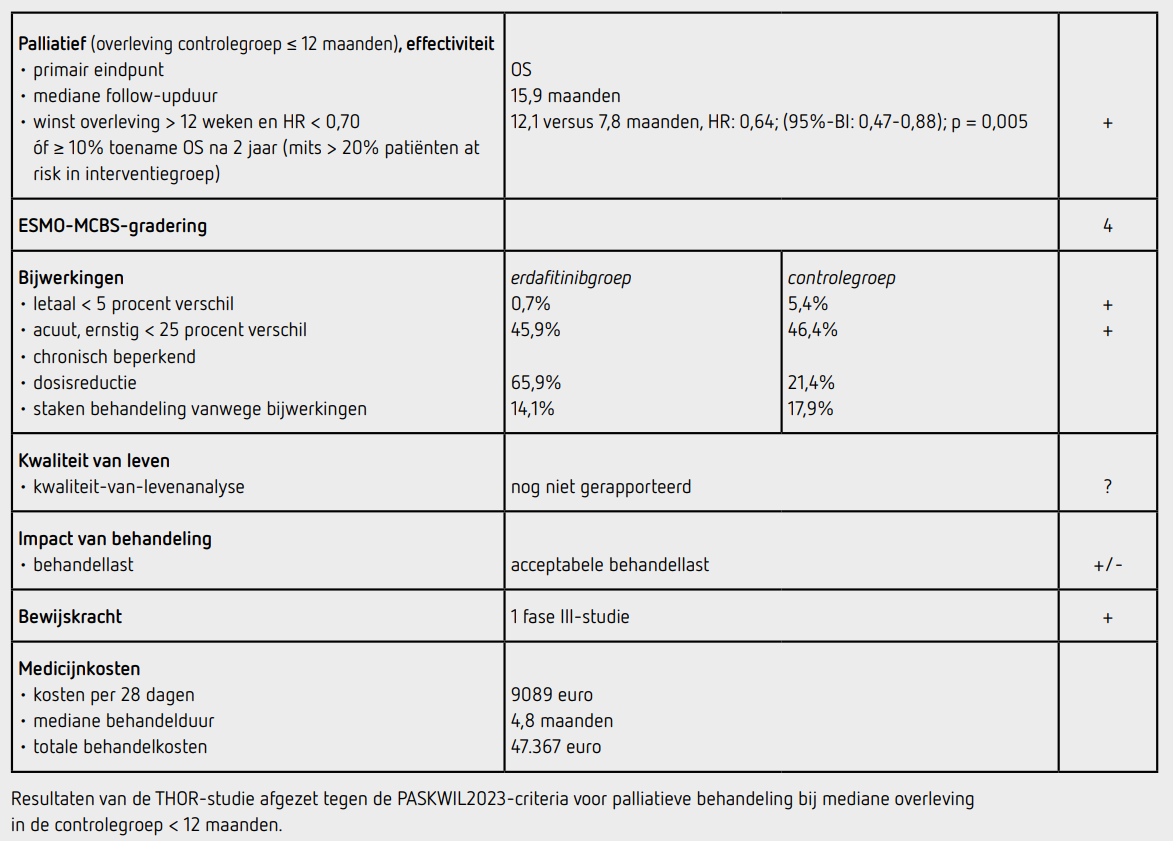
Er waren op het moment van deze interim-analyse 155 patiënten overleden, 77 in de erdafitinibgroep en 78 in de controlegroep. Het primaire eindpunt OS was statistisch significant beter in de erdafitinibgroep dan in de controlegroep (HR: 0,64; [95%-BI: 0,47-0,88]; p = 0,005). De mediane OS bedroeg 12,1 maanden (95%-BI: 10,3-16,4) in de erdafitinibgroep en 7,8 maanden (95%-BI: 6,5-11,1) in de controlegroep. De geschatte 1-jaarsoverleving was 51 procent (95%-BI: 41-60) in de erdafitinibgroep en 38 procent (95%-BI: 28-47) in de controlegroep. Het voordeel van erdafitinib met betrekking tot OS lijkt te gelden voor de verschillende subgroepen, behalve voor de groep patiënten met PD-L1 ≥ 10 (dit is echter een zeer kleine groep) en lijkt onafhankelijk van bijvoorbeeld het aantal eerdere lijnen systemische therapie, eerdere platinumbevattende chemotherapie en type FGFR-verandering.
De PFS was in de erdafitinibgroep ook statistisch significant beter dan in de controlegroep (HR: 0,58 [95%-BI: 0,44-0,78]; p < 0,001). De mediane PFS was 5,6 maanden (95%-BI: 4,4-5,7) in de erdafitinibgroep en 2,7 maanden (95%-BI: 1,8-3,7) in de controlegroep. In de erdafitinibgroep hadden meer patiënten een complete of partiële respons dan in de controlegroep (45,6 procent versus 11,5 procent).
Van de 136 patiënten in de erdafitinibgroep kregen 135 patiënten (99 procent) ten minste 1 gift erdafitinib, 112 van de 130 patiënten (86 procent) in de controlegroep kregen ten minste 1 gift: er waren 12 patiënten die na randomisatie chemotherapie weigerden. De mediane behandelduur was 4,8 maanden in de erdafitinibgroep en 1,4 maanden in de chemotherapiegroep. In de erdafitinibgroep kregen 104 patiënten (77 procent) een dosisverhoging van 8 naar 9 mg.
Behandelingsgerelateerde bijwerkingen die resulteerden in dosisverlaging in de erdafitinibgroep en controlegroep kwamen voor in respectievelijk 65,9 procent en 21,4 procent van de patiënten; onderbreking van de behandeling als gevolg van bijwerkingen kwam voor in respectievelijk 65,9 procent en 19,6 procent. In de erdafitinibgroep werd de behandeling vanwege bijwerkingen gestaakt bij 19 patiënten (14,1 procent) en in de controlegroep bij 20 patiënten (17,9 procent), waarvan respectievelijk 8,1 procent en 13,4 procent werd beschouwd als gerelateerd aan de behandeling. Graad 3 of hoger behandelingsgerelateerde bijwerkingen kwamen bij 62 patiënten (45,9 procent) in de erdafitinibgroep voor en bij 52 patiënten (46,4 procent) in de controlegroep. De meest voorkomende bijwerking van graad 3 of hoger was in de erdafitinibgroep handvoetsyndroom bij 13 patiënten (9,6 procent) en in de controlegroep neutropenie bij 15 patiënten (13,4 procent). Oogaandoeningen exclusief retinopathie kwamen voor bij 57 patiënten (42,2 procent) en retinopathie kwam voor bij 23 patiënten (17,0 procent) in de erdafitinibgroep, beide waren bij 3 patiënten (2,2 procent) van graad 3 of hoger.
Behandelingsgerelateerde bijwerkingen die leidden tot overlijden kwamen voor bij 1 patiënt (0,7 procent) in de erdafitinibgroep (sudden death) en bij 6 patiënten (5,4 procent) in de controlegroep (2 patiënten met febriele beenmergaplasie, 2 patiënten met septische shock, 1 patiënt met atypische pneumonie en 1 patiënt met febriele neutropenie). Er is kwaliteit van leven gemeten, maar de uitkomsten hiervan zijn nog niet gerapporteerd.
In de erdafitinibgroep kregen 44 patiënten (32,4 procent) een volgende lijn systemische behandeling, in de controlegroep waren dit 48 patiënten (36,9 procent). Enfortumab vedotin werd gegeven aan 19 patiënten (14 procent) in de erdafitinibgroep en aan 13 patiënten (10 procent) in de controlegroep.
5. Discussie
In de THOR-studie wordt een statistisch significant voordeel aangetoond voor OS van palliatieve behandeling met erdafitinib ten opzichte van chemotherapie bij patiënten met een irresectabel of gemetastaseerd UCC met een pathogene verandering in FGFR3. Het verschil in mediane OS was 4,3 maanden (mediane OS 12,1 maanden [95%-BI: 10,3-16,4] in de erdafitinibgroep en 7,8 maanden [95%-BI: 6,5-11,1] in de controlegroep) met een HR: 0,64 (95%-BI: 0,47-0,88; p = 0,005).
De resultaten van dit eindpunt voldoen aan de PASKWIL2023 criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep korter dan 12 maanden is. De totale frequentie van graad 3 of hoger bijwerkingen was weliswaar vergelijkbaar in beide groepen, in de erdafitinibgroep werd een hoger percentage huid- en nageltoxiciteit waargenomen. Daarnaast dient er bij gebruik van erdafitinib ook aandacht te zijn voor oogaandoeningen. De toxiciteit van erdafitinib leidde vaker tot dosisreductie en dosisonderbrekingen dan bij chemotherapie. Kwaliteit-van-levendata zijn nog niet gerapporteerd.
Opgemerkt dient te worden dat in de huidige studie een ruime meerderheid behandeld is geweest met 2 eerdere lijnen systemische therapie en dat dit percentage hoger is in de controlegroep dan in de erdafitinibgroep. Ook zijn patiënten in de erdafitinibgroep vaker ouder dan 65 jaar, en hebben ze iets minder vaak platinumbevattende chemotherapie ontvangen (hetgeen opvallend genoeg geen vereiste voorbehandeling was). 14 procent van de patiënten in de controlegroep heeft na inclusie in de studie geen behandeling gekregen. De reden hiervan is onduidelijk. De gebruikte middelen vinflunine en docetaxel in de controlegroep worden in het huidige behandellandschap niet meer gebruikt. Vinflunine heeft in een gerandomiseerde tweedelijnsstudie een beperkte PFS-winst laten zien na een platinumbevattend schema. Deze resultaten hebben geleid tot een negatief cieBOM-advies.10 Voor taxanen als monotherapie zijn voor deze indicatie geen gerandomiseerde studies verricht. Voor het beschikbaar komen van enfortumab vedotin werden taxanen op basis van fase II-data wel ingezet bij deze groep patiënten. Paclitaxel wordt vergoed voor tweedelijnsbehandeling van gemetastaseerd urotheelcelcarcinoom. Verder is onduidelijk hoe de resultaten van deze studie zich verhouden tot die van de EV-301-studie waarin enfortumab vedotin bij patiënten met een gemetastaseerd UCC die eerder een checkpointremmer en platinumbevattende chemotherapie hebben gekregen, een OS-winst laat zien ten opzichte van chemotherapie. Erdafitinib laat na platinumbevattende chemotherapie geen overlevingswinst zien ten opzichte van pembrolizumab (cohort 2 van de THOR-studie). De plaats van erdafitinib in latere lijn in relatie tot het veranderende behandellandschap bij gemetastaseerd UCC bij het verschuiven van enfortumab vedotin naar de eerste lijn zal separaat geadresseerd worden.
6. Kosten
De behandeling met erdafitinib 8 mg of 9 mg kost 9089 euro per 28 dagen. Bij een mediane behandelduur van 4,8 maanden komen de totale kosten van de behandeling op 47.367 euro. (bron: medicijnkosten.nl d.d. februari 2025).
7. Conclusie
In de hier besproken THOR-studie wordt bij patiënten met een irresectabel of gemetastaseerd UCC met een pathogene verandering in FGFR3 die eerder progressief waren na 1 of 2 eerdere systemische behandelingen waaronder een checkpointremmer na een follow-up van mediaan 15,9 maanden een statistisch significant langere overleving gezien met een mediane toename van 4,3 maanden na palliatieve behandeling met erdafitinib vergeleken met docetaxel of vinflunine (HR: 0,64 [95%-BI: 0,47-0,88]; p = 0,005). Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep korter dan 12 maanden is.
Referenties
- Powels T, Valderrama B, Gupta S et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024(10);390:875-88.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab als tweedelijnsbehandeling bij het urotheelcelcarcinoom. Med Oncol 2017;20(8):43-6.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Avelumab als onderhoudsbehandeling bij het urotheelcelcarcinoom van de urinewegen. Med Oncol 2021;24(3):37-40.
- Enfortumab vedotin als derdelijnsbehandeling bij het lokaal gevorderd of gemetastaseerd urotheelcelcarcinoom. Med Oncol 2022;24(4): alleen online beschikbaar op nvmo.org.
- Di Martino E, Tomlinson DC, Williams, SV et al. A place for precision medicine in bladder cancer: targeting the FGFRs. Future Oncol 2016;12(19):2243-63.
- Necchi A, Lo Vullo S, Raggi D et al. Prognostic effect of FGFR mutations or gene fusions in patients with metastatic urothelial carcinoma receiving first-line platinumbased chemotherapy: results from a large, single-institution cohort. Eur Urol Focus 2019;5(5):853-6.
- Siefker-Radtke AO, Necchi A, Park SH et al. Efficacy and safety of erdafitinib in patients with locally advanced or metastatic urothelial carcinoma: long-term follow-up of a phase 2 study. Lancet Oncol 2022;23(2):248-58.
- Yohann LM, Nobuaki M, Se Hoon P et al. Erdafitinib or chemotherapy in advanced or metastatic urothelial carcinoma. N Engl J Med 2023;389(21):1961-71.
- Siefker-Radtke AO, Matsubara N, Park SH et al. Erdafitinib versus pembrolizumab in pretreated patients with advanced or metastatic urothelial cancer with select FGFR alterations: cohort 2 of the randomized phase III THOR trial. Ann Oncol 2024;35(1):107-17.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Vinflunine als tweedelijns chemotherapie bij blaascarcinoom. Med Oncol 2010;13(4):26-8.