
1. Inleiding
Elk jaar wordt in Nederland bij ongeveer 13.000 patiënten de diagnose colorectaal carcinoom (CRC) gesteld. Ongeveer 20 procent van de patiënten heeft stadium IV ziekte op het moment van diagnose en ongeveer 40 procent van alle patiënten overlijdt uiteindelijk aan de gevolgen van een CRC.1 In Nederland is fluoropyrimidinebevattende chemotherapie met oxaliplatine en bevacizumab de meest frequent gekozen eerstelijnsbehandeling van het microsatellietstabiel gemetastaseerd colorectaal carcinoom (mCRC), ongeacht lokalisatie van de primaire tumor of het moleculaire subtype.2 Toevoeging van irinotecan aan de eerste lijn (FOLFOXIRI-bevacizumab) is voor fitte patiënten ook een optie. In de daaropvolgende lijnen kan afhankelijk van het moleculaire subtype irinotecan, een EGFR-antilichaam (panitumumab of cetuximab) en een BRAF-remmer (encorafenib) met cetuximab worden toegepast.3,4 Trifluridine/ tipiracil, met of zonder bevacizumab, is een optie voor patiënten die eerder behandeld zijn met fluoropyrimidine, irinotecan, oxaliplatine, en bevacizumab of een EGFR-antilichaam (bij patiënten met een wildtype RAS-tumor).6,7 Voor het microsatellietinstabiel gemetastaseerd coloncarcinoom wordt in Nederland in het algemeen als eerstelijnsbehandeling pembrolizumab gegeven.
Fruquintinib is een orale tyrosinekinaseremmer van VEGFreceptoren 1, 2 en 3. De effectiviteit van orale VEGF-receptorremmers na eerdere progressie op intraveneuze VEGF-receptorremmers lijkt te berusten op het remmen van meerdere VEGF-receptoren of door off-target bredere remming van tyrosinekinases die een rol spelen bij tumorontwikkeling. Fruquintinib is een remmer van VEGF-receptoren 1, 2 en 3, terwijl bevacizumab bindt aan het VEGF-A ligand waardoor remming van signaaltransductie via VEGF-receptoren 1 en 2 optreedt.
EMA heeft fruquintinib goedgekeurd voor de behandeling van patiënten met gemetastaseerd colorectaal carcinoom die eerder behandeld zijn met de beschikbare standaardtherapie, waaronder fluoropyrimidine, oxaliplatine en irinotecan, anti-VEGF-therapie, en anti-EGFR-therapie, en die progressief zijn onder of intolerant zijn voor trifluridine/tipiracil of regorafenib.
2. Kankersoort en lijn van behandeling
Behandeling met fruquintinib werd onderzocht bij patiënten met een gemetastaseerd colorectaal carcinoom in derde of hogere lijnsbehandeling.8
3. Vergelijking met de referentiebehandeling in Nederland
In de FRESCO-2-studie wordt behandeling met fruquintinib vergeleken met placebo bij patiënten met een gemetastaseerd colorectaal carcinoom in derde of hogere lijnsbehandeling.8 In Nederland wordt na behandeling met fluoropyrimidine, oxaliplatine en irinotecan, anti-VEGF-therapie, en anti-EGFR-therapie (indien wildtype RAS en linkszijdige tumor), encorafenib (in het geval van BRAF-V600E-gemuteerd colorectaal carcinoom) en na progressie onder of intolerantie voor trifluridine/tipiracil, in het algemeen gekozen voor best supportive care. Daarmee is de placebogroep van de FRESCO-2-studie vergelijkbaar met de Nederlandse praktijk. De winst in overleving van regorafenib werd door commissie BOM als te gering beoordeeld voor een positief advies.9
4. Methode en kwaliteit van de studie
De FRESCO-2-studie is een gerandomiseerde, dubbelblind, placebogecontroleerde fase IIIstudie uitgevoerd in 124 centra in 14 landen in NoordAmerika, Europa, Azië en Australië. Deelnemers waren 18 jaar of ouder (≥ 20 jaar in Japan) met histologisch of cytologisch bewezen gemetastaseerd colorectaal adenocarcinoom. Patiënten moesten alle standaardbehandelingen hebben ontvangen, waaronder een fluoropyrimidine, oxaliplatine en irinotecan, anti-VEGF-therapie, en anti-EGFR-therapie (bij wildtype RAS). De ziekte moest progressief zijn onder of de patiënt moest intolerant zijn voor trifluridine/tipiracil en/of regorafenib. RAS, BRAF, en microsatellietinstabiliteit of MMRdeficiëntie (MSIH/dMMR) moesten worden gedocumenteerd. Patiënten met een MSIH/dMMR tumor moesten behandeld zijn met een immuuncheckpointremmer en patiënten met een BRAF-600E-gemuteerde tumor moesten behandeld zijn met een BRAF-remmer, mits beschikbaar. Andere criteria omvatten een ECOG-performancestatus van 0-1 en meetbare ziekte volgens RECIST 1.1.
Patiënten werden 2:1 gerandomiseerd, waarbij gestratificeerd werd voor eerdere therapie (trifluridine/tipiracil versus regorafenib versus beide), RAS-mutatiestatus (wildtype versus mutatie) en duur van gemetastaseerde ziekte (≤ 18 maanden versus > 18 maanden). De behandeling bestond uit fruquintinib (5 mg oraal eenmaal daags) of placebo, dag 1-21 elke 28 dagen. De behandeling ging door tot progressie, overlijden van patiënt of onaanvaardbare bijwerkingen. Cross-over tussen de groepen was niet toegestaan. Onderbrekingen tot 14 dagen en maximaal twee dosisverlagingen waren toegestaan in het geval van bijwerkingen. Maximaal 50 procent van de geïncludeerde patiënten mocht zijn voorbehandeld met regorafenib. Tumorrespons werd lokaal elke 8 weken middels CTscan (of MRI indien CT niet mogelijk was) vastgesteld totdat er sprake was van radiologische ziekteprogressie.
Het primaire eindpunt van de studies was OS. Progressievrije overleving (PFS) was een secundair eindpunt. Andere secundaire eindpunten waren de objectieve respons, de ziektecontrole, de duur van de respons, en veiligheid inclusief bijwerkingen. De analyses van de secundaire eindpunten kwaliteit van leven (gemeten met de vragenlijsten EORTC QLQ-C30 en EQ-5D-5L), gezondheidszorggebruik, en farmacokinetische en dynamische analyses zijn nog niet gerapporteerd.
In het ontwerp van de studie waren 687 patiënten en 480 events nodig om met 90 procent power en een eenzijdige alfa van 0,025 een hazard ratio (HR) van 0,73 voor overlijden vast te kunnen stellen. Dit komt overeen met een verlenging van de OS van 1,8 maanden in de fruquintinibgroep ten opzichte van de verwachte OS van 5 maanden in de placebogroep. Het oorspronkelijke statistisch plan ging uit van 522 patiënten om met 80 procent power en een eenzijdige alfa van 0,025 een HR van 0,73 voor overlijden vast te kunnen stellen, maar reeds in een vroege fase werd de studie geamendeerd naar een power van 90 procent. Op dat moment was nog geen inzicht in de eerste studieresultaten. Er was een interim-analyse voor OS gepland nadat ongeveer 160 patiënten overleden waren. De grens voor futiliteit bij deze analyse was een eenzijdige pwaarde van 0,772, corresponderend met een HR van 1,133.
5. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
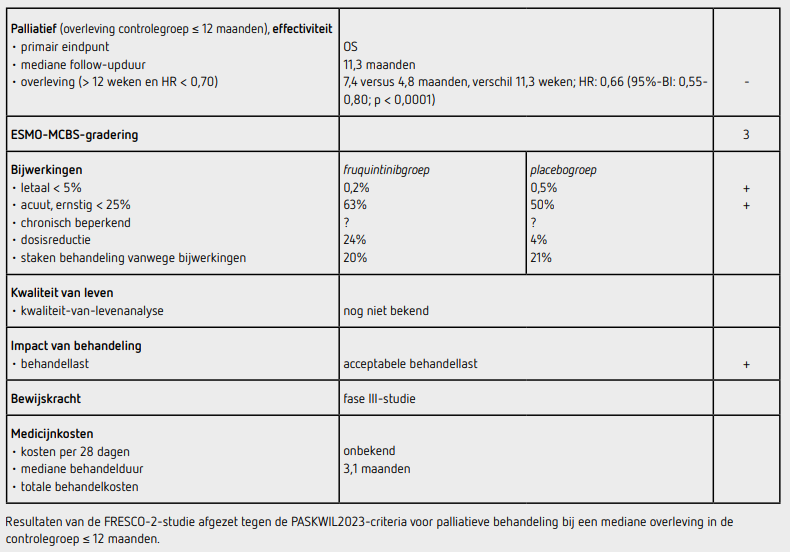
Tussen augustus 2020 en december 2021 werden 691 patiënten gerandomiseerd tussen fruquintinib (n = 461) en placebo (n = 230). De mediane leeftijd was 64 jaar. In de placebogroep lag het percentage mannen wat hoger dan in de fruquintinibgroep (61 versus 53 procent). Ongeveer 70 procent van de patiënten had levermetastasen, 63 procent had een RASmutatie, ongeveer 3 procent een BRAF-V600E-mutatie en ongeveer 1 procent had een MSI-H of dMMR-tumor. Ruim 70 procent had meer dan 3 eerdere behandellijnen gehad. Ten tijde van de analyse waren 490 patiënten overleden, 317 (69 procent) in de fruquintinibgroep en 173 (75 procent) in de placebogroep. Mediane follow-upduur was 11,3 maanden (IQR: 9-14,2) in de fruquintinibgroep en 11,2 maanden (IQR: 8,7-15,5) in de placebogroep. De mediane behandelduur was 3,1 maanden voor fruquintinib en 1,8 maanden voor placebo.
De mediane OS was 7,4 maanden (95%BI: 6,7-8,2) in de fruquintinibgroep versus 4,8 maanden (95%BI: 4,0-5,8) in de placebogroep (absoluut verschil 2,6 maanden; HR: 0,66 [95% BI: 0,55-0,80]; p < 0,0001). Dit verschil was consistent in de vooraf gespecificeerde subgroepen. De mediane PFS was 3,7 maanden (95%BI: 3,5-3,8) in de fruquintinibgroep versus 1,8 maanden (95%BI: 1,8-1,9) in de placebogroep (HR: 0,32 [95% BI: 0,27-0,39]; p < 0,0001).
Behandeling werd gestart bij 686 patiënten; 456 patiënten (98,9 procent) ontvingen fruquintinib en 230 patiënten (100 procent) ontvingen placebo. Bijwerkingen van graad 3 of hoger kwamen voor bij 286 patiënten (63 procent) in de fruquintinibgroep en 116 patiënten (50 procent) in de placebogroep. De meest voorkomende bijwerking van graad 3 of hoger in de fruquintinibgroep was hypertensie, hetgeen optrad bij 62 patiënten (14 procent). Er was 1 mogelijk behandelingsgerelateerd overlijden in elke groep (darmperforatie in de fruquintinibgroep en hartstilstand in de placebogroep). Dosisonderbrekingen als gevolg van mogelijk behandelinggerelateerde bijwerkingen kwamen voor bij 213 patiënten (47 procent) in de fruquintinibgroep en bij 61 patiënten (27 procent) in de placebogroep. Dosisverlagingen als gevolg van bijwerkingen kwamen voor bij 110 (24 procent) patiënten in de fruquintinibgroep en bij 9 (4 procent) patiënten in de placebogroep. In totaal staakten 93 patiënten (20 procent) in de fruquintinibgroep en 49 (21 procent) patiënten in de placebogroep de behandeling vanwege bijwerkingen.
6. Discussie
De FRESCO-2-studie toont een langere OS in de fruquintinibgroep in vergelijking met de placebogroep (HR: 0,66 [95%-BI: 0,55-0,80]; p < 0,0001) bij patiënten met een gemetastaseerd colorectaal carcinoom. De mediane overleving was 7,4 maanden (95%-BI: 6,7-8,2) in de fruquintinibgroep versus 4,8 maanden (95%-BI: 4,0-5,8) in de placebogroep (absoluut verschil 2,6 maanden; HR: 0,66, 95%-BI: 0,55-0,80; p < 0,0001). De resultaten van dit eindpunt voldoen niet aan de PASKWIL2023-criteria voor een positief advies voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep 12 maanden of korter is. De effecten van fruquintinib op de overleving werden waargenomen in bijna alle subgroepen, inclusief de groep patiënten met een RAS-mutatie. Opvallend was het hoge percentage patiënten (70 procent) dat meer dan 3 eerdere behandellijnen had gehad voor inclusie in deze studie. Fruquintinib werd relatief goed verdragen in deze zwaar voorbehandelde patiëntengroep. Hoewel bijwerkingen van graad 3 of hoger voorkwamen bij 63 procent van de patiënten in de fruquintinibgroep, waren de meeste bijwerkingen, zoals hypertensie, asthenie en hand-voetsyndroom, volgens de auteurs hanteerbaar met ondersteunende zorg en dosisaanpassingen.
7. Kosten
Er is in Nederland nog geen prijs vastgesteld voor fruquintinib waardoor de totale kosten van de behandeling niet kunnen worden berekend.
8. Conclusie
Bij patiënten met een gemetastaseerd colorectaal carcinoom leidt behandeling met fruquintinib na twee of meer eerdere lijnen systeemtherapie tot een statistisch significante verbetering van de mediane OS van 4,8 naar 7,4 maanden ten opzichte van placebo (absoluut verschil 2,6 maanden; HR: 0,66 [95%-BI: 0,55-0,80]; p < 0,0001). De resultaten van dit eindpunt voldoen niet aan de PASKWIL2023-criteria voor een positief advies voor palliatieve behandeling bij studies waar de mediane overleving in de controlegroep 12 maanden of korter is.
Referenties
- iknl.nl, NKR-cijfers
- Richtlijn Colorectaal carcinoom 2024
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Panitumumab en cetuximabmonotherapie in de derde lijn bij de behandeling van met chemotherapie refractair gemetastaseerd colorectaal carcinoom. Med Oncol 2008;11(6):52-5.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Cetuximab voor eerstelijns behandeling gemetastaseerd en/of irresectabel colorectaal carcinoom zonder KRASgenmutatie (KRASwt). Med Oncol 2011;14(5):29-35.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Panitumumab toegevoegd aan eerstelijns of tweedelijns combinatiechemotherapie bij gemetastaseerd colorectaal carcinoom. Med Oncol 2012;15(4):27-31.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). TAS-102 voor het gemetastaseerd colorectaal carcinoom. Med Oncol 2016;19(8):55-7.
- Prager GW, Taieb J, Fakih M, et al. Trifluridine/tipiracil and bevacizumab in refractory metastatic colorectal cancer. NEJM 2023;388:1657-67.
- Fruquintinib versus placebo in patients with refractory metastatic colorectal cancer (FRESCO-2): an international, multicenter, randomized, doubleblind, phase 3 study. Dasari A, Lonardi S, GarciaCarbonero R et al. Lancet 2023;402:41-53.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Regorafenib voor het gemetastaseerd colorectaal carcinoom. Med Oncol 2013;6:37-9.