
Inleiding
Ruim twee derde van de patiënten met gemetastaseerd mammacarcinoom heeft hormoonreceptorpositieve (HR-positieve), humaan epidermaal groeifactorreceptor 2-negatieve (HER2-negatieve) ziekte.1 Bij deze patiënten bestaat in Nederland de standaard eerstelijnstherapie uit een aromataseremmer, gevolgd door fulvestrant met een CDK4/6-remmer in de tweede lijn. Resistentie is echter een belangrijk probleem, waarbij mutaties in verschillende signaalroutes een rol kunnen spelen. Ongeveer 40% van de patiënten met een HR-positieve, HER2-negatieve tumor heeft een mutatie in fosfatidylinositol-4,5-bisfosfaat-3-kinase catalytic subunit alpha (PIK3CA), wat leidt tot hyperactivatie van de alfa-isoform (p110α) van fosfatidylinositol-3-kinase (PI3K), een enzym dat de celcyclus activeert.2 Behandeling met de PI3K-remmer alpelisib en de AKT-remmer capivasertib naast endocriene therapie is effectief gebleken bij gemetastaseerd mammacarcinoom.3,4 Preklinisch zijn er aanwijzingen dat het blokkeren van verschillende signaalroutes tegelijk een synergistisch effect heeft. Eerdere combinatie van fulvestrant met ribociclib en alpelisib of buparlisib, een andere PI3K-remmer, bleek echter te toxisch.5
Inavolisib is een selectieve PI3K-remmer die specifiek de afbraak van gemuteerd p110α bevordert. Verondersteld wordt dat door deze selectieve werking een combinatie met een CDK4/6-remmer beter te verdragen is.
In de hier te bespreken INAVO120-studie wordt behandeling met inavolisib met de CDK4/6-remmer palbociclib en fulvestrant vergeleken met placebo met palbociclib en fulvestrant bij patiënten met een PIK3CA-gemuteerd, HR-positief, HER2-negatief lokaal gevorderd of gemetastaseerd mammacarcinoom met progressie tijdens of binnen 12 maanden na afronden van adjuvante endocriene therapie.6,7 EMA heeft inavolisib in combinatie met palbociclib en fulvestrant geregistreerd voor behandeling van volwassenen met PIK3CA-gemuteerd, HR-positief, HER2-negatief lokaal gevorderd of gemetastaseerd mammacarcinoom met progressie tijdens of binnen 12 maanden na het afronden van adjuvante endocriene therapie.
Kankersoort en lijn van behandeling
Behandeling met inavolisib met palbociclib en fulvestrant werd onderzocht bij patiënten met een PIK3CA-gemuteerd, HR-positief, HER2-negatief gemetastaseerd of lokaal gevorderd mammacarcinoom met progressie tijdens of binnen 12 maanden na adjuvante endocriene therapie.
Vergelijking met de referentiebehandeling in Nederland
In Nederland worden patiënten met een HR-positief, HER2- negatief irresectabel recidief of gemetastaseerd mammacarcinoom tijdens of binnen 12 maanden na adjuvante endocriene therapie met een aromataseremmer meestal behandeld met fulvestrant en een CDK4/6-remmer. Bij ziekterecidief tijdens of kort na adjuvante behandeling met tamoxifen wordt een aromataseremmer voorgeschreven al dan niet in combinatie met een CDK4/6-remmer. De controlegroep in de studie is daarmee deels vergelijkbaar met de Nederlandse situatie.
Methoden van de studie
De INAVO120-studie is een dubbelblind placebogecontroleerde gerandomiseerde fase III-multicenterstudie voor patiënten met een HR-positief, HER2-negatief gemetastaseerd of lokaal gevorderd mammacarcinoom met een PIK3CA-mutatie met progressie tijdens of binnen 12 maanden na adjuvante endocriene therapie met een aromataseremmer of tamoxifen. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1, nuchter glucose < 7,0 mmol/L en HbA1c < 39 mmol/mol te hebben. Er moest sprake zijn van meetbare ziekte volgens RECIST 1.1. Patiënten met bekende diabetes mellitus en patiënten met primair gemetastaseerde ziekte of met alleen botmetastasen (ook als deze meetbaar waren) kwamen niet aanmerking voor de studie.
Diagnostiek naar een PIK3CA-mutatie mocht in een lokaal laboratorium worden verricht op tumorweefsel (bij voorkeur op biopt van metastase) of bloed (circulerend tumor-DNA [ctDNA]) met een door de sponsor goedgekeurde en gevalideerde PCR-test of next generation sequencing (NGS) of in een centraal laboratorium middels ctDNA met de FoundationOne Liquid Clinical Trial Assay (Foundation Medicine). Alleen de specifieke PIK3CA-mutaties die in het studieprotocol waren vastgelegd, waren toegestaan.
Patiënten werden 1:1 gerandomiseerd tussen behandeling met inavolisib eenmaal daags 9 mg of placebo oraal ingenomen, in combinatie met palbociclib eenmaal daags 125 mg oraal ingenomen op dag 1-21 in cycli van 28 dagen en fulvestrant 500 mg intramusculair elke 28 dagen met een extra oplaaddosis op dag 15 van de eerste cyclus. Pre- of perimenopauzale vrouwen en mannen kregen tevens een LHRH-agonist. De behandeling werd gestratificeerd naar de aanwezigheid van viscerale ziekte (ja versus nee), hormoonresistentie (primair versus secundair) en regio (Noord-Amerika en West-Europa versus Azië versus de rest van de wereld). Primaire hormoonresistentie was gedefinieerd als recidief mammacarcinoom tijdens de eerste 2 jaar van de adjuvante endocriene therapie, secundaire hormoonresistentie als recidief na ten minste 2 jaar adjuvante behandeling tot aan 1 jaar na beëindigen hiervan.
Dosisaanpassingen en behandelonderbrekingen van inavolisib en palbociclib waren toegestaan. Bij staken van een van deze middelen door toxiciteit mochten de andere middelen worden doorgezet. Het primaire eindpunt van de studie was progressievrije overleving (PFS) door de onderzoeker beoordeeld. Secundaire eindpunten waren onder andere overleving (OS), objectieve responskans, responsduur, kwaliteit van leven en veiligheid. Ter evaluatie van respons werd in de eerste 2 jaar elke 8 weken en daarna elke 12 weken een CT- of MRI-scan (afhankelijk van wat klinisch geïndiceerd was) verricht en beoordeeld volgens RECIST 1.1. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0. Data over vervolgbehandelingen zijn verzameld in deze studie.
Volgens het ontwerp van de studie waren er 320 patiënten en 194 PFS-events nodig om met 85% power en een tweezijdige alfa van 0,05 een hazard ratio (HR) van 0,65 vast te stellen. Dit komt overeen met een toename van de mediane PFS van 11 naar 16,9 maanden. Een interim-analyse voor futiliteit was gepland na 75 PFS-events. OS werd hiërarchisch getest als PFS significant was. In een interim-analyse voor OS werd voorzien op het moment van de finale PFS-analyse waarbij geschat werd dat op dat moment ongeveer 105 patiënten overleden waren. De grens voor significantie van deze interim-analyse was 0,0098. De finale OS-analyse was gepland nadat 153 patiënten overleden waren met een alfa van 0,0469.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen
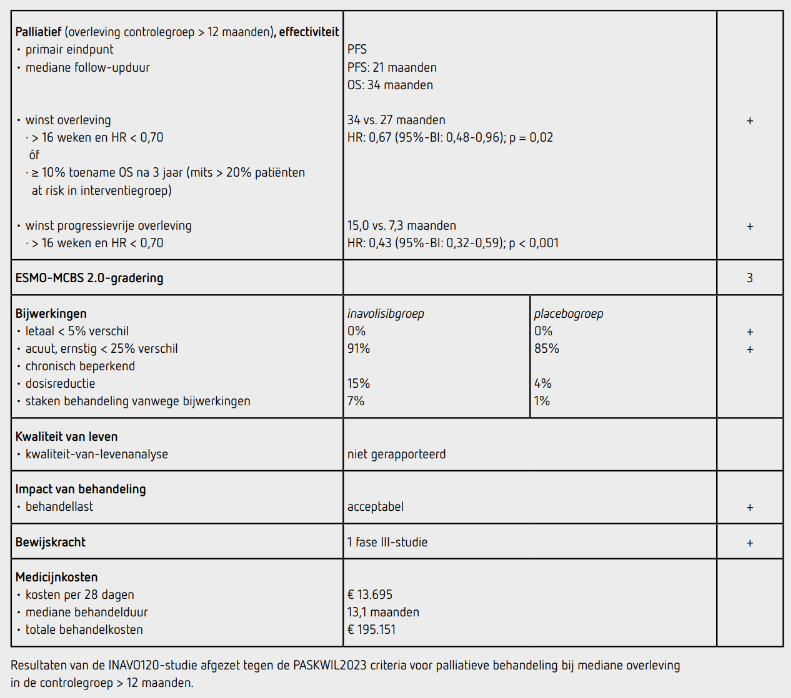
Tussen januari 2020 en september 2023 werden 325 patiënten geïncludeerd in 28 landen in Noord- en Zuid-Amerika, Europa, Azië en Australië: 161 patiënten in de inavolisibgroep en 164 patiënten in de placebogroep. De uitgangskarakteristieken in de beide groepen waren vergelijkbaar: de mediane leeftijd was 54 jaar, 63% had een ECOG-performancestatus 0, 2% was man, 80% had viscerale metastasen, 33% was primair hormoonresistent, 83% had (neo)adjuvante chemotherapie ontvangen en 48% had alleen tamoxifen als adjuvante endocriene therapie gehad. Ten tijde van data-cutoff (29 september 2023) was de mediane follow-upduur 21,3 maanden in de inavolisibgroep en 21,5 maanden in de placebogroep. Er waren 195 patiënten met progressie of overlijden. PFS was statistisch significant langer in de inavolisibgroep dan in de placebogroep (HR: 0,43 [95%-BI: 0,32-0,59], p < 0,001). De mediane PFS was 15,0 maanden (95%-BI: 11,3-20,5) in de inavolisibgroep en 7,3 maanden (95%-BI: 5,6-9,3) in de placebogroep. In de subgroepanalyse valt op dat patiënten ouder dan 65 jaar minder voordeel bij behandeling met inavolisib lijken te hebben. De aantallen zijn echter te klein om hier conclusies aan te verbinden.
Bij een update van de studie werden de resultaten van het secundaire eindpunt OS gepubliceerd bij een mediane follow-upduur van 34 maanden.7 In de inavolisibgroep waren 72 patiënten overleden en in de placebogroep waren 82 patiënten overleden. OS was statistisch significant langer in de inavolisibgroep dan in de placebogroep (HR: 0,67 [95%-BI: 0,48-0,94]; p = 0,02). De mediane OS was 34,0 maanden (95%-BI: 28,4-44,8) in de inavolisibgroep en 27,0 maanden (95%-BI: 22,8-38,7) in de placebogroep.
Na progressie kreeg in beide groepen circa 75% van de patiënten een vervolgbehandeling. De meeste patiënten werden na progressie behandeld met chemotherapie, namelijk 46 van de 83 patiënten (55%) in de inavolisibgroep en 79 van de 109 patiënten (72%) in de placebogroep. Weinig patiënten kregen tweedelijnsbehandeling met een PIK3CA-remmer, namelijk 5 patiënten (6%) in de inavolisibgroep en 11 patiënten (10%) in de placebogroep. Van de 161 patiënten (100%) in de inavolisibgroep die ten minste 1 gift behandeling kregen staakten 11 patiënten (7%) inavolisib vanwege bijwerkingen, 24 patiënten (15%) kregen een dosisreductie van inavolisib en 65 patiënten (40%) van palbociclib. In de placebogroep kregen 163 patiënten (99%) ten minste 1 gift placebo. Een patiënt (1%) staakte placebo vanwege bijwerkingen en een dosisreductie werd toegepast bij 6 patiënten (4%) met placebo en bij 56 patiënten (34%) met palbociclib. De mediane behandelduur was 13,1 maanden met inavolisib en 7,5 maanden met placebo.
In totaal hadden 146 patiënten (91%) in de inavolisibgroep ten minste 1 bijwerking van graad 3 of 4, waarvan neutropenie (83%) en trombocytopenie (14%) het meest frequent voorkwamen. Hyperglykemie kwam voor bij 102 patiënten (63%) en was meestal van graad 1 of 2. Diarree kwam voor bij 84 patiënten (52%), waarvan bij 29 patiënten (18%) van graad 2. In de placebogroep hadden 138 patiënten (85%) ten minste 1 bijwerking van graad 3 of 4, met name neutropenie (80%). In de inavolisibgroep overleden 6 patiënten (4%) tijdens de behandeling en in de placebogroep overleden 2 patiënten (1%) tijdens de behandeling. Geen van deze overlijdens werd gerelateerd aan de studiemedicatie. Er zijn geen data over kwaliteit van leven gerapporteerd.
Kwaliteit van de studie en interpretatie van de uitkomsten
Middels amendementen zijn een aantal belangrijke tussentijdse wijzigingen doorgevoerd: het aantal te includeren patiënten is verlaagd van 400 naar 320 met een benodigd aantal PFS-events dat is verlaagd van 227 naar 194 en een power die verlaagd werd van 90% naar 85%. Ook is de interim-analyse voor OS later toegevoegd. Doordat de studie placebogecontroleerd is, wordt de kans op terugtrekken wegens teleurstelling uit de controlegroep kleiner. Bij een potentieel toxische behandeling en eindpunt PFS is er wel risico op discrepante censoring in de interventiegroep, leidend tot overschatting van de PFS-winst. Data over censoring ontbreken, maar op basis van de Kaplan-Meier-curves lijkt er geen disbalans in censoring tussen de groepen. De winst in PFS gaat ten koste van meer toxiciteit, die met name van graad 1 of 2 is en zich niet lijkt te vertalen in een hoog percentage patiënten dat de behandeling staakt vanwege bijwerkingen. De uitkomsten van het kwaliteit-van-levenonderzoek zijn nog niet gerapporteerd. Deze zullen mogelijk meer inzicht geven in de tolerantie van deze behandeling. Hoewel de subgroepen klein zijn en er geen conclusies aan verbonden kunnen worden is het opvallend dat met name de patiënten ouder dan 65 jaar weinig voordeel van behandeling met inavolisib lijken te hebben. Aanvullende analyses in grotere groepen of real-world data zijn nodig om hier beter zicht op te krijgen.
De update met positieve OS-data ondersteunt het effect dat wordt waargenomen in de PFS. Opvallend is dat slechts 10% van de patiënten in de controlegroep in de volgende lijn is behandeld met een PI3K-remmer. De meeste patiënten kregen chemotherapie. Het is niet bekend of alpelisib (of een andere PI3K-remmer) overal beschikbaar was. De onderzoekers noemen dat het wellicht te maken heeft met de uitgebreidheid van ziekte in de studiepopulatie waarbij men niet meer durfde te wachten met chemotherapie. Doordat weinig patiënten in de controlegroep na progressie zijn behandeld met een PI3K-remmer is niet duidelijk hoe de effectiviteit van een PI3K-remmer gecombineerd met een CDK4/6-remmer zich verhoudt tot sequentiële behandeling.
Discussie
De INAVO120-studie toont in patiënten met PIK3CA-gemuteerd, HR-positief en HER2-negatief lokaal gevorderd of gemetastaseerd mammacarcinoom met progressie tijdens of minder dan een jaar na adjuvante endocriene therapie, die behandeld worden met inavolisib met palbociclib en fulvestrant een verlenging van de mediane PFS van 7,7 maanden (HR: 0,43 [95%-BI: 0,32-0,59], p < 0,001) ten opzichte van behandeling met placebo met palbociclib en fulvestrant. Deze resultaten voldoen aan de criteria voor een positief advies volgens PASKWIL2023-criteria voor palliatieve behandeling bij studies waarin de mediane overleving in de controlegroep langer dan 12 maanden is. Ook de OS is significant langer in de inavolisibgroep dan in de placebogroep. In de studie is duidelijk gekozen voor een studiepopulatie met een slechte prognose. De mediane PFS in de placebogroep is slechts 7 maanden, een groot deel van de patiënten is primair hormoonresistent en de meerderheid heeft reeds (neo)adjuvante chemotherapie gehad. Ook werden patiënten met alleen botmetastasen uitgesloten van deelname aan de studie.
In de Nederlandse praktijk zouden patiënten met progressie tijdens of kort na adjuvante behandeling met tamoxifen geen fulvestrant en CDK4/6-remmer krijgen, maar een aromataseremmer, al dan niet met CDK4/6-remmer. De combinatie aromataseremmer, CDK4/6-remmer en inavolisib is niet onderzocht. Ook een combinatie van inavolisib met andere CDK4/6- remmers is niet onderzocht. Hoe de behandeling met inavolisib, fulvestrant en palbociclib zich verhoudt tot behandeling met een aromataseremmer met of zonder CDK4/6-remmer bij patiënten met progressie tijdens of kort na tamoxifen blijft dus onduidelijk. De patiënten die geïncludeerd werden in de studie hadden geen CDK4/6-remmer gehad in adjuvante setting. Dit is in een aantal landen onderdeel van de standaardbehandeling bij patiënten met een hoogrisicotumor, maar in Nederland niet.
Een andere kanttekening is de behandeling na progressie. In Nederland is alpelisib met fulvestrant beschikbaar voor patiënten met een PIK3CA-gemuteerde tumor na progressie op endocriene therapie. Ook capivasertib in combinatie met fulvestrant resulteert in een toename in mediane PFS van 3,7 maanden.4 Dit betekent dat een PI3K-remmer inmiddels tot het arsenaal aan behandelingen bij patiënten met PIK3CA-gemuteerd, HR-positief en HER2-negatief gemetastaseerd mammacarcinoom behoort. De 10% van de patiënten die in de INAVO120-studie een vervolgbehandeling met een PI3K-remmer kregen is derhalve bijzonder laag. De vraag of combinatiebehandeling superieur is aan sequentiële behandeling van een PI3K-remmer en een CDK4/6-remmer blijft hiermee nog onbeantwoord. In 93% van de patiënten werd de PIK3CA-mutatie bepaald met behulp van ctDNA. Deze analyse is in Nederland geen standaardpraktijk. De analyse op tumorweefsel (primaire tumor of metastase) is wel beschikbaar. In de studie werd slechts bij 7% patiënten op deze manier de PIK3CA-mutatie vastgesteld. De kosten van deze behandeling zijn erg hoog.
Kosten
De behandeling met inavolisib kost 13.695 euro per 28 dagen (bron: medicijnkosten.nl d.d. oktober 2025). Bij een mediane behandelduur van 13,1 maanden bedragen de kosten van inavolisib 195.151 euro. Dit is exclusief de kosten van palbociclib en fulvestrant.
Conclusie
In de hier besproken INAVO120-studie wordt bij patiënten met een PIK3CA-gemuteerd, HR-positief, HER2-negatief gemetastaseerd of lokaal gevorderd mammacarcinoom met progressie tijdens of binnen een jaar na afronden van adjuvante endocriene therapie een toename in de mediane PFS van 7,7 maanden gezien met behandeling met inavolisib met palbociclib en fulvestrant ten opzichte van placebo met palbociclib en fulvestrant (HR: 0,43 [95%-BI: 0,32-0,59]; p < 0,001). Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL2023- criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep van meer dan 12 maanden. De kosten van deze behandeling zijn erg hoog.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Goncalves MD, Hopkins BD, Cantley LC et al. Phosphatidylinositol 3-kinase, growth disorders, and cancer. N Engl J Med 2018;379(21):2052-62.
- André F, Ciruelos E, Rubovszky G et al. Alpelisib for PIK3CA-mutated, hormone receptor-positive advanced breast cancer. N Engl J Med 2019;380(20):1929-40.
- Turner NC, Oliveira M, Howell SJ et al. CAPItello-291 Study Group. Capivasertib in hormone receptor-positive advanced breast cancer. N Engl J Med 2023;388(22):2058-70.
- Tolaney SM, Im YH, Calvo E et al. Phase Ib study of ribociclib plus fulvestrant and ribociclib plus fulvestrant plus PI3K inhibitor (alpelisib or buparlisib) for HR+ advanced breast cancer. Clin Cancer Res 2021; 27(2):418-28.
- Turner NC, Im SA, Saura C et al. Inavolisib-based therapy in PIK3CA-mutated advanced breast cancer. N Engl J Med 2024;391(17):1584-96.
- Jhaveri KL, Im SA, Saura C et al. Overall survival with inavolisib in PIK3CA-mutated advanced breast cancer. N Engl J Med 2025;393(2):151-61.