
Inleiding
Na jarenlange stilte is er met de komst van immuuntherapie in vroegstadium niet-kleincellig longcarcinoom (NSCLC) eindelijk belangrijke voortgang bereikt. De vele opties maken het echter moeilijk om tot rationele keuzes te komen. Er is reeds adjuvante en neoadjuvante (chemo-)immuuntherapie beschikbaar en met de positieve cieBOM-beoordeling van de perioperatieve behandeling met pembrolizumab en chemotherapie in ditzelfde tijdschrift is er nu ook voor de eerste gecombineerde neoadjuvante en adjuvante behandeling een positief advies. Helaas zijn er nog geen vergelijkende studies verricht; we zullen dus keuzes moeten maken wat nu voor de individuele patiënt het meest passend is. Met dit betoog willen we suggesties doen hoe we kunnen komen tot een passend geïndividualiseerd voorstel.
Vroegstadium ziekte en systeemtherapie
De behandeling van stadium I-III NSCLC heeft een curatieve intentie. Desondanks is er een gerede kans op recidief. Dit is afhankelijk van het stadium en resulteert in een vijfjaarsoverleving van ongeveer 80, 50 en 25 procent bij respectievelijk stadium I, II en III ziekte.1 Met de komst van neoadjuvante immuuntherapie is de algehele overleving verbeterd voor stadium II en III ziekte.
De voordelen van aanvullende immuuntherapie zijn waarschijnlijk afhankelijk van aanwezigheid van residuale ziekte na de resectie. Helaas hebben we in de huidige diagnostiek nog geen betrouwbare methodes om deze residuale ziekte vast te stellen. Met behulp van het stadiëringsonderzoek, bestaande uit beeldvormend en pathologisch onderzoek, krijgen we een redelijk idee over de prognose. Uiteindelijk zullen we bij iets minder dan de helft van de patiënten die een aanvullende behandeling krijgen boven op de resectie of de radiotherapie voor niets de aanvullende immuuntherapie na de operatie geven omdat ze reeds genezen waren. Het aantonen van minimaal (moleculair) residuale ziekte (MRD) met behulp van circulerend tumor-DNA (ctDNA) is veelbelovend. Het zal waarschijnlijk op de middellange termijn (binnen 5 jaar) behulpzaam zijn bij verdere personalisering van de behandeling en hierdoor de kans verkleinen op een zinloze adjuvante behandeling.2
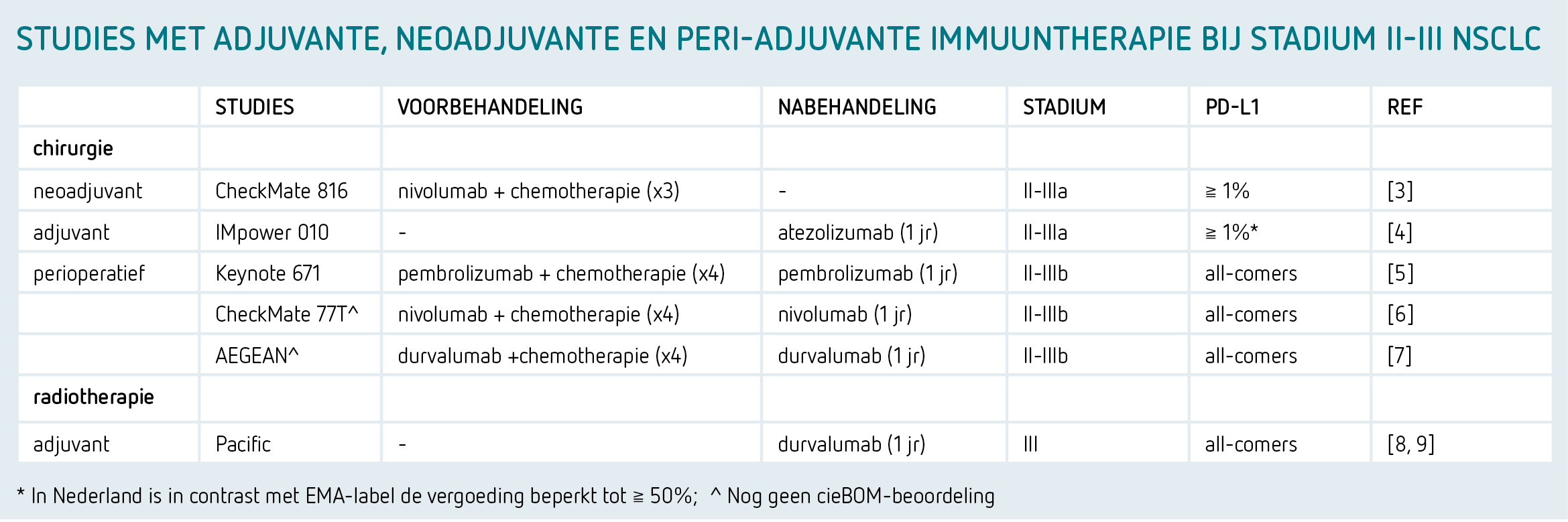
De huidige indicaties voor neoadjuvante immuuntherapie bij NSCLC is beperkt tot stadium II en III. Daarnaast speelt de expressie van het eiwit programmed death (PD) ligand-(L)1 op de tumorcellen en de aanwezigheid van drivermutaties zoals EGFR, ALK, ROS, RET (geen indicatie immuuntherapie) een rol bij de patiëntenselectie. Preoperatief dient dus het moleculair profiel te worden vastgesteld conform de recent gepubliceerde lijst klinisch noodzakelijke targets (KNT) NSCLC.
Personaliseren van de chemo-immuuntherapie
Er zal de komende jaren veel bekend worden over de factoren die bepalend zijn voor de indicatie van de chemo-immuuntherapie bij vroegstadium NSCLC. De vraag doet zich voor of ook nu al een gewogen beslissing genomen kan worden. In het onderstaande proberen we hier een aanzet voor te geven. Ten eerste is het duidelijk geworden dat na inductie/neoadjuvante behandeling de pathologische respons sterk prognostisch is. Er is door pathologisch onderzoek van het resectiepreparaat een inschatting te maken over het percentage vitaal resttumor.
Bij patiënten met een complete pathologische respons (cPR) is de prognose zeer gunstig (2-jaar ziektevrije overleving is +/ -95 procent) in vergelijking met tumoren waarbij de respons minder duidelijk is (2-jaar ziektevrije overleving is ± 50 procent)3 en is er geen overtuigend bewijs voor een meerwaarde van aanvullende adjuvante immuuntherapie. Ook bij de major (m)PR is er een duidelijk voordeel in de overleving ten opzichte van behandeling met chemotherapie alleen.3 Het is bij deze groep onduidelijk wat de rol van aanvullende adjuvante behandeling is zoals toegediend in de KEYNOTE-671-studie.
Ten tweede hebben patiënten met een lager stadium ziekte (stadium II) een relatief beperkte meerwaarde omdat hun kans op genezing postoperatief sowieso al beter was. De number needed to treat is vanzelfsprekend duidelijk hoger. Oftewel: de kans dat immuuntherapie een voordeel biedt is kleiner, en dat is zeker iets om met de patiënt te bespreken.
Ten derde lijkt er een sterke relatie te zijn met de PD-L1-expressie en de kans op een voordeel van de immuuntherapie.3,5-7 Het merendeel van de studies laat zien dat het grootste effect zichtbaar is bij de patiënten met een hoge PD-L1-expressie (≧ 50 procent). Een recente meta-analyse toonde echter aan dat ook bij PD-L1-negatieve tumoren er een voordeel is van immuuntherapie (HR: 0,74; 95%-BI: 0,62-0,89).10 De verschillen in effectiviteit hebben eerder reeds geleid tot beperking van de vergoeding van neoadjuvante immunotherapie voor enkel PD-L1-expressie ≧ 1 procent. Voor de perioperatieve chemo-immuuntherapie is de vergoeding nog niet vastgesteld, maar zowel EMA als cieBOM zijn tot de conclusie gekomen dat deze behandeling effectief zijn voor all comers, dus onafhankelijk van de PD-L1-expressie.
Ten vierde lijkt de rookstatus en het moleculaire profilering relevant te zijn bij het voorspellen van de voordelen van immuuntherapie. Patiënten die gerookt hebben dan wel nog roken hebben een type longcarcinoom ontwikkeld dat gevoeliger is voor de immuuntherapie. Naast de teleurstellende resultaten van immuuntherapie bij patiënten met druggable aberraties zoals EGFR en ALK kunnen we op termijn ook de post-hoc-resultaten van biomarkers zoals STK11, KEAP1 en tumor mutational burden (TMB) bij vroegstadium ziekte verwachten. Op dit moment is er echter nog onvoldoende bewijs om de lessen geleerd bij gemetastaseerde ziekte nu al toe te passen voor vroegstadium ziekte.
Ten vijfde lijkt MRD relevant te gaan worden. Vele studies hebben aangetoond dat ctDNA-MRD sterk prognostisch is. Patiënten met postoperatief detecteerbaar ctDNA krijgen meestal een recidief.2,3 Omdat er nog steeds zeer grote verschillen zijn in de MRD-ctDNA-technologie, de sensitiviteit en de negatief voorspellende waarde nog beperkt is en er nog geen harmonisatie heeft plaatsgevonden blijft ctDNA-MRD tot nader order niet beschikbaar in de standaard zorg.
Als laatste kunnen er ook nog meer technisch en operatieve overwegingen meespelen in de keuze voor neoadjuvante óf adjuvante behandeling. Uit de studies met neoadjuvante behandeling blijkt de kans op een pneumonectomie lager. Ook kan door de respons op neoadjuvante therapie de operatie oncologisch zinvoller (minder R1- en R2-resecties) en met minder mogelijke complicaties plaatsvinden. Hierbij zijn aspecten relevant ten aanzien van de resectabiliteit zoals thoraxwand of grote vaatbetrokkenheid.

Voorstel personalisatie zorg
Totdat er goede vergelijkende studies zijn, kunnen we geen harde uitspraken doen over de superioriteit maar we kunnen wel de relatieve voordelen afwegen tegen de nadelen. Zo heeft een kortdurende behandeling een voordeel vanwege vermindering van het ongemak voor de patiënt, de bijwerkingen en de zorgconsumptie maar kan een te korte behandeling ook ten koste gaan van de effectiviteit. Op basis van de beschikbare data komen we tot de volgende overwegingen (zie figuur 1):
1. Voor patiënten die na neoadjuvante chemo-immuuntherapie een cPR hebben, lijkt adjuvante nabehandeling geen voordeel te bieden. Dit klopt in mindere mate ook voor patiënten met een major pathologische respons (mPR), ook al is er nog weinig data beschikbaar.
2. Patiënten met stadium III hebben meer voordeel van (chemo)immuuntherapie in de perioperatieve setting dan patiënten met stadium II. Er wordt dan ook geadviseerd in stadium III te starten met een neoadjuvant regime indien er sprake is van een potentieel resectabele tumor bij een patiënt die qua conditie en reserves eventueel een dergelijke operatie kan ondergaan. Ook bij patiënten met grote tumoren en bijvoorbeeld thoraxwand of grote vaatbetrokkenheid zou voorbehandeling te overwegen zijn.
3. Indien perioperatieve behandeling onafhankelijk van de PD-L1-status beschikbaar komt, zal er een restgroep overblijven waarvoor perioperatieve (chemo)immuuntherapie kan worden overwogen. Het te verwachten voordeel is geringer bij tumoren met een PD-L1 < 1 procent, maar de recente meta-analyse toont aan dat er wel een voordeel is.10
4. Patiënten die nooit gerookt hebben en/of de druggable mutaties EGFR en ALK hebben, dienen geen immuuntherapie te krijgen. Het ontbreekt vooralsnog aan bewijs voor meerwaarde. Voor andere druggable mutaties die geassocieerd zijn met beperkte werking van immuuntherapie (zie de geldende KNT-lijst NSCLC), is er heden nog geen data beschikbaar maar zouden we eveneens aarzelen om te starten met immuuntherapie, zeker indien patiënten nooit gerookt hebben.
5. Een flink percentage patiënten heeft preoperatief geen pathologische diagnose en heeft dan ook geen neoadjuvante behandeling ondergaan. Hiernaast is er een gerede kans op zogenaamde upstaging. Voor deze patiënten is adjuvante immuuntherapie beschikbaar afhankelijk van stadium, PD-L1-expressie en moleculaire profilering.
Referenties
- Goldstraw, P, et al. The IASLC Lung Cancer Staging Project: Proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer. J Thorac Oncol 2016;11(1):39-51.
- Gale, D., et al. Residual ctDNA after treatment predicts early relapse in patients with early-stage non-small cell lung cancer. Ann Oncol 2022;33(5):500-10.
- Forde, P.M., et al. Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med 2022;386(21):1973-85.
- Felip, E., et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 2021;398(10308):1344-57.
- Wakelee, H., et al. Perioperative pembrolizumab for early-stage non-small-cell lung cancer. N Engl J Med 2023;389(6):491-503.
- Cascone, T., et al. LBA1 CheckMate 77T: Phase III study comparing neoadjuvant nivolumab (NIVO) plus chemotherapy (chemo) vs neoadjuvant placebo plus chemo followed by surgery and adjuvant NIVO or placebo for previously untreated, resectable stage II–IIIb NSCLC. Ann Oncol 2023;34:s1295.
- Heymach, J.V., et al. Perioperative durvalumab for resectable non-small-cell lung cancer. N Engl J Med 2023;389(18):1672-84.
- Antonia, S.J., et al. Overall survival with durvalumab after chemoradiotherapy in stage iii NSCLC. N Engl J Med 2018;379(24):2342-50.
- Spigel, D.R., et al. Five-year survival outcomes from the PACIFIC trial: Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. J Clin Oncol 2022;40(12):1301 11.
- Sorin, M., et al. Neoadjuvant chemoimmunotherapy for NSCLC: A systematic review and meta-analysis. JAMA Oncol 2024 Mar 21:e240057. doi: 10.1001/jamaoncol.2024.0057. Epub ahead of print. PMID: 38512301; PMCID: PMC10958389.