Inleiding
De diagnose niet-kleincellig longcarcinoom (NSCLC) wordt in Nederland jaarlijks bij bijna 10.000 mensen gesteld. Bij diagnose komt meer dan 40 procent van de patiënten niet meer in aanmerking voor een curatieve behandeling. Daarnaast krijgt 40 tot 50 procent van de patiënten die eerder in opzet curatief zijn behandeld in de loop van de tijd afstandsmetastasen (Dutch Lung Cancer Audit 2019). Ongeveer 4 procent van de NSCLC-patiënten heeft bij diagnose een herschikking in het anaplastisch lymfoomkinase-gen (ALK-gen). Deze vorm van longcarcinoom is in het algemeen erg gevoelig voor een behandeling met een ALK-tyrosinekinaseremmer (ALK-TKI).
Crizotinib, een ALK-TKI van de eerste generatie, gaf een overlevingsvoordeel in de eerste lijn ten opzichte van de standaardchemotherapie1 en werd dan ook de eerste behandeloptie (advies commissie BOM in maart 2016). Ceritinib, een ALK-TKI van de tweede generatie, gaf ook voordeel in de eerste lijn ten opzichte van chemotherapie2 (advies commissie BOM in oktober 2018). Nadien bleken ALK-TKI’s van de tweede generatie, zoals alectinib3 en brigatinib4, superieur ten opzichte van crizotinib en werden deze middelen de eerste behandeloptie (adviezen commissie BOM in respectievelijk september 2018 en augustus 2020). De 5-jaarsoverleving van patiënten met een lokaal gevorderd of gemetastaseerd ALK-positief NSCLC is inmiddels hoger dan 60 procent (Awad, Proc ASCO 2021). Ondanks de betere effectiviteit van deze middelen blijft de kans op progressie, zeker ook in het centraal zenuwstelsel (CZS), onverminderd aanwezig.
Lorlatinib, een ALK-TKI van de derde generatie, toonde een goede effectiviteit in fase I- en II-studies na falen van een ALK-TKI van de eerste en tweede generatie, met name ook in het CZS. Lorlatinib werd in eerste instantie dan ook geregistreerd als tweedelijnsbehandeling na falen van een ALK-TKI van de eerste of tweede generatie. In de hier te bespreken CROWN-studie, een gerandomiseerde fase III-studie (open label), wordt behandeling met lorlatinib vergeleken met crizotinib als eerstelijnsbehandeling voor lokaal gevorderd of gemetastaseerd NSCLC met een ALK-herschikking.5 De EMA heeft lorlatinib recentelijk geautoriseerd als eerstelijnsbehandeling voor patiënten met lokaal gevorderd of gemetastaseerd NSCLC met een ALK-herschikking.
1. Kankersoort en lijn van behandeling
Eerstelijnsbehandeling met lorlatinib werd vergeleken met crizotinib bij patiënten met een lokaal gevorderd of gemetastaseerd ALK-positief NSCLC.
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland was ten tijde van de start van de CROWN-studie crizotinib de standaardbehandeling. De referentiebehandeling is dan ook vergelijkbaar met de Nederlandse situatie. Inmiddels zijn alectinib en brigatinib, TKI’s van de tweede generatie, de standaard eerstelijnsbehandeling geworden.
3. Methode en kwaliteit van de studie
CROWN is een internationale gerandomiseerde fase III-studie (open label) voor patiënten met een lokaal gevorderd of gemetastaseerd NSCLC met een ALK-herschikking. Er kon sprake zijn van een primaire diagnose of een gemetastaseerd recidief na eerdere lokale behandeling. De ALK-positiviteit moest worden vastgesteld met de VENTANA ALK (D5F3) CDx Assay. Eerdere behandeling voor gemetastaseerde ziekte was niet toegestaan. Patiënten met asymptomatische metastasering in het CZS (wel of niet behandeld) konden deelnemen aan de studie. Overige inclusiecriteria waren een leeftijd boven de 18 of 20 jaar (afhankelijk van lokale wetgeving), ECOG-performancestatus tussen 0 en 2 en meetbare extracraniële ziekte volgens RECIST 1.1.
Patiënten werden 1:1 gerandomiseerd tussen lorlatinib (1 d.d. 100 mg per os) en crizotinib (2 d.d. 250 mg per os). Er werd gestratificeerd op de aanwezigheid van hersenmetastasering (ja versus nee) en etnische afkomst (Aziatisch versus niet-Aziatisch). Een cyclus bestond uit 28 dagen.
Dosisreducties waren toegestaan voor beide behandelingen. De behandeling werd voortgezet tot aan progressie of onacceptabele bijwerkingen. Per protocol was cross-over niet toegestaan.
Voor randomisatie werd een CT-scan of MRI-scan van thorax, abdomen en bekken gemaakt, en een MRI-scan van het cerebrum. De respons (inclusief MRI-scan van het cerebrum) werd elke 8 weken bepaald volgens RECIST 1.1 en beoordeeld door een onafhankelijke onderzoeker. Daarnaast werd er ook regelmatig een ECG en echocardiografie verricht. Patiëntgerapporteerde uitkomsten werden vastgelegd op baseline en alle follow-upmomenten. Bijwerkingen werden geclassificeerd volgens de CTCAE 4.03.
Het primaire eindpunt van de studie was progressievrije overleving (PFS), die werd bepaald door onafhankelijke geblindeerde beoordelaars. Secundaire eindpunten waren PFS bepaald door de onderzoeker zelf, totale overleving (OS), responskans, intracraniële respons en veiligheid. Om een verbetering van PFS van 11 maanden met crizotinib naar 18 maanden met lorlatinib vast te kunnen stellen, waren er 280 patiënten nodig om met 90 procent power en een eenzijdige alfa van 0,025 een hazard ratio (HR) van 0,611 te verkrijgen. Hierbij was er een groep-sequentieel design met Lan-DeMets-alfaverdeelsleutel en O’Brien- Fleming-grenzen om het betrouwbaarheidsinterval te berekenen. Een interim-analyse was gepland na 75 procent van de 177 verwachte events (progressie of overlijden), met een berekende alfa van 0,0081. OS werd hiërarchisch getest indien het primaire eindpunt PFS statistisch significant was. Effectiviteit werd berekend op basis van het intention to treat-principe voor alle gerandomiseerde patiënten.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen mei 2017 en februari 2019 werden 296 patiënten gerandomiseerd in 104 centra in 23 landen. Hiervan werden 149 patiënten gerandomiseerd voor behandeling met lorlatinib; zij werden allemaal behandeld. Van de 147 patiënten toegewezen aan crizotinib startten 142 patiënten. De overige 5 patiënten werden niet behandeld om niet genoemde redenen. De uitgangskarakteristieken in beide groepen waren vergelijkbaar, de gemiddelde leeftijd was ongeveer 57 jaar, ongeveer 60 procent was vrouw, ongeveer 60 procent had nooit gerookt, 40 procent had een ECOG-performancestatus van 0 en 55 procent van 1, ongeveer 95 procent had stadium IV-ziekte en 44 procent was van Aziatische afkomst. Bij baseline hadden 38 patiënten (26 procent) in de lorlatinib-groep hersenmetastasen en 40 patiënten (27 procent) in de crizotinib-groep. Respectievelijk 6 en 7 procent van de patiënten was eerder bestraald voor hersenmetastasen.
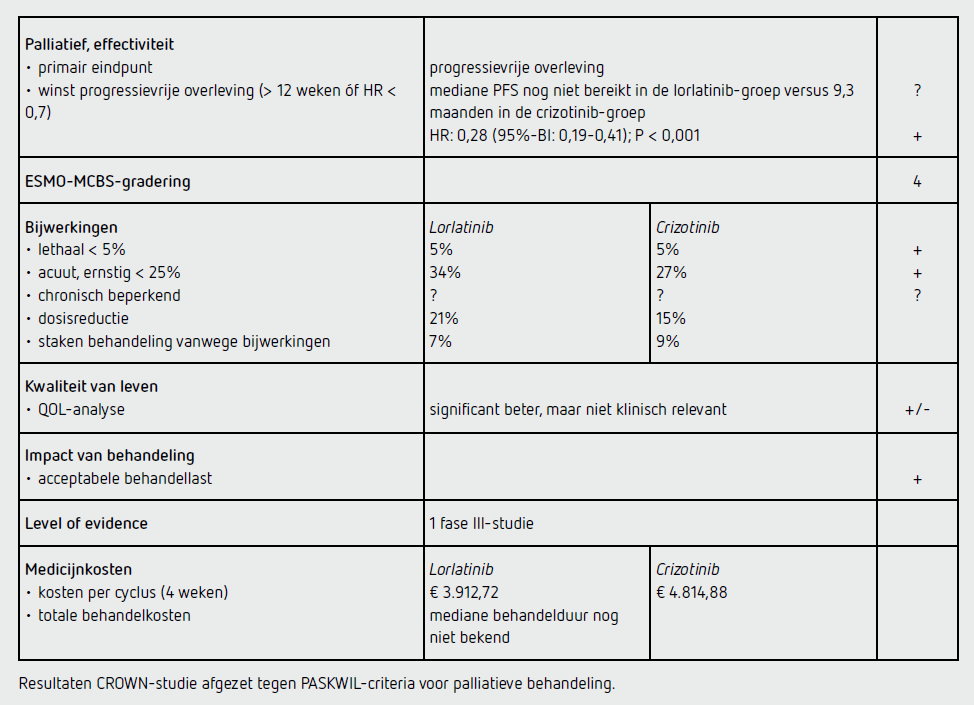
Bij de vooraf vastgestelde interim-analyse waren 127 patiënten overleden of hadden ziekteprogressie: 41 van de 149 patiënten in de lorlatinib-groep (28 procent) en 86 van de 147 in de crizotinib-groep (59 procent). De mediane duur van de follow-up voor PFS was 18,3 maanden in de lorlatinib-groep en 14,8 maanden in de crizotinib-groep. Het percentage patiënten dat na 12 maanden nog niet overleden was en geen ziekteprogressie had, was 78 procent (95%-BI: 70-84) in de lorlatinib-groep versus 39 procent (95%-BI: 30-48) in de crizotinib-groep. De mediane PFS was nog niet bereikt in de lorlatinib-groep en 9,3 maanden (95%-BI: 7,6-11,1) in de crizotinib-groep (HR: 0,28 [95%-BI: 0,19-0,41]; P< 0,001). Dit verschil in PFS werd teruggevonden in alle subgroepen, zoals geslacht, ECOG-performancestatus, leeftijd en rookstatus.
Het percentage patiënten met een bevestigde objectieve respons was hoger in de lorlatinib-groep dan in de crizotinib-groep, 76 versus 58 procent, waarbij 4 patiënten in de lorlatinib-groep een complete respons hadden. Bij de 78 patiënten met bij baseline hersenmetastasen was de responskans in de lorlatinib-groep hoger dan in de crizotinib-groep: 66 procent (95%-BI: 49-80) versus 20 procent (95%-BI: 9-36). Een respons op lorlatinib in het CZS was langduriger dan op crizotinib: respectievelijk 72 versus 0 procent na 12 maanden.
Ook de kans op CZS-progressie was lager in de lorlatinib-groep dan in de crizotinib-groep. In de lorlatinib-groep waren na 12 maanden nog 96 procent van de patiënten zonder CZS-progressie (95%-BI: 91-98) versus 60 procent (95%-BI: 49-69) in de crizotinib-groep. Na 12 maanden was de kans op CZS als eerste locatie van progressie 3 procent in de lorlatinib-groep en 33 procent in de crizotinib-groep (HR: 0,06 [95%-BI: 0,02-0,18]). Ten tijde van de interim-analyse waren de OS-data nog niet matuur (respectievelijk 23 en 28 patiënten overleden in de lorlatinib- en crizotinib-groep).
Ten tijde van de interim-analyse werden nog 69 procent van de patiënten met lorlatinib behandeld en 22 procent van de patiënten met crizotinib. De mediane behandelduur werd niet vermeld. Opvallende bijwerkingen van graad 1-2 in de lorlatinib-groep waren, naast hypertriglyceridemie (44 procent) en hypercholesterolemie (54 procent), veranderingen in cognitie (19 procent) en stemming (14 procent); deze zijn ook bekend uit de eerdere studies met lorlatinib. Deze laaggradige toxiciteit was vrijwel altijd reversibel bij dosisreductie.
Bijwerkingen van graad 3-4 traden op bij 72 procent van de patiënten in de lorlatinib-groep versus 55 procent in de crizotinib-groep. In de lorlatinib-groep waren de meest voorkomende bijwerkingen van graad 3 en hoger hypertriglyceridemie (20 versus 2 procent), gewichtstoename (17 versus 2 procent), hypercholesterolemie (16 versus 0 procent) en hypertensie (10 versus 0 procent). In de crizotinib-groep waren de meest voorkomende bijwerkingen van graad 3 en hoger laboratoriumafwijkingen, zoals een verhoogd ALAT en lipase (beide 4 procent), en neutropenie (8 procent). Ernstige bijwerkingen kwamen voor bij 34 procent van de patiënten met lorlatinib versus 27 procent in de crizotinib. Fatale bijwerkingen traden in beide groepen even vaak op: 7 patiënten (5 procent). Dosisonderbreking of dosisreductie kwam voor bij respectievelijk 49 en 21 procent van de patiënten in de lorlatinib-groep en bij respectievelijk 47 en 15 procent van de patiënten in crizotinib-groep. De behandeling werd vanwege bijwerkingen gestaakt bij 7 procent van de patiënten behandeld met lorlatinib en bij 9 procent van de patiënten behandeld met crizotinib. Patiënten in de lorlatinib-groep hadden een significant hogere verbetering in de algehele kwaliteit van leven gedurende de hele studieperiode (4,65 punten op schaal van 0-100) dan patiënten in de crizotinib-groep. Dit verschil was echter te klein voor klinische relevantie.
Discussie
In de CROWN-studie werd een significant betere PFS gezien van lorlatinib ten opzichte van crizotinib als eerstelijnsbehandeling van gevorderd en gemetastaseerd ALK-positief NSCLC. De OS-data, een secundair eindpunt, zijn nog niet matuur. Gegevens over de vervolgtherapie in beide groepen ontbreken.
Het bijwerkingenprofiel van lorlatinib is duidelijk anders dan van de andere TKI’s. Cognitieve- en stemmingsstoornissen treden vaak op in lage gradering, vaak in het begin van de behandeling. Deze bijwerkingen reageren goed op dosisonderbreking of dosisverlaging. Bijwerkingen van graad 3 of 4 kwamen meer voor bij lorlatinib dan bij crizotinib. Dit betrof in meer dan 50 procent verhogingen van triglyceride en cholesterol, die met statines goed te behandelen zijn. Ten tijde van de start van de CROWN-studie was crizotinib de standaard eerstelijnstherapie bij NSCLC met ALK-herschikking, met een PFS van 10,9 maanden1. Inmiddels zijn TKI’s van de tweede generatie de standaard. Ceritinib liet een PFS zien van 16,6 maanden ten opzichte van 8,1 maanden met chemotherapie2. Alectinib liet een PFS van 25,7 maanden zien ten opzichte van 10,4 maanden met crizotinib in de ALEX-studie3. Brigatinib liet in de ALTA-1L-studie een PFS zien van 24 maanden4 en ensartinib in de eXalt3-studie een PFS van 25,8 maanden6. In de CROWN-studie is de mediane PFS van behandeling met lorlatinib nog niet bekend. De optimale plaatsbepaling van lorlatinib ten opzichte van TKI’s van de tweede generatie is pas vast te stellen op basis van gerandomiseerde studies. Deze ontbreken nog. Ook de optimale sequentie van TKI’s is nog niet bepaald.
5. Kosten
De behandeling met lorlatinib kost per 4 weken toediening 3.912,72 euro en de behandeling met crizotinib per 4 weken 4.814,88 euro (bron: medicijnkosten.nl d.d. 16 februari 2022). De mediane behandelduur wordt niet genoemd in de publicatie, mede omdat de mediane PFS voor de lorlatinibgroep nog niet is bereikt.
Conclusie
In de hier besproken CROWN-studie wordt bij patiënten met een lokaal gevorderd of gemetastaseerd ALK-positief NSCLC een statisch significant langere PFS gezien voor lorlatinib ten opzichte van crizotinib (HR: 0,28 [95%-BI: 0,19-0,41]; P < 0,001). De mediane PFS was nog niet bereikt in de lorlatinib-groep en was 9,3 maanden (95%-BI: 7,6-11,1) in de crizotinib-groep. Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL-criteria voor palliatieve behandeling.
Referenties
- Solomon BJ, Mok T, Kim DW, et al; PROFILE 1014 Investigators. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014;371(23):216777.
- Soria J-C, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet 2017;389(10072):91729.
- Peters S, Camidge DR, Shaw AT, et al; ALEX Trial Investigators. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med 2017;377(9):82938.
- Camidge DR, Ryun KH, Ahn MJ, et al. Brigatinib versus crizotinib in ALK-positive non-small-cell lung cancer. N Engl J Med 2018;379(21):202739.
- Shaw AT, Bauer TM, de Marinis F, et al; CROWN Trial Investigators. First-line lorlatinib or crizotinib in advanced ALK-positive lung cancer. N Engl J Med 2020;383(21):201829.
- Horn L, Wang Z, Wu G, et al. Ensartinib vs crizotinib for patients with anaplastic lymphoma kinase-positive non-small cell lung cancer: a randomized clinical trial.
JAMA Oncol 2021;7(11):161725.