
1. Samenvatting eerder advies
In oktober 2023 paste cieBOM bij herbeoordeling het eerder afgegeven voorlopig positieve advies aan voor onderhoudsbehandeling met niraparib bij patiënten met een gevorderd hooggradig, hoogstadium (FIGO-stadium III en IV) ovariumcarcinoom, tubacarcinoom of peritoneaalcelcarcinoom, die een respons hebben na eerstelijnsbehandeling met platinumbevattende chemotherapie, van de totale populatie naar de populatie met een tumor-BRCA-mutatie of een tumor met homologe-recombinatiedeficiëntie (HRD).1
In de PRIMA/ENGOT-OV26/GOG-3012-studie werd 3 jaar adjuvante behandeling met niraparib vergeleken met placebo bij patiënten met een stadium III-ziekte met zichtbare residuale ziekte of inoperabel stadium III-ziekte, of stadium IV-ziekte. Patiënten moesten in ieder geval 4 cycli platinumbevattende chemotherapie gehad hebben, waarna er een complete of partiële remissie was ontstaan zonder meetbare tumorresten groter dan 2 cm. Het CA 125-gehalte moest genormaliseerd zijn of 90 procent of meer zijn gereduceerd tijdens de primaire behandeling en ten minste 7 dagen stabiel zijn. Er werd een centrale test verricht op HRD, gedefinieerd als de aanwezigheid van een in de tumor vastgestelde BRCA-mutatie of een HRD-score van 42 of hoger (op een schaal van 0-100) of een combinatie van beide. Na een amendement (december 2016) mochten alle patiënten worden geïncludeerd en werd HRD een stratificatiefactor.
Het primaire eindpunt was onafhankelijk beoordeelde progressievrije overleving (PFS) in de groep patiënten met een HRD-tumor en in de gehele populatie; dit werd hiërarchisch getest. Secundaire eindpunten waren overleving, tijd tot volgende behandeling, effectiviteit van de volgende behandeling, PFS2 en tijd tot CA 125-stijging.
Tussen juli 2016 en juni 2018 werden 733 patiënten door 181 centra in 20 landen gerandomiseerd: 487 patiënten in de niraparibgroep en 246 patiënten in de placebogroep. Van de 733 patiënten hadden 373 patiënten (50,9 procent) een HRD-tumor, waarvan bij 223 patiënten een BRCA-mutatie vastgesteld werd en bij 150 patiënten geen BRCA-mutatie aanwezig was. Ten tijde van de primaire analyse (cieBOM-advies van februari 2021) was de mediane follow-up 13,8 maanden.2 Het primaire eindpunt PFS in de HRD-populatie was statistisch significant langer in de niraparibgroep dan in de placebogroep (HR: 0,43 [95%-BI: 0,31-0,59]; p < 0,001). De mediane PFS in de HRD-populatie bedroeg 21,9 maanden in de niraparibgroep en 10,4 maanden in de placebogroep. In de totale populatie bedroeg de mediane PFS 13,8 maanden in de niraparibgroep en 8,2 maanden in de placebogroep (HR: 0,62 [95%-BI: 0,50-0,76]; p < 0,001). Deze resultaten voldeden aan de destijds geldende PASKWIL-criteria voor adjuvante behandeling voor een voorlopig positief advies.
In augustus 2023 werden de resultaten gepubliceerd van een ad-hoc-analyse van de PFS en veiligheid op lange termijn.1 Ten tijde van de data-cutoff op 17 november 2021 was er een mediane follow-up van 3,5 jaar. Overeenkomstig de primaire analyse was de PFS in de HRD-populatie statistisch significant langer in de niraparibgroep dan in de placebogroep (HR: 0,52 [95%-BI: 0,40-0,68]; p < 0,001). De mediane PFS in de HRD-populatie bedroeg 24,5 maanden in de niraparibgroep en 11,2 maanden in de placebogroep. In de totale populatie was de PFS ook langer in de niraparibgroep dan in de placebogroep. De mediane PFS in de totale populatie bedroeg 13,8 maanden in de niraparibgroep en 8,2 maanden in de placebogroep (HR: 0,66 [95%-BI: 0,56-0,79]; p < 0,001). Deze resultaten voldeden aan de PASKWIL2023-criteria voor adjuvante behandeling voor een voorlopig positief advies voor patiënten met een gevorderd hooggradig, hoogstadium (FIGO-stadium III en IV) ovariumcarcinoom, tubacarcinoom of peritoneaalcelcarcinoom met een HRD-tumor of een tumor-BRCA-mutatie, die een (complete of partiële) respons hadden na eerstelijnsbehandeling met platinumbevattende chemotherapie. Hiermee kwam het voorlopig positieve advies voor de totale populatie te vervallen.
2. Update van de resultaten
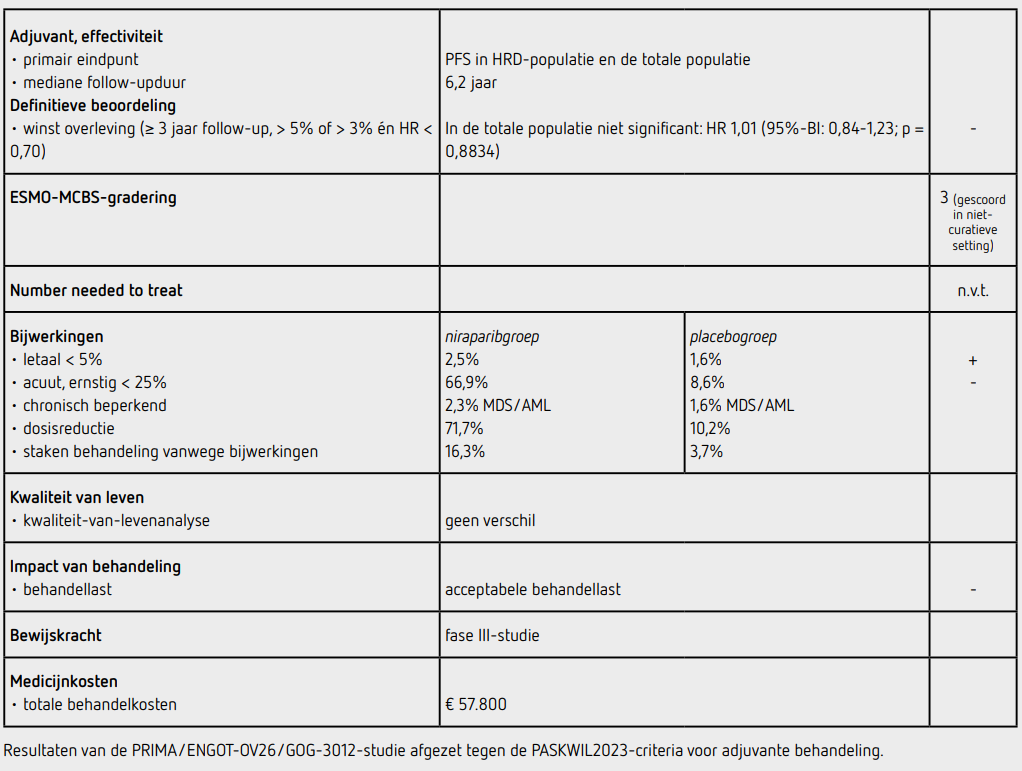
Recent zijn de finale OS-data gepubliceerd.3 OS was een secundair eindpunt van de studie, dat getest zou worden bij ongeveer 440 overlijdens om een HR ≤ 0,75 vast te stellen met een power van 80 procent en een tweezijdige alfa van 0,05. Ten tijde van deze analyse (data-cutoff 8 april 2024) was de mediane follow-up 6,2 jaar (niraparibgroep 73,9 maanden en placebogroep 73,8 maanden). Op dat moment waren 458 patiënten overleden (62,5 procent) en werden nog 27 patiënten behandeld met niraparib en 11 met placebo. Vervolgbehandelingen bij recidiefziekte zijn gestart bij 325 patiënten (66,7 procent) in de niraparibgroep en 180 patiënten (73,2 procent) in de placebogroep. Bij ongeveer 60 procent van de patiënten betrof het platinumbevattende chemotherapie en bij een derde een taxaan. Behandeling met een PARP-remmer werd bij 11,7 procent van de patiënten in de niraparibgroep gestart en bij 37,8 procent van de patiënten in de placebogroep.
In de HRD-populatie was dit percentage respectievelijk 15,8 en 48,4 procent waarbij de meeste patiënten behandeld werden met olaparib. In de totale populatie was er geen OS-verschil tussen de niraparibgroep en de placebogroep met een HR 1,01 (95%-BI: 0,84-1,23; p = 0,8834) en een mediane OS van 46,6 maanden in de niraparibgroep en van 48,8 maanden in de placebogroep.
Omdat er geen OS-verschil in de totale populatie was, werd OS in de HRD-populatie niet formeel getest, maar ook in de HRD-populatie leek de kans op overlijden niet verschillend tussen de niraparibgroep en de placebogroep met een HR van 0,95 (95%-BI: 0,70-1,29). De mediane behandelduur was 11,3 (range 0-80) maanden in de niraparibgroep en 8,3 (range 0-77) maanden in de placebogroep.
Tijdens deze langere follow-up werden geen onverwachte bijwerkingen waargenomen, waarbij 66,9 procent van de patiënten in de niraparibgroep en 8,6 procent van de patiënten in de placebogroep een behandelingsgerelateerde bijwerking van graad 3 of hoger had. Er stopten meer patiënten met niraparib (16,3 procent) dan met placebo (3,7 procent) vanwege bijwerkingen. Dosisonderbrekingen en -reducties kwamen voor bij respectievelijk 80,8 procent en 71,7 procent van de patiënten die met niraparib behandeld werden. 11 patiënten in de niraparibgroep (2,3 procent) en 4 patiënten in de placebogroep (1,6 procent) ontwikkelden MDS of AML. Deze 4 patiënten in de placebogroep waren bij progressie allemaal behandeld met een PARP-remmer. De kwaliteit van leven, gemeten met de EORTC QLQ-C30 subschaal overall QoL, leek gedurende 24 cycli niet verschillend te zijn tussen de beide groepen.
3. Bespreking
In de hier gepresenteerde finale OS-analyse van de PRIMA/ ENGOT-OV26/GOG-3012-studie bleek na een mediane followup van 6,2 jaar de OS in de totale populatie niet te verschillen tussen patiënten behandeld met niraparib of placebo. OS werd volgens protocol niet formeel getest in de HRDpopulatie, maar leek ook in deze populatie niet verschillend te zijn. Op basis van de PASKWIL2023-criteria voor adjuvante studies voldoet dit resultaat niet aan de criteria voor een positief advies. De bijwerkingen van niraparib zijn aanzienlijk. Sinds de startdosis op het gewicht is gebaseerd zijn de bijwerkingen van graad 3 en hoger wel afgenomen (van 79 naar 64 procent). Na een mediane follow-up van 6,2 jaar hebben 15 patiënten (2 procent) MDS of AML ontwikkeld.
Opmerkelijk aan deze studie is de geïncludeerde populatie. Het betrof patiënten met stadium III-ziekte met zichtbare residuale ziekte of inoperabel stadium III-ziekte, of stadium IV-ziekte, aan wie behandeling met in ieder geval 4 cycli platinumbevattende chemotherapie gegeven moest zijn, waarna er een complete of partiële remissie was ontstaan zonder meetbare tumorresten groter dan 2 cm, en het CA 125-gehalte moest genormaliseerd zijn of 90 procent of meer zijn gereduceerd tijdens de primaire behandeling. De mediane OS van 48,8 maanden in de placebogroep is daarbij opmerkelijk lang. Ook in de HRD-populatie lijkt een OS-verschil niet aanwezig te zijn. Mogelijk maakt het niet uit in welke lijn patiënten behandeld worden met een PARP-remmer, aangezien bijna de helft van de HRD-populatie bij recidiefziekte alsnog behandeling met een PARP-remmer is gestart.
4. Kosten
De behandeling met niraprib kost bij een dosering van eenmaal daags 200 mg 4.708 euro per behandelcyclus van 28 dagen (bron: medicijnkosten.nl d.d. december 2024). De totale medicatiekosten bij een mediane behandelduur van 11,3 maanden zijn daarmee 57.800 euro.
5. Conclusie
Niraparib als onderhoudsbehandeling bij patiënten met een hooggradig, hoogstadium (FIGO III of IV) ovarium, tuba- of peritoneaalcelcarcinoom met een complete of partiële respons na eerstelijns platinumbevattende chemotherapie, voldoet niet aan de PASKWIL2023-criteria voor adjuvante studies voor een positief advies op basis van de OS-data in de totale populatie. De mediane OS is 46,6 maanden in de niraparibgroep en 48,8 maanden in de placebogroep (HR: 1,01 [95%-BI: 0,84-1,23; p = 0,8834]).
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Niraparib als onderhoudsbehandeling na primaire behandeling van het gevorderd epitheliaal ovariumcarcinoom. Med Oncol 2023;26(8):30-2.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Niraparib als onderhoudsbehandeling na primaire behandeling van het gevorderd epitheliaal ovariumcarcinoom. Med Oncol 2021;24(1):35-8.
- Monk BJ, Barretina-Ginesta MP, Pothuri B, et al. Niraparib first-line maintenance therapy in patients with newly diagnosed advanced ovarian cancer: final overall survival results from the PRIMA/ENGOT-OV26/GOG-3012 trial. Ann Oncol 2024;35(11):981-92.