Inleiding
De incidentie van het oesofaguscarcinoom is in Nederland de laatste jaren fors toegenomen: van 683 diagnoses in 1989 naar ongeveer 2.600 diagnoses in 2021. Deze stijging betreft vooral het adenocarcinoom, vaak distaal gelegen in de oesofagus of op de gastro-oesofageale overgang. De incidentie van het maagcarcinoom vertoont een geringe daling, met ongeveer 1.600 diagnoses in 2021; het betreft vrijwel altijd een adenocarcinoom. De overleving van patiënten met een gemetastaseerd oesofagus- of maagcarcinoom is beperkt. In de Nederlandse praktijk is de overleving van patiënten die eerstelijns palliatieve behandeling ondergaan ongeveer 7,5 maanden.1 Vaak wordt in Nederland chemotherapie in een doublet- of tripletregime gegeven. Bij HER2-overexpressie wordt trastuzumab aan de chemotherapie toegevoegd. Vaak betreft de chemotherapie een platinumderivaat (oxaliplatine of cisplatine) in combinatie met 5FU (FOLFOX of cisplatine-5-FU) of capecitabine (CAPOX), al dan niet gecombineerd met epirubicine (EOX/ECC/ECF).
In de hier te bespreken CheckMate 649-studie2, uitgevoerd in Azië, Australië, Europa, NoordAmerika en Zuid-Amerika, wordt behandeling met chemotherapie (CAPOX of FOLFOX) vergeleken met chemotherapie met nivolumab, bij patiënten met een adenocarcinoom van de maag, gastro-oesofageale overgang of oesofagus.
1. Kankersoort en lijn van behandeling
De EMA heeft nivolumab in combinatie met fluoropyrimidineen platinumbevattende chemotherapie geregistreerd voor de eerstelijnsbehandeling van volwassen patiënten met een gevorderd of gemetastaseerd HER2-negatief adenocarcinoom van de maag, gastro-oesofageale overgang of oesofagus bij wie de tumor PD-L1-expressie vertoont met een combined positive score (CPS) van 5 of hoger.
2. Vergelijking met de referentiebehandeling in Nederland
In de CheckMate 649-studie wordt palliatieve behandeling met CAPOX of FOLFOX vergeleken met CAPOX of FOLFOX met nivolumab. In Nederland wordt aan patiënten met een gemetastaseerd HER2-negatief adenocarcinoom van de maag, gastro-oesofageale overgang of oesofagus een systemische behandeling gegeven met chemotherapie in een doublet- of triplet-regime, vaak bestaande uit een combinatie van een 5-FU-derivaat en een platinumderivaat (oxaliplatine of cisplatine), soms gecombineerd met epirubicine. Hiermee voldoet de controlegroep van deze studie aan de Nederlandse praktijk.
3. Methode en kwaliteit van de studie
De CheckMate 649-studie is een gerandomiseerde fase III-multicenterstudie (open label) voor patiënten met een HER2-negatief adenocarcinoom van de maag, gastro-oesofageale overgang of oesofagus. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1 te hebben. Er moest sprake zijn van volgens RECIST 1.1 meetbare ziekte of evalueerbare ziekte en er diende tumormateriaal beschikbaar te zijn om de PD-L1-expressie te bepalen. Er mocht geen voorgaande behandeling voor gemetastaseerde ziekte gegeven zijn. Adjuvante of neoadjuvante behandeling met chemotherapie, radiotherapie of chemoradiatie diende meer dan 6 maanden tevoren te zijn afgerond. Patiënten met onbehandelde hersenmetastasen, bekende autoimmuunziekten, hepatitis B of C of hiv/aids werden geëxcludeerd. Tijdens de inclusie werd de primaire studiepopulatie aangepast naar patiënten met een PD-L1-expressie met een CPS van 5 of hoger, mede op basis van de CheckMate 032-studie3-5. Patiënten konden ongeacht hun CPS geïncludeerd blijven worden in de studie, maar patiënten met een CPS lager dan 5 werden niet meegenomen in de primaire uitkomstmaat voor effectiviteit.
Patiënten werden 1:1:1 gerandomiseerd tussen behandeling met CAPOX (capecitabine oraal 1.000 mg/m2 2 d.d. gedurende 14 dagen en oxaliplatine i.v. 130 mg/m2 op dag 1 iedere 3 weken) of FOLFOX (oxaliplatine i.v. 85 mg/m2, leucovorine i.v. 400 mg/m2 en 5-FU i.v. 400 mg/m2 op dag 1 en 5-FU i.v. 1.200 mg/m2 op dag 1 en 2, iedere 2 weken) versus CAPOX of FOLFOX met nivolumab i.v. 360 mg iedere 3 weken of 240 mg iedere 2 weken versus nivolumab 1 mg/ kg plus ipilimumab 3 mg/kg iedere 3 weken i.v. gedurende 4 giften gevolgd door nivolumab i.v. 240 mg iedere 2 weken.
In de oorspronkelijke opzet van de studie was er sprake van een 1:1 randomisatie tussen chemotherapie en nivolumab met ipilimumab, wat later aangepast werd naar een driearmige studie. De nivolumab-ipilimumab-groep wordt nog geblindeerd vervolgd en is geen onderdeel van dit rapport. Alleen de patiënten die gerandomiseerd zijn in de periode dat óók geïncludeerd kon worden in de nivolumab-groep, worden gerapporteerd in het huidige rapport.
De studiebehandeling werd gestratificeerd naar PD-L1-expressie (≥ 1 versus < 1 procent versus onbekend), regio (Azië versus Verenigde Staten/Canada versus overig), ECOG-performancestatus (0 versus 1) en type chemotherapie (CAPOX versus FOLFOX). Dosisaanpassing en behandelonderbreking van de chemotherapie waren toegestaan volgens lokale standaarden. Dosisreductie was voor nivolumab niet toegestaan. De behandeling werd gestaakt op verzoek van de patiënt, bij klinische verslechtering van de conditie van de patiënt, om veiligheidsredenen, bij radiologische progressie of aan het einde van de studie. Nivolumab werd bij afwezigheid van progressie gestaakt na maximaal 2 jaar behandeling. Het was toegestaan om na progressie op basis van RECIST-criteria door te gaan met chemotherapie en nivolumab, gebaseerd op het oordeel van de lokale onderzoeker/behandelaar.
Het duaal primaire eindpunt van de studie was overleving (OS; tijd van randomisatie tot overlijden) of progressievrije overleving (PFS; tijd van randomisatie tot eerst gedocumenteerde ziekteprogressie of overlijden, door middel van centrale geblindeerde onafhankelijke beoordeling) bij de patiënten met een CPS van 5 of hoger. Hiërarchisch geteste secundaire eindpunten waren OS bij patiënten met een CPS van 1 of hoger en OS in alle gerandomiseerde patiënten. Daarnaast werden additioneel ook PFS in alle CPS-subgroepen en objectieve responskans (ORR) getest, maar deze waren niet formeel onderdeel van het statistisch plan. Voor de evaluatie van veiligheid werden alle behandelde patiënten beoordeeld.
Een CT- of MRI-scan voor evaluatie werd gemaakt bij start, vervolgens iedere 6 weken gedurende 48 weken, en vervolgens iedere 12 weken. PD-L1-expressie van de tumor werd bepaald middels PD-L1 IHC 288 pharmDx (DAKO) in twee centrale laboratoria, waarna gestandaardiseerd de CPS kon worden berekend. Bij baseline en minimaal éénmaal gedurende de behandeling werd kwaliteit van leven gemeten met de vragenlijst Functional Assessment of Cancer Therapy-Gastric (FACT-Ga). Bijwerkingen van de behandeling werden geëvalueerd volgens de CTC-AE v4. Data over vervolgbehandelingen zijn verzameld in deze studie.
Voor het duale primaire eindpunt werd een tweezijdige alfa (type I-error) gealloceerd aan OS (0,03) en PFS (0,02). Bij het aantonen van superioriteit voor OS bij patiënten met een CPS van 5 of hoger werd OS hiërarchisch getest bij patiënten met een CPS van 1 of hoger (met alfatransmissie van 50 procent, dus alfa 0,015) en vervolgens bij alle gerandomiseerde patiënten (met alfatransmissie van 100 procent, dus alfa 0,015). De planning was om de primaire eindpunten te evalueren voor PFS, met een interim-analyse voor OS na minimaal 12 maanden follow-up, en voor de finale OS-analyse na een minimale follow-up van 24 maanden. Volgens het ontwerp van de studie waren 554 patiënten met een CPS van 5 of hoger en 446 events nodig om met 85 procent power en een tweezijdige alfa van 3 procent een gemiddelde hazard ratio (HR) van 0,74 vast te kunnen stellen. Voor PFS werd een gemiddelde HR van 0,56 verwacht, rekening houdend met een vertraagd effect na 3 of 6 maanden. Bij een vertraagd effect na 3 maanden wordt een power van 99 procent bereikt en bij een vertraagd effect na 6 maanden een power van 60 procent. Er wordt in het statistisch plan geen powerberekening voor de totale populatie genoemd. Na een minimale follow-up van 12,1 maanden werden onderstaande analyses verricht.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen maart 2017 en april 2019 werden 1.581 patiënten geïncludeerd door 175 centra in 29 landen: 789 patiënten in de nivolumab-groep en 792 patiënten in de controlegroep. De studiepopulatie voor analyse van de primaire eindpunten, patiënten met een CPS van 5 of hoger, bestond uit 473 patiënten in de nivolumab-groep en 482 patiënten in de controlegroep (ongeveer 60 procent van de totale studiepopulatie). De mediane follow-up bedroeg 13,1 maanden (IQR: 6,7-19,1) in de nivolumab-groep en 11,1 maanden (IQR: 5,8-16,1) in de controlegroep. Er waren ten tijde van de analyse 698 patiënten gestopt met de behandeling in de nivolumab-groep en 728 patiënten in de controlegroep. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 62 jaar, 70 procent was man, 40 procent had een ECOG-performance-status van 0, 76 procent was niet Aziatisch, en ongeveer 70 procent had een primaire tumor in de maag; bij 18 procent betrof het een tumor van de gastro-oesofageale overgang en bij 13 procent was sprake van een oesofaguscarcinoom. Bijna alle patiënten (96 procent) had gemetastaseerde ziekte en 60 procent had een CPS van 5 of hoger. Ongeveer een kwart van de patiënten met een CPS van 5 of hoger had een PD-L1-expressie van 1 of hoger. Dit was 16 procent in de totale studiepopulatie.
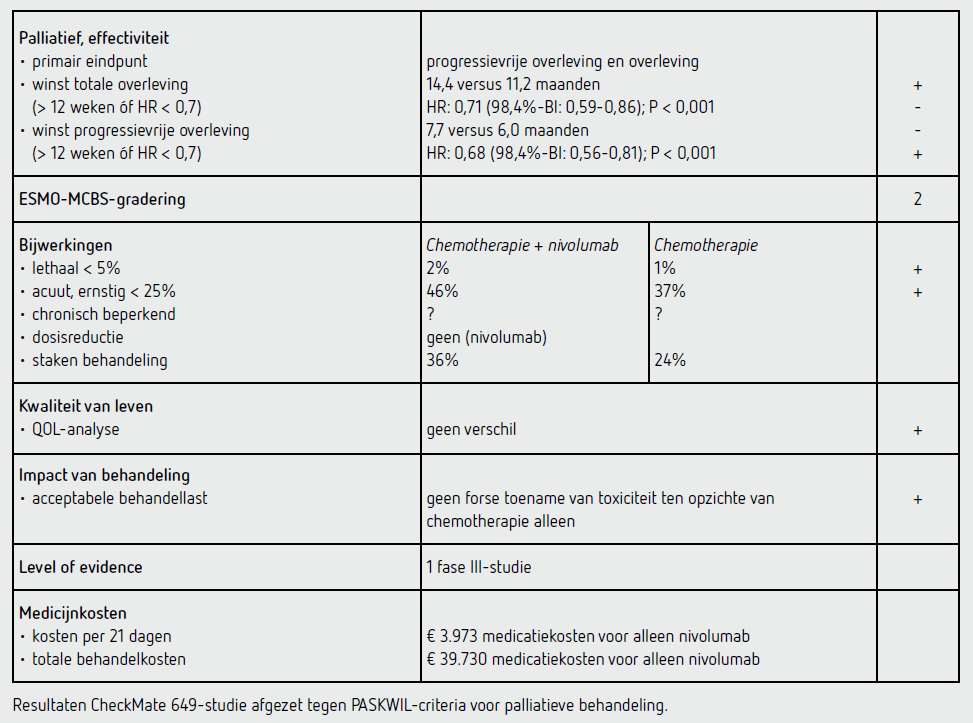
Het primaire eindpunt OS in de intention to treat-populatie met een CPS van 5 of hoger was statistisch significant beter in de nivolumab-groep dan in de controlegroep (HR: 0,71 [98,4%-BI: 0,59-0,86]; P < 0,0001). De mediane OS bedroeg 14,4 maanden (95%-BI: 13,1-16,2) in de nivolumab-groep en 11,1 maanden (95%-BI: 10,0-12,1) in de controlegroep. De 12-maanden-overleving was 57 procent (95%-BI: 53-62) in de nivolumab-groep en 46 procent (95%-BI: 42-51) in de controlegroep. Ook PFS in de intention to treat-populatie met een CPS van 5 of hoger was statistisch significant beter in de nivolumab-groep dan in de controlegroep (HR: 0,68 [98%-BI: 0,56-0,81]; P < 0,0001). De mediane PFS bedroeg 7,7 maanden (95%-BI: 7,0-9,2) in de nivolumab-groep en 6,0 maanden (95%-BI: 5,6-6,9) in de controlegroep. Geschat werd dat na 12 maanden 36 procent (95%-BI: 32-41) vrij was van progressie of overlijden in de nivolumab-groep en 22 procent (95%-BI: 18-26) in de controlegroep.
Tumorrespons op basis van RECIST-criteria trad op in de populatie met een CPS van 5 of hoger bij 60 procent van de patiënten in de nivolumab-groep en bij 45 procent van de patiënten in de controlegroep. In de gehele patiëntenpopulatie kreeg 38 procent van de patiënten in de nivolumab-groep en 41 procent van de patiënten in de controlegroep nog minstens een behandeling na staken van de behandeling in studieverband. Van de patiënten in de controlegroep kreeg later alsnog 8 procent immuuntherapie.
In de groep patiënten met een CPS lager dan 5 was geen sprake van een behandelvoordeel van de toevoeging van nivolumab aan chemotherapie (ongestratificeerde HR: 0,94 [95%-BI: 0,78-1,13]). Bij de 44 geïncludeerde patiënten met microsatellietinstabiele tumoren was er een HR voor OS van 0,37 (95%-BI: 0,16-0,87) versus een HR voor OS van 0,80 (95%-BI: 0,71-0,91) bij de 1.377 geïncludeerde patiënten met microsatellietstabiele tumoren.
Van de 789 patiënten in de nivolumab-groep ontvingen 782 patiënten ten minste één cyclus; hiervan kregen 360 patiënten CAPOX en 422 FOLFOX met een mediane behandelduur van 6,8 maanden. Voor de chemotherapie werd de dosis gereduceerd bij 46 procent (oxaliplatine CAPOX), 14 procent (capecitabine CAPOX), 41 procent (oxaliplatine FOLFOX), 31 procent (5-FU bolus FOLFOX) en 43 procent (5-FU continu FOLFOX). Bij 284 patiënten (36 procent) traden bijwerkingen op waardoor de behandeling gestaakt werd. Van de 792 patiënten in de controlegroep ontvingen 767 patiënten ten minste één cyclus; hiervan kregen 361 patiënten CAPOX en 406 FOLFOX met een mediane behandelduur van 4,9 maanden. De dosis werd gereduceerd bij 40 procent (oxaliplatine CAPOX), 15 procent (capecitabine CAPOX), 45 procent (oxaliplatine FOLFOX), 36 procent (5-FU bolus FOLFOX) en 37 procent (5-FU continu FOLFOX) en was vergelijkbaar tussen beide groepen. Bij 181 patiënten (24 procent) traden bijwerkingen op waardoor de behandeling gestaakt werd.
In totaal hadden 358 patiënten (46 procent) van de met chemotherapie behandelde patiënten met nivolumab ten minste één bijwerking van graad 3; 104 patiënten (13 procent) hadden toxiciteit van graad 4. Toxiciteit van graad 5 trad in de nivolumab-groep op bij 4 patiënten (cerebrovasculair accident, febriele neutropenie, gastro-intestinale inflammatie en pneumonie). In de nivolumab-groep overleden 16 patiënten ten gevolge van bijwerkingen: 4 patiënten aan een nivolumab-bijwerking (allen pneumonitis), 7 patiënten chemotherapie-bijwerkingen (febriele neutropenie [2], gastro-intestinale bloeding [1], mucositis van de darm [1], pneumonie [1], septische shock [1] en een CVA [1]) en 5 patiënten aan de combinatie van chemotherapie met nivolumab (acuut herseninfarct, gedissemineerde intravasale stolling, gastro-intestinale toxiciteit, infectie en mesenteriale trombose; alle 1). De meest voorkomende (5 procent of hoger) bijwerkingen van graad 3 of hoger in de nivolumab-groep waren neutropenie (15 procent) of lage neutrofielen (11 procent), anemie (6 procent) en verhoogd lipase (5 procent). Potentieel immuuntherapiegerelateerde bijwerkingen van graad 3 of 4 in de nivolumab-groep met een incidentie van 3 procent of hoger waren huidtoxiciteit (3 procent), gastro-intestinale toxiciteit (5 procent) en levertoxiciteit (4 procent). In totaal hadden 285 patiënten (37 procent) van de patiënten behandeld met chemotherapie ten minste één bijwerking van graad 3; 56 patiënten (7 procent) hadden toxiciteit van graad 4. In de controlegroep= waren de meest voorkomende bijwerkingen van graad 3 of 4 (incidentie 5 procent of hoger) neutropenie (12 procent) of lage neutrofielen (9 procent). Er overleden 4 patiënten in de controlegroep ten gevolge van bijwerkingen (diarree [1], asthenie en fors verminderde eetlust [1], longembolie [1] en pneumonitis [1]). Analyses van kwaliteit van leven toonden voor de nivolumabgroep ten opzichte van de controlegroep geen statistisch significant verschillende score voor de FACTGa.
Discussie
Deze studie werd aanvankelijk opgezet voor een vergelijking van immuuntherapie (nivolumab en ipilimumab) en chemotherapie. Bij het bekend worden van meer gegevens van eerdere studies over de predictieve waarde van CPS en de additieve waarde van chemotherapie met immuuntherapie, is de studie geamendeerd naar een driearmige studie met ook een nivolumab-groep waarbij tevens de primaire studiepopulatie werd aangepast naar patiënten met een tumor met een CPS van 5 of hoger. Opvallend is dat bij ongeveer 60 procent van de gerandomiseerde patiënten sprake is van een CPS van 5 of hoger. In de planning van de studie werd rekening gehouden met 35 procent. Dit leidt ertoe dat de populatie waarover gerapporteerd wordt (955 patiënten) groter is dan vooraf berekend in het statistische plan (554 patiënten).
In de CheckMate 649-studie wordt een statistisch significant verschil aangetoond voor het duale primaire eindpunt OS (interim-analyse) en PFS (finale analyse) van palliatieve behandeling met chemotherapie in combinatie met nivolumab ten opzichte van chemotherapie alleen bij patiënten met een adenocarcinoom van de maag, gastro-oesofageale overgang of oesofagus én een CPS van 5 of hoger (HR voor OS: 0,71 [98,4%-BI: 0,59-0,86]; P < 0,0001; HR voor PFS: 0,68 [98%-BI: 0,56-0,81]; P < 0,0001). Dit resulteert in een verlenging van de mediane OS bij deze populatie van 3,3 maanden (14,4 maanden [95%-BI: 13,1-16,2] versus 11,1 maanden [95%-BI: 10,0-12,1]) en een bescheiden verlenging van PFS van 1,7 maanden (7,7 maanden [95%-BI: 7,0-9,2] versus 6,0 maanden [95%-BI: 5,6-6,9]). De resultaten van dit duale eindpunt voldoen aan de criteria voor een positief advies volgens de PASKWIL-criteria voor palliatieve behandeling.
5. Kosten
De behandeling met nivolumab 360 mg kost 3.973 euro per behandelcyclus van 21 dagen (bron: medicijnkosten.nl d.d. 5 april 2022). De totale medicatiekosten van mediaan 6,8 maanden behandeling komen daarmee op 39.730 euro. De werkelijk betaalde prijs is niet bekend omdat nivolumab nog tot in ieder geval begin 2024 in de sluis zit. De chemotherapie is in beide behandelarmen gegeven en wordt daarom niet meegenomen in de prijscalculatie.
Conclusie
In de hier besproken CheckMate 649-studie wordt bij patiënten met HER2-negatief adenocarcinoom van maag, gastro-oesofageale overgang of oesofagus met een CPS van 5 of hoger, na een follow-up van mediaan 13,1 maanden een 3,3 maanden betere OS en een 1,1 maanden betere PFS gezien na palliatieve behandeling met chemotherapie (CAPOX of FOLFOX) met nivolumab dan na chemotherapie alleen (OS: 14,4 versus 11,1 maanden; HR voor OS: 0,71 [98,4%-BI: 0,59-0,86]; P < 0,0001) (PFS: 7,7 versus 6,0 maanden; HR voor PFS: 0,68 [98,4%-BI: 0,56-0,81]; P < 0,0001). Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL-criteria voor palliatieve behandeling.
Referenties
- Dijksterhuis WPM, Verhoeven RHA, Slingerland M, et al. Heterogeneity of firstline palliative systemic treatment in synchronous metastatic esophagogastric cancer patients: a real-world evidence study. Int J Cancer 2020;146(7):1889-901.
- Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet 2021;398(10294):27-40.
- Kulangara K, Guerrero L, Posch A, et al. Investigation of PD-L1 expression and response to pembrolizumab (pembro) in gastric cancer (GC) and cervical cancer (CC) using combined positive score (CPS) and tumor proportion score (TPS). J Clin Oncol 2018;36(no. 15_suppl):4065.
- Lei M, Siemers N, Pandya D, et al. Association of PD-L1 combined positive score and immune gene signatures with efficacy of nivolumab (NIVO) ± ipilimumab (IPI) in patients with metastatic gastroesophageal cancer (mGEC). Cancer Res 2019:79(13_supplement):2673.
- Shitara K, Özgüroğlu M, Bang Y-J, et al; KEYNOTE-061 investigators. Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastrooesophageal junction cancer (KEYNOTE-061): a randomised, open-label, controlled, phase 3 trial. Lancet 2018;392(10142):123-33.