
Inleiding
Van de patiënten met gemetastaseerd colorectaal carcinoom heeft 4 tot 7 procent een microsatellietinstabiliteit high (MSI-H) en/of mismatch repair-deficiënte (dMMR) tumor.1 Deze tumoren reageren matig op conventionele chemotherapie en/of doelgerichte therapie. De behandeling van gemetastaseerde colorectale kanker met MSI-H/dMMR is aanzienlijk verbeterd met de introductie van immuuncheckpointremmers.2-5 Pembrolizumab, een PD-1-remmer, toonde in de KEYNOTE-177-studie een verbeterde progressievrije overleving (PFS) in vergelijking met chemotherapie bij patiënten met gemetastaseerd colorectaal carcinoom met MSI-H/dMMR in de eerste lijn waarvoor een positief cieBOM-advies is gegeven.2 In de niet-gerandomiseerde fase II-studie CheckMate 142 toonden nivolumab (een PD-1-remmer) en ipilimumab (cytotoxische T-lymfocyt-antigeen 4 (CTLA4-)remmer) veelbelovende effectiviteit en een acceptabel bijwerkingenprofiel bij zowel eerder behandelde als onbehandelde immuuntherapie-naïeve patiënten met gemetastaseerd colorectaal carcinoom met MSI-H/dMMR.6
In de hier te bespreken fase III-studie CheckMate 8HW wordt behandeling met nivolumab en ipilimumab vergeleken met behandeling met nivolumab, of chemotherapie met of zonder doelgerichte therapie, bij patiënten met een gemetastaseerd colorectaal carcinoom met MSI-H/dMMR.7,8
EMA heeft behandeling met ipilimumab en nivolumab goedgekeurd voor volwassenen met een MSI-H of dMMR colorectaal carcinoom als eerstelijnsbehandeling bij irresectabele of gemetastaseerde ziekte en als behandeling bij gemetastaseerde ziekte na eerdere behandeling met fluoropyrimidine-bevattende chemotherapie.
Kankersoort en lijn van behandeling
Combinatiebehandeling met nivolumab en ipilimumab werd onderzocht bij patiënten met een gemetastaseerd MSI-H of dMMR colorectaal carcinoom als eerste- of laterelijnsbehandeling.
Vergelijking met de referentiebehandeling in Nederland
In de CheckMate 8HW-studie wordt palliatieve behandeling met nivolumab en ipilimumab vergeleken met nivolumab monotherapie (in alle lijnen) en met chemotherapie met of zonder doelgerichte therapie (in de eerste lijn). Ten tijde van de start van deze studie was chemotherapie met of zonder doelgerichte therapie nog de standaardbehandeling in Nederland. Na een positief cieBOM-advies in 2021 is dat veranderd in pembrolizumab als eerstelijnsbehandeling.5 Nivolumab kan in Nederland worden ingezet als monotherapie bij dMMR solide tumoren bij ontbreken van standaardtherapie. Nivolumab heeft een vergelijkbaar werkingsmechanisme als pembrolizumab, maar deze middelen zijn daarmee niet zonder meer uitwisselbaar. De groep die in de eerste lijn behandeld werd met chemotherapie komt overeen met de destijds geldende Nederlandse praktijk en zal in dit rapport als referentiegroep worden gebruikt.
Methode en kwaliteit van de studie
De CheckMate 8HW-studie is een gerandomiseerde, open-label, fase III-multicenterstudie voor patiënten met een MSI-H/dMMR recidief of gemetastaseerd irresectabel colorectaal carcinoom. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1 te hebben. Er moest sprake zijn van radiologisch evalueerbare ziekte volgens RECIST 1.1. Er moest voldoende tumormateriaal beschikbaar zijn zodat na randomisatie de aanwezigheid van MSI-H en/of dMMR centraal bevestigd kon worden. Eerdere behandeling met immuuncheckpointremmers was niet toegestaan. Patiënten met 0 of 1 eerdere behandellijnen voor gemetastaseerde ziekte werden 2:2:1 gerandomiseerd tussen behandeling met nivolumab en ipilimumab, nivolumab of chemotherapie. Patiënten met 2 of meer eerdere behandelingen voor gemetastaseerde ziekte werden 1:1 gerandomiseerd tussen nivolumab en ipilimumab of nivolumab. De patiënten werden gestratificeerd op basis van de zijde van de primaire tumor (rechts versus links) en het aantal eerdere behandellijnen (0 versus 1 versus ≥ 2). Adjuvante of neoadjuvante chemotherapie diende meer dan 6 maanden voor inclusie te zijn afgerond, anders werd het beschouwd als eerstelijns palliatieve behandeling.
Na bekend worden van de resultaten van de KEYNOTE-177-studie is met een amendement, na inclusie van 560 patiënten, de studie uitgebreid met een tweede deel waarin alleen patiënten die geen eerdere behandeling hadden gehad 2:2:1 werden gerandomiseerd. Aan patiënten in de nivolumab-ipilimumabgroep werd nivolumab 240 mg in combinatie met ipilimumab 1 mg/kg lichaamsgewicht intraveneus toegediend elke 3 weken gedurende de eerste 12 weken (tot maximaal 4 doses ipilimumab), gevolgd door nivolumab 480 mg als monotherapie elke 4 weken. Patiënten in de nivolumabgroep kregen nivolumab 240 mg intraveneus elke 2 weken gedurende de eerste 12 weken, gevolgd door nivolumab 480 mg elke 4 weken. De door de onderzoeker gekozen chemotherapie kon bestaan uit mFOLFOX6 met of zonder bevacizumab of cetuximab of FOLFIRI met of zonder bevacizumab of cetuximab en werd 2-wekelijks intraveneus toegediend volgens het doserings- en toedieningsschema dat in het protocol was gespecificeerd. Cross-over naar nivolumab en ipilimumab was toegestaan voor patiënten na ziekteprogressie in de chemotherapiegroep. Behandelingen werden gecontinueerd tot ziekteprogressie, intrekking van toestemming of onaanvaardbare toxiciteit. Patiënten in de nivolumab-ipilimumabgroep en nivolumabgroep kregen de studiemedicatie maximaal 2 jaar (inclusief patiënten die overstapten naar nivolumab en ipilimumab na chemotherapie). Dosisreductie van nivolumab en ipilimumab was niet toegestaan.
Er waren twee onafhankelijke primaire eindpunten, beide PFS, onafhankelijk en geblindeerd centraal vastgesteld. Het ene primaire eindpunt was PFS voor de vergelijking nivolumab en ipilimumab versus chemotherapie in de eerste lijn. Het andere primaire eindpunt was PFS voor de vergelijking tussen nivolumab en ipilimumab versus nivolumab monotherapie in alle behandellijnen. Secundaire eindpunten waren onder andere objectieve responskans (ORR), overleving (OS), en PFS voor de vergelijking nivolumab en ipilimumab versus nivolumab als eerste behandellijn. Veiligheid en kwaliteit van leven waren exploratieve eindpunten.
Een CT-scan voor evaluatie werd in de eerste 24 weken elke 6 weken gemaakt, daarna iedere 8 weken. In de eerste twee jaar werd bij elk follow-upbezoek ook kwaliteit van leven gemeten met de vragenlijsten EQ-5D-3L Questionnaire, EORTC QLQ-C30 en EORTC QLQ-CR29. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0. De MSI/MMR-status werd centraal bevestigd door middel van het mismatch repair immunohistochemistry panel pharmDx (Dako Omnis, codes GE079, GE087, GE085, GE086; Agilent) of middels PCR-analyse (Idylla MSI-test[(Biocartis]). Data over vervolgbehandelingen zijn verzameld in deze studie.
Volgens het ontwerp van de studie waren in totaal circa 831 patiënten nodig. Voor de vergelijking van het primaire eindpunt nivolumab en ipilimumab met nivolumab in alle lijnen was een tweezijdige alfa van 0,006 gereserveerd en voor de vergelijking van nivolumab en ipilimumab met chemotherapie in de eerste lijn een alfa van 0,044. Voor de evaluatie van het primaire eindpunt nivolumab en ipilimumab versus chemotherapie in de eerste lijn waren 230 patiënten en 125 events nodig om met 99 procent power en een tweezijdige alfa van 0,044 een HR van 0,55 voor PFS vast te kunnen stellen. Er was voorzien in een interimanalyse na circa 106 events. Als het eindpunt PFS nivolumab en ipilimumab versus chemotherapie positief was, kon een deel van een alfa van 0,024 worden hergebruikt voor de analyse nivolumab en ipilimumab versus nivolumab. Voor de interimanalyses en finale analyse werd de alfa verdeeld volgens de O’Brien-Fleming-methode. De secundaire eindpunten zouden hiërarchisch getest worden als de primaire eindpunten positief waren.
De hier gerapporteerde data zijn afkomstig van de interim-analyse van het primaire eindpunt PFS nivolumab en ipilimumab versus chemotherapie in de eerste lijn (data-cutoff 12 oktober 2023). Bij 100 events (informatiefractie 80 procent) was de alfa voor deze analyse 0,0209.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen
Tussen 16 augustus 2019 en 10 april 2023 werden 839 patiënten geïncludeerd door 121 centra in 23 landen in Noord- en Zuid-Amerika, Europa, Azië en Australië: 354 patiënten in nivolumab-ipilimumabgroep, 353 patiënten in de nivolumabgroep en 132 patiënten in de chemotherapiegroep.
Voor de analyse van PFS in de nivolumab-ipilimumabgroep versus chemotherapiegroep werden alleen de patiënten meegenomen die geen eerdere behandeling voor gemetastaseerde ziekte hadden ondergaan en bij wie de MSI/MMR-status centraal bevestigd kon worden. Van de 354 patiënten in de nivolumab-ipilimumabgroep waren 202 patiënten (57 procent) niet eerder behandeld en bij 171 patiënten (85 procent) kon de dMMR-status centraal bevestigd worden. Van de 132 patiënten in de chemotherapiegroep waren 101 patiënten (77 procent) niet eerder behandeld en bij 84 patiënten (83 procent) kon de dMMR-status centraal bevestigd worden. Deze groep vormt de effectiviteitsgroep waarin de PFS-analyse is verricht.
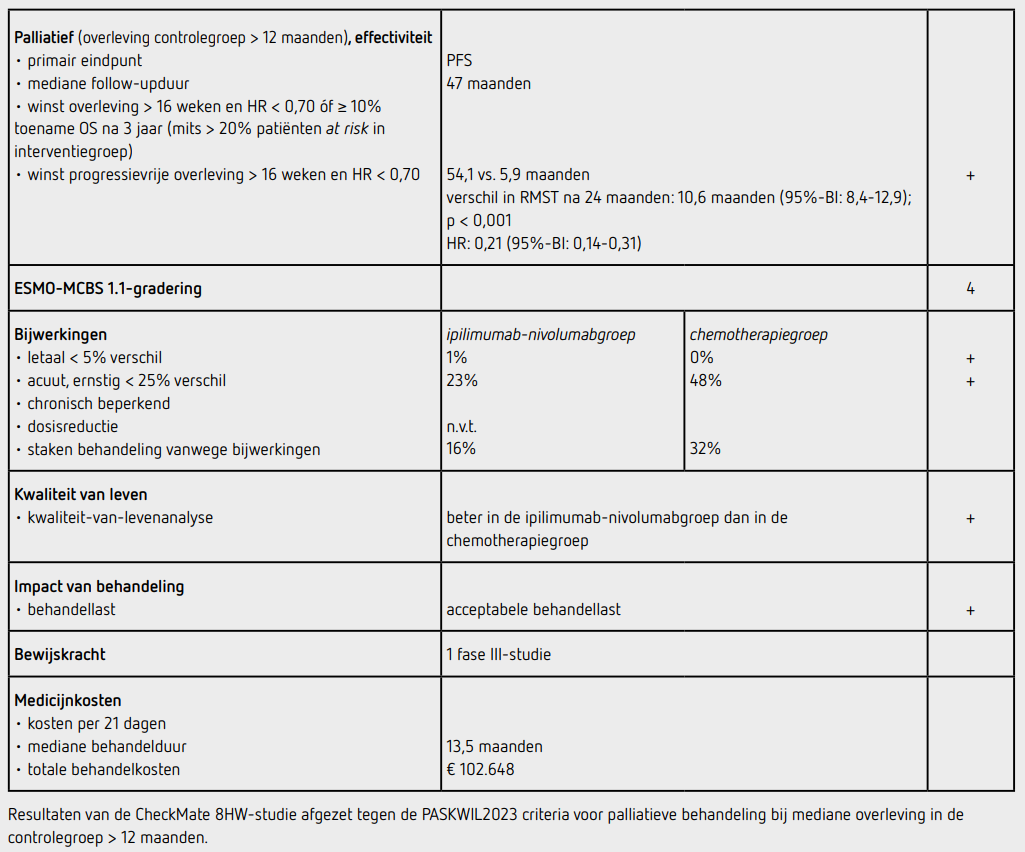
De uitgangskarakteristieken waren vergelijkbaar tussen de groepen: de mediane leeftijd lag rond de 63 jaar, iets minder dan de helft was man, de helft had een ECOG-performancestatus van 0,73 procent van de patiënten had een rechtszijdig coloncarcinoom, 43 procent had synchroon gemetastaseerde ziekte en ongeveer een derde had eerder (neo) adjuvante chemotherapie ondergaan. Na een mediane follow-up van 31,5 maanden hadden 48 patiënten in de nivolumab-ipilimumabgroep en 52 patiënten in de chemotherapiegroep progressie of waren overleden. Het primaire eindpunt PFS was statistisch significant langer in de nivolumab-ipilimumabgroep dan in de chemotherapiegroep (p < 0,001). Omdat de hazards niet proportioneel waren, werd een restricted mean survival time-analyse (RMST) uitgevoerd om het behandeleffect te kwantificeren. Na 24 maanden was het verschil in geschatte RMST 10,6 maanden (95%-BI: 8,4-12,9). De mediane PFS was niet bereikt (95%-BI: 38,4 maanden-niet bereikt) in de nivolumab-ipilimumabgroep en 5,9 maanden (95%-BI: 4,4-7,8) in de chemotherapiegroep. De 2-jaars PFS was 72 procent in de nivolumab-ipilimumabgroep en 14 procent in de chemotherapiegroep. Dit verschil leek min of meer consistent over de vooraf gespecificeerde subgroepen. Tijdens het ASCO2025-congres werd een update van de PFS-analyse gepresenteerd bij een mediane follow-up van 47 maanden. De mediane PFS was 54,1 maanden (95%-BI: 54,1-niet bereikt) in de nivolumab-ipilimumabgroep en 5,9 maanden (95%-BI: 4,4- 9,8) in de chemotherapiegroep (HR: 0,21 [95%-BI: 0,14-0,31]).9 Het andere primaire eindpunt PFS bij 296 patiënten in de nivolumab-ipilimumabgroep in alle behandellijnen was ook langer dan bij 286 patiënten in de nivolumab-groep in alle behandellijnen (HR: 0,62 [95%-BI: 0,48-0,81]; p = 0,0003). De mediane PFS was nog niet bereikt in de nivolumab-ipilimumabgroep (95%-BI: 53,8 maanden-niet bereikt) en 39,3 maanden in de nivolumabgroep (95%-BI: 22,1-niet bereikt). De verbeterde PFS was niet verschillend in de vooraf gespecificeerde subgroepen. De uitkomsten van de vergelijking nivolumab-ipilimumab versus nivolumab in de eerste lijn zijn nog niet gerapporteerd.
De OS-data zijn voor beide analyses nog niet matuur. Van de 200 patiënten (99 procent) in de nivolumab-ipilimumabgroep die ten minste 1 dosis medicatie ontvingen als eerstelijnsbehandeling, werd minstens 1 van de middelen voortijdig gestaakt vanwege bijwerkingen door 33 patiënten (16 procent). Van de 88 patiënten (87 procent) in de chemotherapiegroep die ten minste één dosis medicatie ontvingen als eerstelijnsbehandeling, staakten in totaal 28 patiënten (32 procent) minstens 1 van de middelen voortijdig vanwege bijwerkingen.
De mediane behandelduur was 13,5 maanden in de nivolumab-ipilimumabgroep en 4,0 maanden in de chemotherapiegroep. In totaal hadden 46 patiënten (23 procent) in de nivolumab-ipilimumabgroep en 42 patiënten (48 procent) in de chemotherapiegroep ten minste één bijwerking van graad 3 of 4. Er traden geen onverwachte bijwerkingen op. In de nivolumab-ipilimumabgroep overleden 2 patiënten (1 procent) ten gevolge van de behandeling; er zijn geen patiënten overleden in de chemotherapiegroep als gevolg van de behandeling. Analyses van kwaliteit van leven toonden een verschil tussen de groepen waarbij na 13 weken de kwaliteit van leven beter was in de nivolumab-ipilimumabgroep dan in de chemotherapiegroep.
Kwaliteit van de studie en interpretatie van de uitkomsten
De studie is veelvuldig geamendeerd (in totaal 10 keer), waarbij een primair eindpunt is toegevoegd en het aantal te includeren patiënten is opgehoogd.
Opvallend was de grote discordantie (15 procent) tussen lokale testen voor MSI-H/dMMR en de centraal vastgestelde uitkomsten hiervan. Ruim 10 procent van de patiënten die gerandomiseerd waren voor chemotherapie kreeg niet de toegewezen behandeling, ten opzichte van 1 procent in de nivolumab-ipilimumabgroep. Dit was voornamelijk omdat patiënten behandeling met chemotherapie weigerden. Of deze patiënten alsnog een behandeling kregen, en welke behandeling dit was wordt niet vermeld.
Cross-over naar nivolumab en ipilimumab na progressie op chemotherapie was toegestaan. Er is (nog) niet gerapporteerd hoe vaak dit voorkwam.
Formeel kon de HR niet worden bepaald vanwege niet proportionele hazards waardoor het primaire eindpunt met behulp van RMST is geanalyseerd. De PFS-curves lopen reeds snel uiteen en het verschil lijkt al snel blijvend groter dan 30 procent. De geschatte HR van 0,21 lijkt derhalve een goede indicatie om het grote verschil tussen de curves aan te geven. Voor wat betreft de PASKWIL-criteria bestaat er op basis van visuele inspectie van de Kaplan-Meier-curves bij cieBOM geen twijfel dat de HR lager dan 0,70 zal zijn.
Discussie
In de CheckMate 8HW-studie werd een statistisch significant voordeel aangetoond voor het primaire eindpunt PFS van palliatieve eerstelijnsbehandeling met nivolumab-ipilimumab ten opzichte van chemotherapie bij patiënten met een gemetastaseerd MSI-H of dMMR colorectaal carcinoom (verschil in RMST na 24 maanden: 10,6 maanden (95%-BI: 8,4-12,9]; p < 0,001) met een benaderde HR van 0,21 (95%-BI: 0,14-0,31). De mediane PFS was 54,1 maanden in de nivolumab-ipilimumabgroep en 5,9 maanden in de chemotherapiegroep. Deze resultaten voldoen aan de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep van meer dan 12 maanden voor een positief advies.
Het tweede primaire eindpunt toont ook een statistisch significant voordeel voor nivolumab en ipilimumab ten opzichte van nivolumab monotherapie ongeacht lijn van behandeling. Ten tijde van het ontwerp van deze studie was chemotherapie de standaard eerstelijnsbehandeling voor gemetastaseerd MSI-H/ dMMR colorectaal carcinoom. Inmiddels is echter immuuntherapie in de vorm van pembrolizumab als monotherapie de standaard eerstelijnsbehandeling voor deze specifieke patiëntengroep. Nivolumab heeft een vergelijkbaar werkingsmechanisme als pembrolizumab. In de hier besproken CheckMate 8HW-studie is echter de effectiviteit van nivolumab monotherapie ten opzichte van chemotherapie niet getest en kan formeel niet geconcludeerd worden dat nivolumab evenals pembrolizumab superieur is ten opzichte van chemotherapie. Het heeft inmiddels de voorkeur om immuuntherapie in de eerste lijn te geven. De resultaten van het secundaire eindpunt PFS voor de vergelijking nivolumab-ipilimumab versus nivolumab in de eerste lijn volgen nog. Bij de interim-analyse waren deze data nog niet matuur en in de subgroepanalyse wordt de effectiviteit in de verschillende behandellijnen nog niet beschreven omdat eerstelijnsbehandeling een secundair eindpunt is en derhalve formeel getest dient te worden. De richtlijncommissie is gevraagd een nadere duiding te geven over plaats van nivolumab-ipilimumab ten opzichte van pembrolizumab.
De aan de behandeling gerelateerde toxiciteit was numeriek lager in de nivolumab-ipilimumabgroep dan in de chemotherapiegroep, met name door verschil in neutropenie.
Opvallend is dat het aantal graad 3-4 bijwerkingen in de nivolumab-ipilimumabgroep wel lager is dan gerapporteerd in andere studies met een vergelijkbare dosering van deze middelen.
Kosten
De behandeling met nivolumab 240 mg en ipilimumab 1 mg/kg kost bij een gewicht van 80 kilogram respectievelijk 2.648 euro en 7.125 euro per behandelcyclus van 21 dagen (bron: medicijnkosten.nl d.d. juni 2025). De totale medicatiekosten van 4 cycli nivolumab en ipilimumab komen daarmee op 39.096 euro voor de eerste 12 weken. Daarna kregen patiënten mediaan 12 cycli nivolumab 480 mg elke 4 weken. De totale behandelkosten komen daarmee op 102.648 euro.
Conclusie
In de hier besproken CheckMate 8HW-studie wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt PFS van palliatieve eerstelijnsbehandeling met nivolumab-ipilimumab ten opzichte van chemotherapie bij patiënten met een gemetastaseerd irresectabel MSI-H of dMMR colorectaal carcinoom (verschil in RMST na 24 maanden: 10,6 maanden (95%-BI: 8,4-12,9; p < 0,001) met een benaderde HR van 0,21 (95%-BI: 0,14-0,31). De mediane PFS is 54,1 maanden in de nivolumab-ipilimumabgroep en 5,9 maanden in de chemotherapiegroep. Deze resultaten voldoen aan de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep van meer dan 12 maanden voor een positief advies.
Referenties
- Gutierrez C, Ogino S, Meyerhardt JA, Iorgulescu JB. The prevalence and prognosis of microsatellite instability-high/mismatch repair-deficient colorectal adenocarcinomas in the United States. JCO Precis Oncol 2023;7:e2200179.
- André T, Shiu KK, Kim TW et al; KEYNOTE-177 Investigators. Pembrolizumab in microsatellite-instability-high advanced colorectal cancer. N Engl J Med 2020;383(23):2207-18.
- Cervantes A, Adam R, Rosello S et al. Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2023;34(1):10-32.
- Morris VK, Kennedy EB, Baxter NN et al. Treatment of metastatic colorectal cancer: ASCO guideline. J Clin Oncol 2023;41(3):678-700.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab als eerstelijnsbehandeling van het gemetastaseerd microsatellietinstabiel colorectaal carcinoom. Med Oncol 2021;24(2):33-6.
- Lenz HJ, Van Cutsem E, Luisa Limon M et al. First-line nivolumab plus low-dose ipilimumab for microsatellite instability-high/mismatch repair-deficient metastatic colorectal cancer: the phase 2 CheckMate 142 study. J Clin Oncol 2022 40(2):161-70.
- Andre T, Elez E, Van Cutsem E et al. Nivolumab plus ipilimumab in microsatelliteinstability-high metastatic colorectal cancer. N Engl J Med 2024;391(21):2014-26.
- André T, Elez E, Lenz HJ et al. Nivolumab plus ipilimumab versus nivolumab in microsatellite instability-high metastatic colorectal cancer (CheckMate 8HW): a randomised, open-label, phase 3 trial. Lancet 2025;405(10476):383-95.
- Lenz H-J, Lonardi S, Elez E et al. Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) or NIVO monotherapy for microsatellite instability-high/ mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): Expanded analyses from CheckMate 8HW. J Clin Oncol 2025;43(16 suppl):3501.