
Inleiding
Het anaplastisch schildkliercarcinoom is een zeer zeldzaam type schildkliercarcinoom met een jaarlijkse incidentie van ongeveer 40 patiënten in Nederland.1 Bij diagnose is meestal sprake van lokaal uitgebreide of gemetastaseerde ziekte en de prognose is zeer somber met een 1-jaarsoverleving van 10-20%.2 Chemotherapie, bijvoorbeeld in de vorm van een taxaan of doxorubicine, of doelgerichte therapie met een tyrosinekinaseremmer (TKI) is nauwelijks effectief. Sommige anaplastische schildkliercarcinomen hebben een NTRK-verandering, een RET-fusie of een mismatch repair-deficiëntie waardoor patiënten in aanmerking kunnen komen voor gerichte behandeling. Bij ongeveer 20-50% van de anaplastische schildkliercarcinomen is een activerende BRAF-V600E-mutatie in de tumor aanwezig. Patiënten met een gemetastaseerd melanoom of longcarcinoom met een BRAF-V600E-mutatie kunnen behandeld worden met een combinatie van de BRAF-remmer dabrafenib en de MEK-remmer trametinib.3,4 In een muismodel werd effect gezien van de combinatie van een RAF-en een MEK-remmer bij BRAF-V600E-gemuteerd anaplastisch schildkliercarcinoom.5
De ROAR-studie is een eenarmige fase II-basketstudie waarin patiënten met een gemetastaseerde of gevorderde maligniteit met een BRAF-V600E-mutatie werden behandeld met dabrafenib en trametinib.6 De effectiviteit bij patiënten met een BRAF-gemuteerd anaplastisch schildkliercarcinoom werd separaat geanalyseerd.7,8 EMA heeft dabrafenib en trametinib niet beoordeeld voor het anaplastisch schildkliercarcinoom.
Kankersoort en lijn van behandeling
De combinatiebehandeling met dabrafenib en trametinib werd onderzocht bij patiënten met een irresectabel of gemetastaseerd anaplastisch schildkliercarcinoom met een BRAF-V600E-mutatie.
Onderbouwing voor een niet-gerandomiseerde studie
Het anaplastisch schildkliercarcinoom is uiterst zeldzaam. Daarnaast is het klinisch beloop dermate agressief dat veel patiënten op het moment van diagnose geen behandeling meer aankunnen. Dit betekent dat in deze patiëntencategorie een gerandomiseerde fase III-studie niet haalbaar is en er sprake is van een unmet medical need.
Methoden van de studie
De ROAR-studie is een eenarmige open-label fase II-studie voor patiënten met een maligniteit met een BRAF-V600E-mutatie. Patiënten werden geïncludeerd in 1 van de cohorten voor de verschillende tumortypes: anaplastisch schildkliercarcinoom, glioom (laaggradig of hooggradig), dunnedarmkanker, hairy cell-leukemie, multipel myeloom, galwegcarcinoom, kiemceltumoren (non-seminoom of non-germinoom) of gastro-intestinale stromale tumor. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0-2 te hebben. In de tumor moest een BRAF-V600E-mutatie zijn vastgesteld in een lokaal laboratorium of in een centraal laboratorium middels de THxID-BRAF-kit. Er moest weefsel beschikbaar zijn voor centrale bevestiging.
In het cohort patiënten met een anaplastisch schildkliercarcinoom moest er sprake zijn van meetbare ziekte volgens RECIST 1.1 en er mochten geen zinvolle andere behandelopties voorhanden zijn. Patiënten moesten chirurgie en/of radiotherapie van de primaire tumor hebben ondergaan tenzij er sprake was van afstandsmetastasen. Eerdere behandeling met een BRAF- of MEK-remmer was niet toegestaan, radiotherapie diende ten minste 7 dagen en chirurgie ten minste 14 dagen voor inclusie te zijn afgerond. De behandeling bestond uit dabrafenib 150 mg tweemaal daags en trametinib 2 mg eenmaal daags oraal ingenomen en werd gecontinueerd tot ziekteprogressie of onacceptabele toxiciteit. Dosisreductie of onderbreken van therapie was toegestaan.
Het primaire eindpunt was het percentage patiënten met een door de lokale onderzoeker vastgestelde objectieve respons (ORR). De respons werd achteraf centraal en onafhankelijk bevestigd. Secundaire eindpunten waren duur van de respons (DoR), overleving (OS), progressievrije overleving (PFS) en veiligheid. Kwaliteit van leven werd niet gemeten. Beeldvorming middels MRI-hersenen en CT-hals, -thorax en -abdomen werd bij inclusie in de studie verricht en responsevaluatie werd middels CT-thorax en -abdomen uitgevoerd gedurende de behandeling elke 8 weken, binnen 28 dagen na stop van de behandeling, daarna elke 4 weken gedurende de eerste 6 maanden en vervolgens elke 3 maanden.
Door een adaptief statistisch model kon de effectiviteit separaat in de verschillende cohorten worden geanalyseerd met uitwisseling van informatie tussen de cohorten waardoor de alfa kon worden gecontroleerd. Voor ieder cohort werd een specifieke aanname gedaan over de ORR van de historische controle en over wat een klinisch relevante verbetering zou zijn. De alfa en de power waren afhankelijk van de homogeniteit in uitkomsten tussen de verschillende cohorten. Elke 12 weken werd een analyse voor futiliteit en effectiviteit verricht en de maximale grootte van elk cohort was 25 patiënten. Effectiviteit kon per cohort worden vastgesteld na inclusie van ten minste 10 patiënten als de achterafkans dat de ORR hoger was dan de historische controle ten minste 95% was. De primaire analyse vond plaats nadat alle patiënten in het cohort hun behandeling hadden beëindigd, of ten minste 8 maanden waren behandeld. Voor het cohort patiënten met anaplastisch schildkliercarcinoom was de ORR van de historische controle op 15% verondersteld en werd een ORR van 60% als klinisch relevante verbetering beschouwd.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen
Tussen april 2014 en juli 2018 werden 206 patiënten met een BRAF-V600E-gemuteerde maligniteit geïncludeerd. Het primaire cohort patiënten met anaplastisch schildkliercarcinoom werd na inclusie van 15 patiënten vanwege effectiviteit gesloten. In latere instantie werd een expansiecohort van nog 21 patiënten toegevoegd. Deze 36 patiënten vormen de intention-to-treat-populatie.
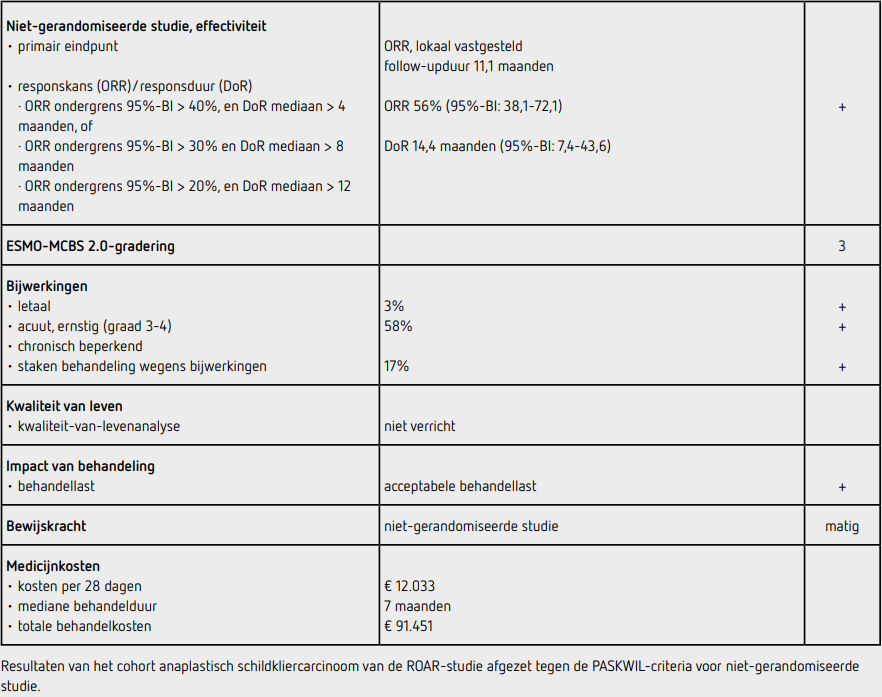
De mediane leeftijd was 71 jaar en 56% was vrouw. Alle patiënten hadden eerdere behandeling ondergaan: 83% chirurgie, 83% radiotherapie en 42% had eerdere systemische therapie gekregen. De BRAF-mutatie was bij 92% centraal bevestigd. Op het moment van data-cutoff was de mediane follow-upduur 11,1 maanden. De ORR was 56% (95%-BI: 38,1-72,1). De mediane DoR was 14,4 maanden (95%-BI: 7,4-43,6). In de initiële groep van 15 patiënten in de ROAR-studie was de bayesiaanse schatting, die rekening houdt met informatie over de ORR uit de andere histologische types, van de ORR 70% (95%-geloofwaardigheidsinterval: 46,8-89,3). De mediane PFS was 6,7 maanden (95%-BI: 4,7-13,8) en de mediane OS was 14,5 maanden (95%-BI: 6,8-23,2). De mediane behandelduur was 7,0 maanden.
Bijwerkingen van graad 3 of 4 kwamen voor bij 21 patiënten (58%). De meest voorkomende bijwerkingen van graad 3 of 4 waren anemie bij 7 patiënten (19%), pneumonie bij 7 patiënten (19%) en hyponatriëmie bij 6 patiënten (17%). Tijdens de behandeling zijn 3 patiënten (8%) overleden; bij geen van de overlijdens werd door de onderzoekers een relatie met de behandeling verondersteld (longembolie, pneumosepsis, bloeding uit de tractus digestivus). Huidafwijkingen en koorts kwamen bij de helft van de patiënten voor en waren meestal van graad 1 of 2. Bij 17 patiënten (47%) en 18 patiënten (50%) had dosisreductie of uitstel van behandeling vanwege bijwerkingen plaatsgevonden en bij 6 patiënten (17%) werd de behandeling vanwege bijwerkingen gestaakt.
In de totale groep van 206 patiënten in de ROAR-studie kwamen bijwerkingen van graad 3 of 4 voor bij 122 patiënten (59%). Er leek geen evident verschil in de bijwerkingen bij patiënten met anaplastisch schilkliercarcinoom vergeleken met de andere cohorten.
Kwaliteit van de studie en interpretatie van de uitkomsten
De bewijskracht van de studie is beperkt vanwege de nietgerandomiseerde opzet. De ROAR-studie is een basketstudie waarbij diverse tumortypen in verschillende cohorten werden geïncludeerd. Hierdoor kon met beperkte patiëntenaantallen per cohort een adequate power worden bereikt. De gezamenlijke analyse van het initiële cohort van 15 patiënten met anaplastisch schildkliercarcinoom in de ROAR-studie en de 21 patiënten van het expansiecohort leidt tot een robuustere schatting van het effect. De resultaten van deze cohorten komen goed overeen. Vanwege de afwezigheid van een referentiebehandeling voor anaplastisch schildkliercarcinoom ligt een eerstelijns setting voor de hand.
In het huidige landschap met beschikbaarheid van onder andere NTRK-remmers en selpercatinib is de relatie tot deze middelen onduidelijk en had aanwezigheid van NTRK- of RET-verandering of dMMR-status als exclusiecriterium kunnen worden meegenomen. Voor deelname aan de studie was de aanwezigheid van geschikt materiaal voor centrale bevestiging van de BRAF-V600E-mutatie vereist, maar de bevestiging zelf was niet vereist. Er wordt niet vermeld hoeveel patiënten na progressie een andere behandeling ontvangen hebben en welke behandeling dat was. Gezien het beloop van deze ziekte zullen de meeste patiënten niet meer voor een andere behandeling in aanmerking zijn gekomen.
Discussie
Het anaplastisch schildkliercarcinoom is een uiterst zeldzame en bijzonder agressief verlopende maligniteit waarvoor nauwelijks behandelopties zijn. De combinatie van dabrafenib en trametinib laat bij patiënten met een lokaal uitgebreid of gemetastaseerd anaplastisch schildkliercarcinoom een ORR zien van 56% (95%- BI: 38,1-72,1) met een DoR van 14,4 maanden (95%-BI: 7,4- 43,6). Deze uitkomsten voldoen aan de PASKWIL-criteria voor niet-gerandomiseerde studies voor een positief advies. De geschatte 2-jaars overleving van 30% is een stuk hoger dan de historische controles bij dit tumortype waarbij na 1 jaar nog 10-20% van de patiënten in leven is. Er heeft geen EMA-beoordeling voor deze indicatie plaatsgevonden en de verwachting is ook niet dat dit binnenkort gaat gebeuren. Als deze combinatie tot vergoede zorg in Nederland leidt, betekent dat dat bij elke patiënt met anaplastisch schildkliercarcinoom die na vaststellen van de diagnose voor behandeling in aanmerking komt, genotypering voor BRAF-V600E-mutatie dient te gebeuren.
Patiënten met een BRAF-non-V600E-mutatie hebben niet deelgenomen aan deze studie en voor deze patiënten is dus geen uitspraak te doen over de effectiviteit van dabrafenib en trametinib. Voor start van therapie is lokale behandeling van de tumor middels chirurgie en/of radiotherapie geïndiceerd, mits er geen afstandsmetastasen zijn. De behandeling met dabrafenib en trametinib wordt over het algemeen goed verdragen. Hoewel dit niet als zodanig door de onderzoekers is beoordeeld is een relatie met de behandeling bij de patiënt die overleed aan longembolieën geenszins uit te sluiten, aangezien dit een bekende bijwerking is.
Kosten
Behandeling met dabrafenib kost 5.925 euro en met trametinib kost 6.108 euro per cyclus van 28 dagen (bron: medicijnkosten.nl d.d. september 2025). De totale kosten bij een mediane behandelduur van 7 maanden komen hiermee op 91.451 euro.
Conclusie
Bij patiënten met een irresectabel of gemetastaseerd anaplastisch schildkliercarcinoom met een BRAF-V600E-mutatie geeft combinatiebehandeling met dabrafenib en trametinib een responskans van 56% (95%-BI: 38,1-72,1) met een mediane responsduur van 14,4 maanden. Deze uitkomst voldoet aan de PASKWIL-criteria voor niet-gerandomiseerde studies voor een positief advies.
Dit advies is tot stand gekomen op basis van de uitkomsten van niet-gerandomiseerd onderzoek. De kwaliteit van het bewijs is matig. Het is mogelijk dat met verder onderzoek de schatting van de grootte van het effect van de behandeling zal veranderen.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Kebebew E, Greenspan FS, Clark OH, et al.: Anaplastic thyroid carcinoma. Treatment outcome and prognostic factors. Cancer 2005;103(7):1330-5.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM): Combinatiebehandeling met dabrafenib en trametinib bij niet-resectabel of gemetastaseerd melanoom. Med Oncol 2016;19(1):39-42.
- Planchard D, Smit EF, Groen HJ et al. Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 2017;18(10):1307-16.
- McFadden DG, Vernon A, Santiago PM et al: p53 constrains progression to anaplastic thyroid carci nomain aBRAF-mutant mouse model of papillary thyroid cancer. Proc Natl Acad Sci USA 2014;111(16):E1600-9.
- Subbiah V, Kreitman RJ, Wainberg ZA et al. Dafrafenib plus trametinib in BRAF V600E-mutated rare cancer: the phase 2 ROAR trial. Nat Med 2023;29(5):1103-12.
- Subbiah V, Kreitman RJ, Wainberg ZA et al. Dafrafenib and trametinib treatment in patients with locally advanced of metastatic BRAF V600E-mutant anaplastic thyroid cancer. J Clin Oncol 2018;36(1):7-13.
- Subbiah V, Kreitman RJ, Wainberg ZA et al. Dafrafenib plus trametinib in patients with BRAF V600E-mutant anaplastic thyroid cancer: updated analysis from the phase II ROAR basket study. Ann Oncol 2022;33(4):406-15.