
Inleiding
Jaarlijks wordt bij ongeveer 1300 volwassenen in Nederland een glioom gediagnosticeerd.1 Gliomen breiden zich uit in het omliggende hersenweefsel, hetgeen de behandeling bemoeilijkt. Gliomen worden onderverdeeld volgens de classificatie van de Wereldgezondheidsorganisatie (WHO), waarbij bij WHO-graad 1 en 2 sprake is van een laaggradig glioom en bij graad 3 en 4 van een hooggradig glioom.2 De prognose van het glioom is afhankelijk van de WHO-gradering, met een 1-jaars overleving van 90% bij graad 2 glioom en 40% bij graad 4 glioom. Bij het laaggradig glioom kan afhankelijk van klinische en moleculaire factoren een initieel afwachtend beleid, resectie, moleculair gerichte behandeling en radiotherapie gevolgd door chemotherapie toegepast worden. Bij het glioblastoom, de meest voorkomende vorm van het hooggradig glioom, bestaat de behandeling indien mogelijk uit resectie gevolgd door radiochemotherapie met temozolomide volgens het Stupp-schema.3 Ondanks therapie recidiveert de meerderheid van de gliomen waarbij lokale behandeling of systemische therapie, bijvoorbeeld in de vorm van temozolomide bij hooggradig glioom, toegepast kan worden. Nadien zijn de behandelopties beperkt.
Bij 5-15% van de laaggradige gliomen en bij 3% van de glioblastomen is een BRAF-V600-mutatie aanwezig. Patiënten met een gemetastaseerd melanoom of longcarcinoom met een BRAF-V600E-mutatie kunnen behandeld worden met een combinatie van de BRAF-remmer dabrafenib en de MEK-remmer trametinib.4,5 Bij kinderen met een BRAF-gemuteerd glioom werd effectiviteit gezien van behandeling met dabrafenib en trametinib.6
De ROAR-studie is een eenarmige fase II-basketstudie waarin patiënten met een gemetastaseerde of gevorderde maligniteit met een BRAF-V600E-mutatie werden behandeld met dabrafenib en trametinib.7 De effectiviteit bij patiënten met een BRAF-gemuteerd laaggradig of hooggradig glioom werd separaat geanalyseerd.8 EMA heeft dabrafenib en trametinib niet beoordeeld voor het glioom bij volwassenen, maar wel goedkeuring verleend voor deze combinatie voor de behandeling van laaggradig of hooggradig glioom bij kinderen.
Kankersoort en lijn van behandeling
De combinatiebehandeling met dabrafenib en trametinib werd onderzocht bij patiënten met een laaggradig of hooggradig glioom met een BRAF-V600E-mutatie.
Onderbouwing voor een niet-gerandomiseerde studie
Zowel het laaggradig als het hooggradig glioom is een zeldzame vorm van kanker, waarbij bij een kleine subgroep sprake is van een BRAF-V600E-mutatie. Slechts een deel van de patiënten is na progressie op de standaardbehandeling geschikt voor en bereid tot vervolgtherapie. Vanwege de lage incidentie wordt de uitvoering van een gerandomiseerde fase III-studie niet als haalbaar ingeschat. Vanwege het ontbreken van behandelopties bij progressie op standaardbehandeling is er sprake van een unmet medical need.
Methoden van de studie
De ROAR-studie is een eenarmige open-label fase II-studie voor patiënten met een maligniteit met een BRAF-V600E-mutatie. Patiënten werden geïncludeerd in 1 van de cohorten voor de verschillende tumortypes: anaplastisch schildkliercarcinoom, glioom (laaggradig of hooggradig), dunnedarmkanker, hairy cell-leukemie, multipel myeloom, galwegcarcinoom, kiemceltumoren (non-seminoom of non-germinoom), of gastro-intestinale stromale tumor. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn, een ECOG-performancestatus van 0-2 te hebben en een histologisch bevestigd laaggradig (graad 1 of 2) of hooggradig (graad 3 of 4) glioom te hebben, vastgesteld volgens de WHO 2007-classificatie. Er moest sprake zijn van meetbare ziekte volgens de Response Assessment in Neuro-Oncology (RANO)-criteria.9,10 In de tumor moest een BRAF-V600E-mutatie zijn vastgesteld in een lokaal laboratorium of in een centraal laboratorium middels de THxID-BRAF-kit. Er moest weefsel beschikbaar zijn voor centrale bevestiging.
Er was een cohort voor patiënten met een hooggradig glioom en een cohort voor patiënten met een laaggradig glioom. Patiënten met een glioom graad 1 dienden symptomen te hebben waardoor behandeling noodzakelijk was en waarvoor geen zinvolle alternatieven waren volgens een centraal panel. Patiënten met een glioom graad 2 dienden een contra-indicatie voor behandeling met chemotherapie te hebben. Patiënten met een hooggradig glioom dienden eerder behandeld te zijn met radiotherapie gevolgd door temozolomide of radiochemotherapie. Eerdere behandeling met een BRAF- of een MEK-remmer was niet toegestaan en radiotherapie was niet toegestaan in de 3 maanden voorafgaand aan inclusie.
De behandeling bestond uit dabrafenib 150 mg tweemaal daags en trametinib 2 mg eenmaal daags oraal ingenomen en werd gecontinueerd tot ziekteprogressie of onacceptabele toxiciteit. Dosisreductie of onderbreken van therapie was toegestaan. Het primaire eindpunt was het percentage patiënten met een door de lokale onderzoeker vastgestelde objectieve respons (ORR) volgens de RANO-criteria, gedefinieerd als complete of partiële respons voor hooggradige gliomen en als complete, partiële of beperkte respons voor laaggradige gliomen. De respons werd achteraf centraal en onafhankelijk bevestigd. Secundaire eindpunten waren duur van de respons (DoR), overleving (OS), progressievrije overleving (PFS) en veiligheid. Kwaliteit van leven werd niet gemeten. Beeldvorming middels MRI-hersenen werd bij inclusie verricht, daarna elke 8 weken gedurende 48 weken en daarna elke 3 maanden tot progressie.
Door een adaptief statistisch model kon de effectiviteit separaat in de verschillende cohorten van de ROAR-studie worden geanalyseerd met uitwisselen van informatie tussen de cohorten waardoor de alfa kon worden gecontroleerd. Voor ieder cohort werd een specifieke aanname gedaan over de ORR van de historische controle en over wat een klinisch relevante verbetering zou zijn. De alfa en de power waren afhankelijk van de homogeniteit in uitkomsten tussen de verschillende cohorten. Elke 12 weken werd een analyse voor futiliteit en effectiviteit verricht en de maximale grootte van elk cohort was 25 patiënten.
Effectiviteit kon per cohort worden vastgesteld na inclusie van ten minste 10 patiënten als de achteraf kans dat de ORR hoger was dan de historische controle ten minste 95% was. De primaire analyse vond plaats nadat alle patiënten in het cohort hun behandeling hadden beëindigd, of ten minste 8 maanden waren behandeld. Voor de cohorten patiënten met hooggradig en laaggradig glioom was de ORR van de historische controle op 10% verondersteld en werd een ORR van 50% als klinisch relevante verbetering beschouwd.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen
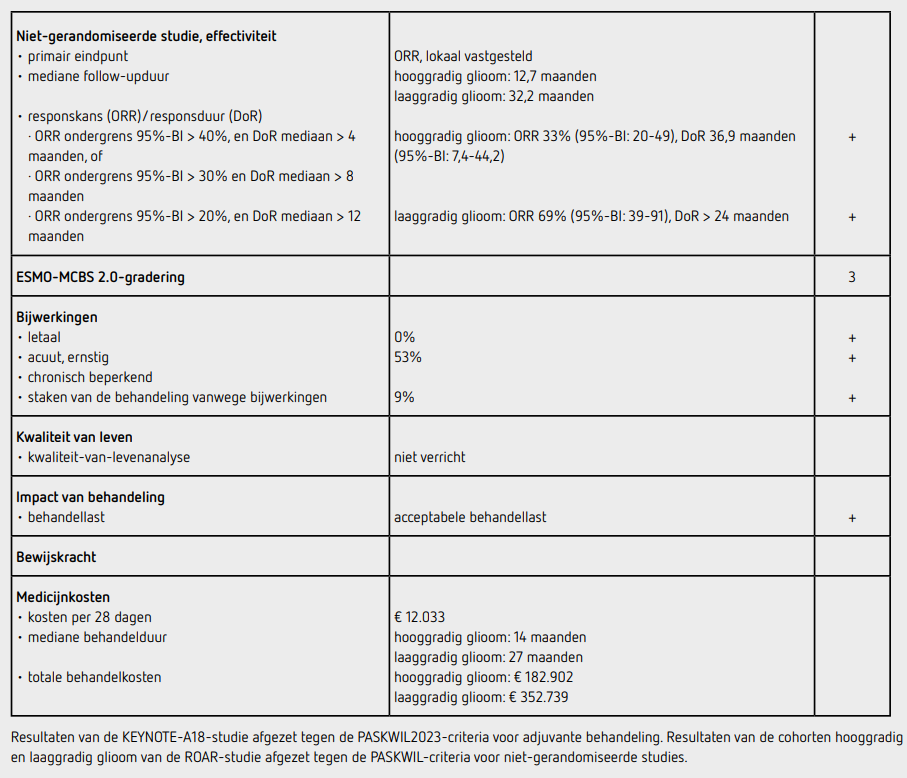
Tussen april 2014 en juli 2018 werden 206 patiënten met een BRAF-V600E-gemuteerde maligniteit geïncludeerd. Het cohort patiënten met hooggradig glioom bestond uit 45 patiënten, waarvan 24 patiënten in het cohort voor primaire analyse werden geïncludeerd en 21 patiënten in het expansiecohort. De mediane leeftijd was 42 jaar, de helft was man en de mediane tijd sinds diagnose was 1,4 jaar. Bij 93% van de patiënten kon de BRAF-mutatie centraal worden bevestigd, 69% had een glioblastoom, 93% had resectie van de tumor ondergaan en 93% had ten minste 1 lijn chemotherapie gehad. De mediane follow-upduur was 12,7 maanden. De lokaal vastgestelde ORR bij patiënten met hooggradig glioom was 33% (95%-BI: 20-49) met een mediane DoR van 36,9 maanden (95%-BI: 7,4-44,2).
Van de 15 patiënten met een respons hadden 3 een complete en 12 een partiële respons. Bij centrale beoordeling was de ORR 31% (95%- BI: 18-47) met een mediane DoR van 13,6 maanden (95%-BI: 4,6-43,4). De mediane PFS was 3,8 maanden (95%-BI: 1,8-9,2) en de mediane OS was 17,6 maanden (95%-BI: 9,5-45,2). Voor zover subgroepen betrouwbaar te evalueren zijn bij dergelijke kleine aantallen lijken de 22 patiënten jonger dan 40 jaar een betere ORR te hebben dan de 23 patiënten van 40 jaar en ouder (respectievelijk 50% en 17%).
Er waren 13 patiënten met een laaggradig glioom geïncludeerd. De mediane leeftijd was 33 jaar en een derde was man. De helft van de patiënten had een graad 1 glioom en bij 62% kon de BRAF-mutatie centraal bevestigd worden. De mediane tijd sinds diagnose bedroeg bijna 7 jaar. 92% had resectie van de tumor ondergaan, 62% was bestraald en 38% had eerdere chemotherapie ontvangen. De mediane follow-upduur was 32,2 maanden. De lokaal vastgestelde ORR bij patiënten met laaggradig glioom was 69% (95%-BI: 39-91) met een mediane DoR die niet bereikt was (95%-BI: 5,5 maanden-niet bereikt). Na 24 maanden had 56% van de patiënten een voortdurende respons. Van de 9 patiënten met een respons had 1 een complete, 6 een partiële en 2 een beperkte respons. Bij centrale beoordeling was de ORR gelijk aan de lokale beoordeling met een mediane DoR van 27,5 maanden (95%-BI: 3,8-39,5). De mediane PFS (95%-BI: 7,4 maanden-niet bereikt) en OS (95%-BI: 11,6 maanden-niet bereikt) waren niet bereikt.
Bijwerkingen van graad 3 of 4 kwamen voor bij 31 van de 58 patiënten (53%), alle met een incidentie lager dan 10%. Tijdens de behandeling is 1 patiënt overleden aan algehele klinische achteruitgang, hetgeen werd beschouwd als niet gerelateerd aan de behandeling. Bij 22 patiënten (38%) en 24 patiënten (41%) had dosisreductie of uitstel van behandeling vanwege bijwerkingen plaatsgevonden en bij 5 patiënten (9%) werd de behandeling vanwege bijwerkingen gestaakt. In de totale groep van 206 patiënten in de ROAR-studie kwamen bijwerkingen van graad 3 of 4 voor bij 122 patiënten (59%).
Na progressie op dabrafenib en trametinib kregen 18 patiënten (40%) met hooggradig glioom een vervolgbehandeling: 9 (20%) kregen radiotherapie, 7 (16%) resectie en 14 (31%) een vorm van systemische therapie, meestal bevacizumab of lomustine. 4 patiënten met laaggradig glioom (31%) kregen een vervolgbehandeling: alle 4 kregen radiotherapie, 3 een resectie en 3 een vorm van systemische therapie.
Kwaliteit van de studie en interpretatie van de uitkomsten
De bewijskracht van de studie is beperkt vanwege de nietgerandomiseerde opzet. De ROAR-studie is een basketstudie waarbij diverse tumortypen in verschillende cohorten werden geïncludeerd. Hierdoor kon met beperkte aantallen per cohort een adequate power worden bereikt. Het cohort patiënten met een hooggradig glioom bestond uit het primaire cohort en een expansiecohort. De resultaten voor het primaire cohort zijn niet separaat vermeld, alleen de resultaten van beide cohorten samen. We moeten dus aannemen dat de resultaten van het primaire cohort voldeden aan de vooraf gestelde grenzen voor effectiviteit.
Voor deelname aan de studie was de aanwezigheid van geschikt materiaal voor centrale bevestiging van de BRAF-V600E-mutatie vereist, maar de bevestiging zelf was niet vereist. Met name in de groep met laaggradig glioom kon bij een aanzienlijk deel van de tumoren de BRAF-mutatie niet centraal bevestigd worden (negatief of niet beoordeelbaar). Het aantal patiënten in de groep met een laaggradig glioom was laag maar voldoende om te voldoen aan de grenzen voor effectiviteit en het sluiten van het cohort. Hierdoor zijn de betrouwbaarheidsintervallen wijd, resulterend in een onzekerheid van het geschatte effect.
De RANO-criteria zijn de gouden standaard voor het vaststellen van respons bij hersentumoren. Desondanks blijft respons bij hersentumoren lastig vast te stellen, blijkend uit de discrepantie tussen lokaal en centraal vastgestelde responsduur bij hooggradige gliomen. Omdat lokaal vastgestelde respons het primaire eindpunt van de studie was, worden deze getallen gebruikt bij de beoordeling.
Discussie
De combinatie van dabrafenib en trametinib laat bij patiënten met een hooggradig glioom en een BRAF-V600E-mutatie een ORR zien van 33% (95%-BI: 20-49) met een mediane DoR van 36,9 maanden (95%-BI: 7,4-44,2). Deze uitkomsten voldoen aan de PASKWIL-criteria voor niet-gerandomiseerde studies voor een positief advies. Ook de resultaten bij patiënten met een laaggradig glioom en een BRAF-V600E-mutatie voldoen met een ORR van 69% (95%-BI: 39-91) en een mediane responsduur langer dan 24 maanden aan de PASKWIL-criteria voor nietgerandomiseerde studies voor een positief advies. Er heeft geen EMA-beoordeling voor deze indicatie plaatsgevonden voor volwassenen en de verwachting is ook niet dat dat binnenkort gaat gebeuren.
De ORR-winst bij patiënten met een hooggradig glioom lijkt meer uitgesproken bij de patiënten jonger dan 40 jaar, hoewel dit een post-hoc-analyse betreft waaraan geen conclusies verbonden kunnen worden. De mediane OS is met name bij de patiënten met hooggradig glioom een stuk langer dan verwacht op basis van de beschikbare literatuur.
Waarschijnlijk is dit deels het gevolg van een selectie van patiënten met een gunstiger prognose, omdat de mediane tijd sinds diagnose bij inclusie al langer is dan de mediane OS. Als deze behandeling tot vergoede zorg in Nederland leidt, zal bepaling van de BRAF-V600E-mutatiestatus plaats dienen te vinden bij patiënten met een hooggradig glioom en recidief na resectie en radiochemotherapie en bij patiënten met een laaggradig glioom bij recidief na resectie en de aanwezigheid van een behandelindicatie. Patiënten met een BRAF-non-V600Emutatie hebben niet deelgenomen aan deze studie en voor deze patiënten is dus geen uitspraak te doen over de effectiviteit van dabrafenib en trametinib. De behandeling met dabrafenib en trametinib wordt over het algemeen goed verdragen. Door de lange behandelduur is deze behandeling met name bij patiënten met een laaggradig glioom zeer kostbaar.
Kosten
Behandeling met dabrafenib kost 5.925 euro en met trametinib kost 6.108 euro per cyclus van 28 dagen (bron: medicijnkosten.nl d.d. september 2025). De totale kosten voor de behandeling van hooggradig glioom met een mediane behandelduur van 14 maanden bedragen 182.902 euro en bij een laaggradig glioom met een mediane behandelduur van 27 maanden is dit 352.739 euro.
Conclusie
Bij patiënten met een hooggradig glioom en een BRAF-V600E-mutatie geeft combinatiebehandeling met dabrafenib en trametinib een responskans van 33% (95%-BI: 20-49) met een mediane responsduur van 36,9 maanden. Bij patiënten met een laaggradig glioom en een BRAF-V600E-mutatie geeft combinatiebehandeling met dabrafenib en trametinib een responskans van 69% (95%-BI: 39-91) met een responsduur langer dan 24 maanden. De resultaten van beide cohorten voldoen aan de PASKWIL-criteria voor niet-gerandomiseerde studies voor een positief advies.
Dit advies is tot stand gekomen op basis van de uitkomsten van niet-gerandomiseerd onderzoek. De kwaliteit van het bewijs is matig. Het is mogelijk dat met verder onderzoek de schatting van de grootte van het effect van de behandeling zal veranderen.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Louis DN, Perry A, Wesseling P et al. The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro Oncol 2021;23(8):1231-51.
- Stupp R, Mason WP, Van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New Engl J Med 2005;352(10):987-96.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM): Combinatiebehandeling met dabrafenib en trametinib bij niet-resectabel of gemetastaseerd melanoom. Med Oncol 2016;19(1):39-42.
- Planchard D, Smit EF, Groen HJ et al. Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 2017;18(10):1307-16.
- Bouffet E, Hansford JR, Garrè ML et al. Dabrafenib plus Trametinib in pediatric glioma with BRAF V600 Mutations. New Engl J Med 2023;389(12):1108-20.
- Subbiah V, Kreitman RJ, Wainberg ZA et al. Dafrafenib plus trametinib in BRAF V600E-mutated rare cancer: the phase 2 ROAR trial. Nat Med 2023;29(5): 1103-12.
- Wen PY, Stein A, van den Bent M et al. Dabrafenib plus trametinib in patients with BRAFV⁶⁰⁰E-mutant low-grade and high-grade glioma (ROAR): a multicentre, openlabel, single-arm, phase 2, basket trial. Lancet Oncol 2022;23(1):53-64.
- Wen PY, Macdonald DR, Reardon DA et al. Updated response assessment criteria for highgrade gliomas: response assessment in neurooncology working group. J Clin Oncol 2010;28(11): 1963-72.
- Van den Bent MJ, Wefel JS, Schiff D et al. Response assessment in neurooncology (a report of the RANO group): assessment of outcome in trials of diffuse lowgrade gliomas. Lancet Oncol 2011;12(6):583-93.