
1. Inleiding
RET-fusies komen voornamelijk voor bij long- en schildklierkanker, maar zijn in zeer zeldzame gevallen ook aanwezig bij andere tumoren. RET-veranderingen (mutatie of fusie) komen met een prevalentie van minder dan 1-2 procent voor bij onder andere paraganglioom, colorectaal-, mamma-, urotheelcel-, ovarium- en pancreascarcinoom.
Selpercatinib is een selectieve RET-kinaseremmer die de bloedhersenbarrière passeert en werkzaamheid heeft getoond bij patiënten met RET-geactiveerde tumoren.2 cieBOM heeft selpercatinib eerder een voorlopig positief advies gegeven voor RET-gemuteerd schildkliercarcinoom3 en RET-fusiepositief gemetastaseerd niet-kleincellig longcarcinoom (NSCLC).4
In de hier te bespreken LIBRETTO-001-studie werd de effectiviteit van selpercatinib onderzocht bij patiënten met een RET-fusiepositieve, gevorderde of gemetastaseerde solide tumor. De eerste gegevens werden gepubliceerd in 2022.5 In januari 2024 werd op het ASCO GI Cancers Symposium een poster gepresenteerd met meer patiënten en een langere follow-up van deze studie.6 Selpercatinib is door EMA voorwaardelijk geregistreerd in de tumoragnostische setting voor de behandeling van volwassenen met een RET-fusiepositieve gevorderde of gemetastaseerde solide tumor bij wie geen andere behandelopties zijn.
2. Kankersoort en lijn van behandeling
Selpercatinib werd onderzocht bij patiënten met een lokaal gevorderde of gemetastaseerde RET-fusiepositieve solide tumor, met uitzondering van long- en schildkliercarcinoom, met ziekteprogressie na eerdere systemische therapie of bij wie geen zinvolle systemische therapie aanwezig was.
3. Onderbouwing voor een niet-gerandomiseerde studie
RET-fusiepositieve solide tumoren zijn zeldzaam. Het meest voorkomend is deze RET-verandering (mutatie of fusie) in het long- en het schildkliercarcinoom. Voor deze beide patiëntengroepen is het mogelijk gebleken een gerandomiseerde studie te doen.7,8 In andere tumoren is deze RET-verandering zo zeldzaam dat een gerandomiseerde fase II- of III-studie als niet haalbaar beschouwd wordt.
In de LIBRETTO-001-studie werd selpercatinib ingezet als reguliere behandelopties uitgeput waren. Behandelingen die ingezet kunnen worden, zijn afhankelijk van het tumortype. De biologische rationale voor de werking van de behandeling is sterk en de populatie patiënten is betrouwbaar en reproduceerbaar te selecteren op basis van de RET-fusiebepaling. Selpercatinib is reeds bewezen effectief gebleken in het NSCLC en het schildkliercarcinoom waarbij een RET-verandering (mutatie of fusie) vaker voorkomt.
4. Methode en kwaliteit van de studie
De LIBRETTO-001-studie (NCT03157128) is een fase I/ II-multicenterstudie waarin patiënten met een gevorderde of gemetastaseerde solide tumor met een RET-verandering (mutatie of fusie) werden behandeld met selpercatinib. Patiënten met NSCLC en schildkliercarcinoom zijn separaat geanalyseerd en worden hier buiten beschouwing gelaten. Om voor inclusie in aanmerking te komen dienden patiënten 12 jaar of ouder te zijn en een ECOG-performancestatus van 0-2 te hebben. Daarnaast was adequate orgaanfunctie en een gecorrigeerde QT-tijd van ≤ 470 ms vereist. Patiënten mochten voorbehandeld zijn met meerdere lijnen therapie inclusief multi-targeted kinaseremmers en er mochten geen zinvolle andere systemische opties voorhanden zijn. Patiënten die eerder een selectieve RET-remmer hadden gebruikt mochten niet deelnemen. Vereist was een prospectief vastgestelde RET-mutatie of fusie met behulp van next generation sequencing, fluorescentie in-situhybridisatie of polymerasekettingreactie, uitgevoerd in een gecertificeerd centrum. Ook moest er sprake zijn van meetbare ziekte volgens RECIST 1.1.
Patiënten in het dosisescalatiegedeelte van de fase I-studie kregen selpercatinib in oplopende doseringen van 20 mg eenmaal daags tot 240 mg tweemaal daags. In fase I bestond de mogelijkheid de dosering binnen patiënten te verhogen. Patiënten die deelnamen aan het fase II-deel van de studie kregen de aanbevolen dosis van 160 mg tweemaal daags. Patiënten met gedocumenteerde ziekteprogressie mochten doorgaan met selpercatinib als ze klinisch voordeel hadden.
Het primaire eindpunt was het percentage patiënten met een objectieve respons (ORR), bevestigd middels een tweede meting en centraal en onafhankelijk bepaald. Secundaire eindpunten waren onder andere progressievrije overleving (PFS), duur van de respons (DoR) en veiligheid. Kwaliteit van leven werd niet gemeten. Een CT-scan voor evaluatie werd in het eerste jaar elke 8 weken uitgevoerd, daarna elke 12 weken. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.03.
Volgens het statistische analyseplan bestond de geplande omvang van de patiëntengroep voor deze vooraf gespecificeerde analyse uit ongeveer 40 patiënten uit fase I en fase II met een gedocumenteerde RET-fusiepositieve tumor die ten minste 1 dosis selpercatinib had gekregen op 24 maart 2021. Uitgaande van een ORR van 40 procent, werd met deze geplande omvang van de patiëntengroep een 79 procent power ingeschat om met een tweezijdige alfa van 5 procent de nulhypothese te verwerpen dat het werkelijke objectieve responspercentage 20 procent of lager was.
De tumoragnostische populatie werd gedefinieerd als patiënten met een RET-fusiepositieve solide tumor, anders dan long- of schildkliercarcinoom, die minstens 6 maanden follow-up hadden na de eerste dosis selpercatinib. De data gepresenteerd op een poster tijdens het ASCO GI Cancers Symposium met meer patiënten en een langere follow-up zijn gebruikt voor dit rapport.6
5. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Vanaf december 2017 werden 55 patiënten in de studie geïncludeerd. In totaal werden 52 patiënten in de analyse voor effectiviteit meegenomen. Drie patiënten werden niet meegenomen omdat ze korter dan 6 maanden voor de data-cutoff op 13 januari 2023 geïncludeerd waren.
Het betrof 52 patiënten met 16 verschillende tumortypen, namelijk pancreascarcinoom (13 patiënten), colorectaal carcinoom (13 patiënten), speekselkliercarcinoom (4 patiënten), cholangiocarcinoom (3 patiënten), sarcoom (3 patiënten), primaire tumor onbekend (3 patiënten), mammacarcinoom (2 patiënten), huidcarcinoom (2 patiënten), xanthogranuloom (2 patiënten) en per tumortype 1 patiënt met rectale neuro-endocriene tumor, dunnedarmcarcinoom, carcinoïd, neuro-endocrien carcinoom, ovariumcarcinoom, pulmonaal carcinosarcoom en kleincellig longcarcinoom.
Er werd een variatie aan RET-fusiepartners gezien waarbij NCOA4 de meest voorkomende was (18 patiënten; 34,6 procent), met daarna CCDC6 (9 patiënten; 17,3 procent) en KIF5B (6 patiënten; 11,5 procent). Andere fusiepartners kwamen bij minder dan 10 procent voor.
De mediane leeftijd van de patiënten was 54 jaar en de helft was man. Meer dan 90 procent van de patiënten had een ECOG-performancestatus van 0 of 1 en had eerdere systemische behandeling ondergaan, waarbij ruim een kwart van de patiënten 3 of meer eerdere lijnen therapie had gekregen. Dit was met name chemotherapie. Een kleine 10 procent van de patiënten had eerder een multi-targeted kinaseremmer ontvangen.
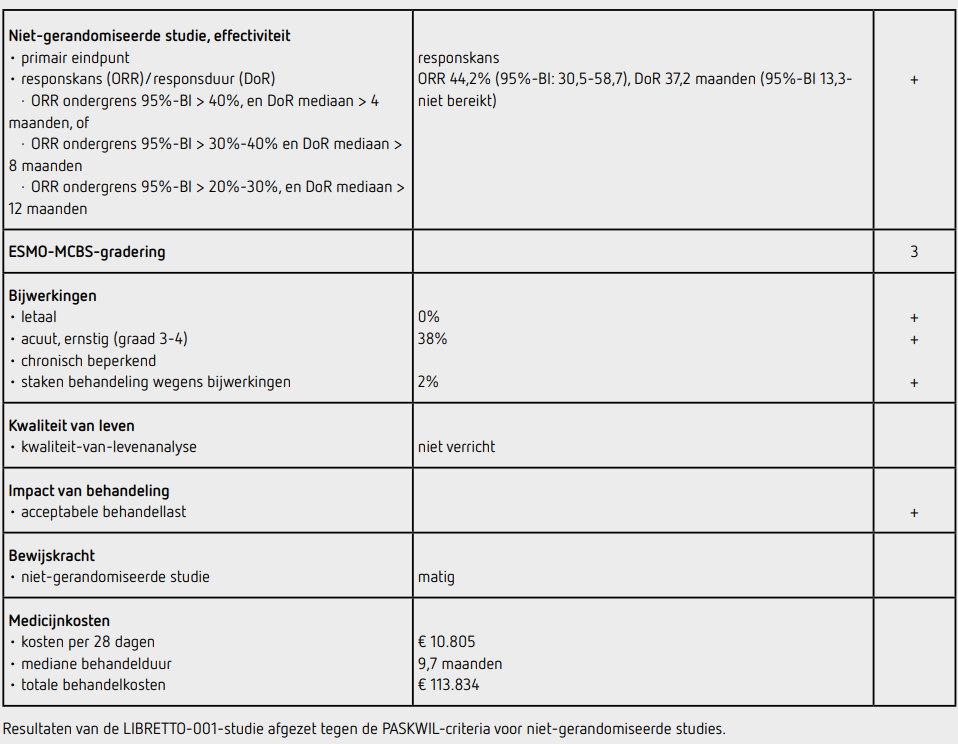
51 van de 52 patiënten kregen de aanbevolen dosis selpercatinib van 160 mg tweemaal daags, 1 patiënt kreeg een startdosis van 120 mg tweemaal daags en heeft nooit een dosisescalatie gekregen. Van de 52 patiënten waren 45 patiënten evalueerbaar voor respons. Zeven patiënten werden niet meegenomen in de analyses omdat ze alleen non-target laesies hadden of geen responsmeting hadden voor onafhankelijke beoordeling. De ORR was 44,2 procent (95%-BI: 30,5-58,7). De mediane DoR was 37,2 maanden (95%-BI: 13,3-niet bereikt) bij een mediane follow-upduur van 29 maanden. Responsen werden gezien in meerdere tumortypes en werden gezien in alle tumortypes waarbij 2 of meer patiënten geïncludeerd waren (pancreascarcinoom, colorectaal carcinoom, speekselkliercarcinoom, cholangiocarcinoom, sarcoom, primaire tumor onbekend, mammacarcinoom en huidkanker) en in 4 van de 7 tumortypes waar maar 1 patiënt geïncludeerd was (dunnedarmcarcinoom, carcinoïd, neuro-endocrien carcinoom en ovariumcarcinoom).
De 2 patiënten met xanthogranuloom en de patiënt met pulmonaal carcinosarcoom waren niet evalueerbaar voor respons. Responsen waren onafhankelijk van de RET-fusiepartner. Complete responsen werden gezien in 3 patiënten (5,8 procent). De mediane PFS was 13,2 maanden (95%-BI: 5,6-26,6), bij een mediane follow-upduur van 25 maanden. De mediane OS was 18,0 maanden (95%-BI: 10,7-39,2) bij een mediane follow-upduur van 33 maanden.
De mediane behandelduurduur was 9,7 maanden (range 0,6-59,7). Voor het beschrijven van de bijwerkingen wordt uitgegaan van de eerste analyse in 45 patiënten.5 Behandelingsgerelateerde bijwerkingen van graad 3 of hoger kwamen voor bij 17 patiënten (38 procent). De belangrijkste waren verhoogd ALAT bij 7 patiënten (16 procent), verhoogd ASAT bij 5 patiënten (11 procent) en hypertensie bij 6 patiënten (13 procent). Tijdens de behandeling zijn 3 patiënten (7 procent) overleden, waarvan bij geen van de overlijdens een relatie met de behandeling werd verondersteld.
Bij 14 patiënten (31 procent) had dosisreductie vanwege bijwerkingen plaatsgevonden en bij een patiënt (2 procent) was de behandeling vanwege bijwerkingen gestaakt. De bijwerkingen gezien in deze studie waren vergelijkbaar met die in andere studies met selpercatinib.
6. Discussie
Selpercatinib is door de EMA voorwaardelijk geregistreerd in de tumoragnostische setting voor de behandeling van volwassenen met lokaal gevorderd of gemetastaseerd RET-fusiepositieve solide tumoren met ziekteprogressie na eerdere systemische therapie of waarvoor geen zinvolle systemische therapie aanwezig is. Er is al een voorlopig positief cieBOM-advies voor selpercatinib bij RET-gemuteerd medullair schildkliercarcinoom en RET-fusiepositief gemetastaseerd NSCLC.
Om voor beoordeling volgens NRS-criteria in aanmerking te komen moet de behandelindicatie voor het betreffende middel zeldzaam en goed definieerbaar zijn, en moet het niet haalbaar zijn om een fase III-studie uit te voeren. Dit is het geval bij RET-fusie positieve tumoren met uitzondering van het schildkliercarcinoom en het NSCLC.
In de fase I/II-studie LIBRETTO-001 werd voor patiënten met gemetastaseerde RET-fusiepositieve solide tumoren een ORR van 44,2 procent (95%-BI: 30,5-58,7) gezien bij behandeling met selpercatinib. Deze uitkomsten voldeden aan de tevoren vastgestelde grenzen voor klinische relevantie. De mediane responsduur was 37,2 maanden (95%-BI: 13,3-niet bereikt).
Deze uitkomsten voldoen aan de PASKWIL-criteria voor nietgerandomiseerde studies voor een voorlopig positief advies vanwege de voorwaardelijke EMA-goedkeuring. De bijwerkingen van de behandeling lijken hanteerbaar en weinig patiënten hoeven de behandeling te staken vanwege bijwerkingen.
De ESMO heeft recent de ESMO Tumour-Agnostic Classifier and Screener (ETAC-S) gepubliceerd die handvatten geeft over minimale voorwaarden om medicijnen te identificeren met tumoragnostische mogelijkheden.9 De ETAC-S benoemt als minimale voorwaarden: 1) robuust preklinisch mechanistisch bewijs, gecombineerd met 2) prospectief klinisch bewijs uit fase I/II-studies met een ORR van ten minste 20 procent in twee derde van de onderzochte tumortypes (en totaal in ten minste 4 tumortypes) met ten minste 5 evalueerbare patiënten per tumortype met therapierefractaire ziekte. In het geval van selpercatinib kunnen we concluderen dat aan deze punten voldaan is. De ORR is ten minste 20 procent in ten minste tweederde van de tumortypes, namelijk in 14 van de 18 (78 procent) en in 4 of meer tumortypes waarbij 5 of meer evalueerbare patiënten per tumortype zijn onderzocht, namelijk een ORR van 84 procent bij 129 patiënten met NSCLC in de LIBRETTO-431-studie8 , een ORR van 69 procent voor 193 patiënten met medullair schildkliercarcinoom in de LIBRETTO-531-studie7 , een ORR van 54 procent voor 13 patiënten met pancreascarcinoom in de LIBRETTO-001-studie en een ORR 31 procent voor 13 patiënten met colorectaal carcinoom in dezelfde LIBRETTO-001-studie.5,6 Daarmee lijkt een tumoragnostische indicatie voldoende onderbouwd.
7. Kosten
De behandeling met selpercatinib kost per 4 weken bij gebruik van 2 maal daags 160 mg 10.805 euro (bron: medicijnkosten.nl d.d. december 2024). Bij een mediane behandelduur van 9,7 maanden komen de totale kosten voor deze behandeling uit op 113.834 euro.
8. Conclusie
Bij patiënten met lokaal gevorderde of gemetastaseerde RET-fusiepositieve solide tumoren, met uitzondering van NSCLC en schildkliercarcinoom, met ziekteprogressie na eerdere systemische therapie of waarvoor geen zinvolle systemische therapie aanwezig is, geeft behandeling met selpercatinib responskans van 44,2 procent (95%-BI: 30,5-58,7) met een mediane responsduur van 37,2 maanden (95%-BI: 13,3-niet bereikt) en een mediane PFS van 13,2 maanden (95%-BI: 5,6 26,2).
Deze uitkomst voldoet aan de PASKWIL-criteria voor nietgerandomiseerde studies voor een voorlopig positief advies vanwege de voorwaardelijke EMA-goedkeuring. Dit advies is tot stand gekomen op basis van de uitkomsten van niet-gerandomiseerd onderzoek. De kwaliteit van het bewijs is matig. Het is waarschijnlijk dat met verder onderzoek de schatting van de grootte van het effect van de behandeling zal veranderen.
Referenties
- Kato S, Subbiah V, Marchlik E, et al. RET Aberrations in diverse cancers: next-generation sequencing of 4,871 patients. Clin Cancer Res 2017;23(8):1988-97.
- Clark L, Fisher G, Brook S, et al. Selective RET inhibitors (SRIs) in cancer: A journey from multi-kinase inhibitors to the next generation of SRIs. Cancers (Basel) 2023;16(1):31.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Selpercatinib als eerstelijnsbehandeling bij gemetastaseerd RET-gemuteerd medullair schildkliercarcinoom. Med Oncol 2024;27(4):33-6.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Selpercatinib als eerstelijnsbehandeling bij gemetastaseerd RET-fusiepositief niet-kleincellig longcarcinoom. Med Oncol 2024;27(4):28-31.
- Subbiah V, Wolf J, Konda B, et al. Tumour-agnostic efficacy and safety of selpercatinib in patients with RET fusion-positive solid tumours other than lung or thyroid tumours (LIBRETTO-001): a phase 1/2, open-label, basket trial. Lancet Oncol 2022;23(10):1261-73.
- Subbiah V, Drilon AE, Sukrithan V, et al. Durable efficacy of selpercatinib in patients with RET fusion+ solid tumors, with a focus on GI tumors: LIBRETTO-001. Journal of Clinical Oncology, Volume 42, Number 3_suppl, doi.org/10.1200/JCO.2024.42.3_ suppl.746. ASCO GI 2024.
- Hadoux J, Elisei R, Brose MS, et al. Phase 3 trial of selpercatinib in advanced RET-mutant medullary thyroid cancer. N Engl J Med 2023;389(20):1851-61.
- Zhou C, Solomon B, Loong HH, et al. First-line selpercatinib or chemotherapy and pembrolizumab in RET fusion-positive NSCLC. N Engl J Med 2023;389(20):1839-50.
- Westphalen CB, Martins-Branco D, Beal JR, et al. The ESMO Tumour-Agnostic Classifier and Screener (ETAC-S): a tool for assessing tumour-agnostic potential of molecularly guided therapies and for steering drug development. Ann Oncol 2024;35(11):936-53.