Jaarlijks wordt in Nederland bij bijna 13.000 patiënten de diagnose niet-kleincellig longcarcinoom (NSCLC) gesteld. Bij diagnose komt meer dan 40 procent van de patiënten niet meer in aanmerking voor een curatieve behandeling. Daarnaast krijgt 40 tot 50 procent van de patiënten die eerder in opzet curatief zijn behandeld in de loop van de tijd afstandsmetastasen.1 Ongeveer 3 procent van de patiënten heeft bij diagnose een alteratie in het mesenchymaal-epitheliale-transitiefactor (MET)-gen (een amplificatie of een MET exon 14 skipping-mutatie). Deze alteratie leidt tot een activering van de oncogenese. MET-alteraties kunnen bij het NSCLC een primaire oncogene driver zijn, maar zijn ook een bekend resistentiemechanisme bij patiënten behandeld met een EGFRTKI. In exon 14 van het MET-gen kunnen puntmutaties, inserties of deleties plaatsvinden die alle leiden tot verkeerde splitsing waardoor er geen transcriptie van exon 14 meer plaatsvindt, de zogenaamde exon 14 skipping-mutatie (METex14).
Tepotinib is een selectieve, orale type 1b tyrosinekinaseremmer gericht op de exon 14 skipping-mutatie, met in eerdere studies klinisch effect bij patiënten met diverse tumorsoorten met een METex14-mutatie. In de hier te bespreken publicatie wordt de effectiviteit van tepotinib in een cohort van patiënten met een NSCLC en een METex14-mutatie beschreven.2 In maart 2022 werd een geüpdatete analyse op basis van een groter cohort patiënten beschreven.3
1. Kankersoort en lijn van behandeling
De in deze publicatie te bespreken studie betreft zowel de eerste-, tweede- als hogerelijns behandeling van patiënten met een gevorderd of gemetastaseerd NSCLC met een METex14 skipping-mutatie. Tepotinib is door EMA geregistreerd voor de behandeling van volwassenen met gevorderd niet-kleincellig longcarcinoom (NSCLC) met een METex14 skipping-mutatie als monotherapie na eerdere behandeling met immunotherapie en/of platinum-bevattende chemotherapie.
2. Onderbouwing voor een niet-gerandomiseerde studie
In Nederland was ten tijde van de start van de studie chemotherapie en/of immuuntherapie de standaard behandeling van het METex14 skipping-gemuteerd NSCLC. Er was geen andere doelgerichte therapie tegen METex14 skipping-gemuteerd NSCLC beschikbaar. Voor patiënten met een NSCLC en deze mutatie is er sprake van een unmet medical need. Voor deze indicatie is gelijktijdig ook een niet-gerandomiseerde fase II-studie met capmatinib gepubliceerd.4 Er liep een fase III-studie voor dezelfde patiëntencategorie waarin capmatinib in de tweede lijn wordt vergeleken met docetaxel, de GeoMETry-III-studie (NCT04427072). Deze studie is echter na 3 jaar gestopt met includeren op 25 juli 2023, nadat in 3 jaar slechts 22 van 90 beoogde patiënten geïncludeerd waren. Geconcludeerd kan worden dat in deze patiëntencategorie een gerandomiseerde fase III-studie niet haalbaar is.
3. Methode en kwaliteit van de studie
De VISION-studie is een internationale, single-arm, open-label fase II-studie. Cohort A bestond uit patiënten met een METex14-mutatie, cohort B uit patiënten met een MET-amplificatie en cohort C is een later gestart cohort met ook een METex14-mutatie, als validatie voor cohort A. In deze publicatie worden alleen de resultaten van cohort A beschreven.2
Om voor inclusie in aanmerking te komen, moesten patiënten ouder zijn dan 18 jaar en een gevorderd of gemetastaseerd NSCLC hebben met een METex14 skipping-mutatie. Er moest sprake zijn van een ECOG-performancestatus van 0 of 1, afwezigheid van een EGFR-mutatie of ALK-herschikking, en meetbare ziekte volgens RECIST 1.1. Een METex14 skipping-mutatie moest worden vastgesteld met next generation sequencing op circulerend vrij DNA (cfDNA, liquid biopsy) of RNA-analyse van verse of archiefweefselbiopten of allebei. Tot 2 eerdere lijnen van behandeling waren toegestaan. Hersenmetastasen waren toegestaan mits neurologisch stabiel en met een afgebouwde steroïddosering of indien de hersenmetastasen asymptomatisch en kleiner dan 1 cm in grootste diameter waren.
Tepotinib werd eenmaal daags gegeven in een tablet van 500 mg (waar 450 mg van het actieve bestandsdeel in zit), in cycli van 21 dagen. De behandeling werd voortgezet tot aan progressie, overlijden of onacceptabele toxiciteit. Responsmetingen door middel van CT- of MRI-scan vonden plaats voor start van de studie, en nadien elke 6 weken gedurende de eerste 9 maanden, en vervolgens om de 12 weken. Bij start van de studie was beeldvorming van de hersenen (CT- of MRI-scan) verplicht.
Bij hersenmetastasering werd deze ook bij elke responsmeting herhaald. Alle beeldvorming werd centraal en onafhankelijk beoordeeld volgens RECIST 1.1. Bijwerkingen werden geclassificeerd volgens de NCI-CTCAE v4.03. Kwaliteit van leven werd gemeten met de European Organization for Research and Treatment of Cancer Quality of Life Questionnaire aangevuld met de Lung Cancer Module (EORTC QLQ-LC 30 en 13), en met de EuroQol Group 5-Dimension 5-Level questionnaire (EQ-5D-5L), ook steeds elke 6 weken. Ook werd serieel bij baseline, in week 6 en in week 12 een cfDNA liquid biopsy gedaan voor het beoordelen van een moleculaire respons, met ofwel een complete respons (geen METex14 mutatie meer aantoonbaar) of majeure respons (> 75 procent maar < 100 procent afname van de mutatie).
Het primaire eindpunt van de studie was het objectieve respons percentage (ORR), bevestigd in een herhaling van de beeldvorming ten minste 4 weken na de vorige beeldvorming, centraal en onafhankelijk bepaald. Secundaire eindpunten waren het door de onderzoeker bepaalde ORR, responsduur (DoR), progressievrije overleving (PFS), algehele overleving (OS) en veiligheid. Effectiviteitsanalyse werd verricht nadat er ten minste 60 patiënten in zowel de liquid biopsy subgroep als de weefselbiopsie subgroep ten minste 9 maanden follow-up hadden gehad. Evaluatie was mogelijk indien er minstens 2 responsbeoordelingen hadden plaatsgevonden of indien deelname aan de studie was beëindigd (elke reden). De analyses werden verricht in drie groepen: alleen liquid biopsy, alleen weefselbiopt en de gecombineerde groep. In elk van deze groepen werd gestreefd naar een ORR van 40-50 procent, met een ondergrens van het tweezijdige 95 procent-betrouwbaarheidsinterval (Clopper-Pearson) van ten minste 20 procent voor alle behandellijnen. Voor het bepalen van de DoR, PFS en OS werd de Kaplan-Meier-methode gebruikt. Veiligheidsanalyse gebeurde in alle patiënten die ten minste 1 dosis tepotinib hadden gehad.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen september 2016 en januari 2020 werden 6.078 patiënten gescreend op MET-alteraties. Een METex14-mutatie werd bij 169 patiënten vastgesteld. Hiervan werden 152 patiënten behandeld met tepotinib (veiligheidsgroep), waarvan 99 patiënten ten minste 9 maanden follow-up (effectiviteitspopulatie) hadden. Deze 99 patiënten waren de gecombineerde diagnosegroep, 66 hadden een positieve liquid biopsy, 60 een positief weefselbiopt en 27 patiënten allebei. De mediane leeftijd van deze 99 patiënten was 74 jaar, 46 procent was (ex)roker, 75 procent was Kaukasisch, 78 procent had een performancestatus van 1, 90 procent had een adenocarcinoom en 11 procent had hersenmetastasen. 43 patiënten hadden nog geen eerdere behandeling ondergaan, 33 1 eerdere lijn en 23 2 of meer lijnen eerdere therapie. Eerdere therapie bestond uit chemotherapie en/of immuuntherapie, met een mediane PFS van 3 maanden. De karakteristieken waren vrijwel gelijk tussen de 3 groepen. De mediane follow-up in de effectiviteitspopulatie was 17,4 maanden, die in de veiligheidspopulatie 11,8 maanden. De mediane behandelduur met tepotinib was 6,9 maanden (< 0,1 tot 36,7 maanden).
In de effectiviteitspopulatie was de onafhankelijk bepaalde ORR 46 procent (95%-BI: 36%-57%). Alle responsen waren partieel; complete responsen werden niet gezien. In de groep patiënten behandeld met tepotinib in eerste lijn was de onafhankelijk vastgestelde ORR 44,2% (95%-BI: 29,1%-60,1%) en in de tweede lijn of hoger (het EMA-label) 48,2 procent (95%-BI: 34,7%-62,0%). Er was geen verschil tussen de 33 patiënten in de tweede lijn (ORR 48,5%) en de derde lijn of hoger (23 patiënten met ORR 47,8%). De ORR zonder eerdere platinumbevattende chemotherapie was 42,6 procent (95%-BI: 28,3%-57,8%), die na platinumbevattende chemotherapie 53,1 procent (95%-BI: 38,3%-67,5%). Er was geen verschil in ORR ten aanzien van het soort biopsie, de ORR van de weefselbiopsie groep was 50 procent en 48 procent in de liquid biopsy-groep.
Respons trad snel op, meestal binnen 6 weken na start. De onafhankelijk vastgestelde DoR was 11,1 maanden in de effectiviteitspopulatie (95%-BI: 7,2-niet te bepalen). In de groep patiënten met alleen een weefselbiopt was dit 15,7 maanden, in de liquid biopsy groep 9,9 maanden. De DoR wordt niet weergeven voor de groepen uitgesplitst naar lijn van de behandeling. De mediane PFS van de effectiviteitspopulatie was 8,5 maanden (95%-BI: 6,7 maanden tot 11,0 maanden). De mediane OS in deze populatie was 17,1 maanden (95%-BI: 12,0-26,8 maanden), maar nog niet matuur. Van de patiënten werd 35 procent behandeld met een vervolglijn na tepotinib. Bij de 11 patiënten met hersenmetastasen was de onafhankelijke bepaalde ORR 55 procent, met een mediane DoR van 9,5 maanden. De kwaliteit van leven vragenlijsten werden goed ingevuld, 88 procent na 12 weken. De meesten domeinen vertoonden stabiliteit, alleen het domein hoest vertoonde een klinisch relevante verbetering.
In de veiligheidspopulatie van 152 patiënten werd bij 89 procent een bijwerking gevonden die toe te schrijven was aan tepotinib. Een bijwerking van graad 3 of hoger trad op bij 25 procent van de patiënten. De meest voorkomende bijwerking van graad 3 of hoger was perifeer oedeem (7 procent) en pleuravocht (3 procent). Een verhoogd amylase en lipase werd vaak gezien (9 procent en 6 procent; maximaal graad 2), maar was meestal asymptomatisch. De meeste bijwerkingen ontstonden binnen 11 weken na start van de behandeling. Ernstige bijwerkingen gerelateerd aan tepotinib traden op in 15 procent, de meest voorkomende pleuravocht en oedeem, in 2,6 procent allebei.
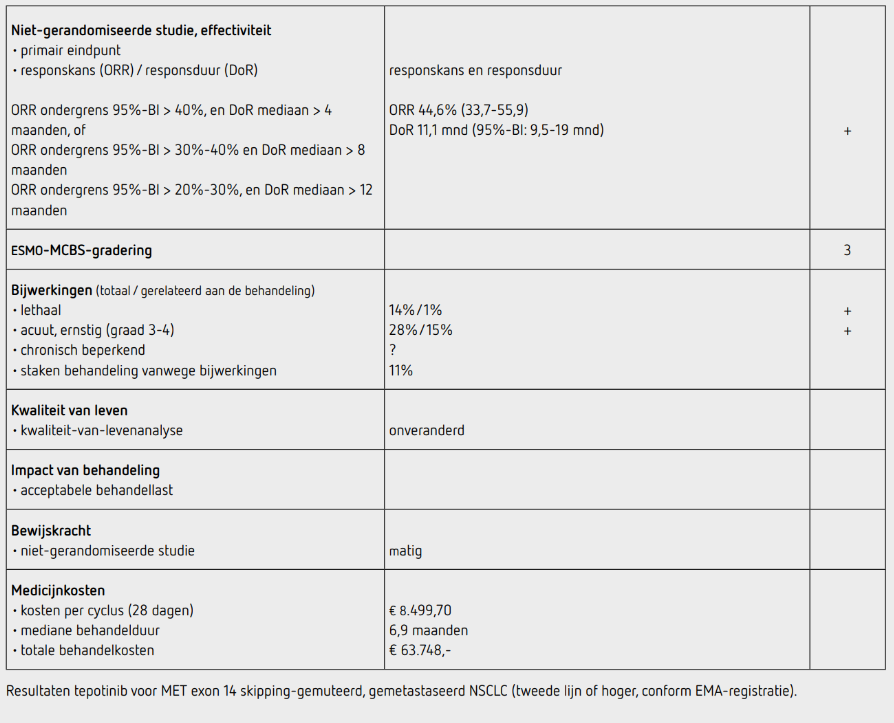
Bijwerkingen leidden tot een dosisreductie in 33 procent van de patiënten, en in 11 procent tot een behandelstop. Bijwerkingen leidend tot de dood traden op bij 21 patiënten, maar slechts bij 1 patiënt was het overlijden het gevolg van tepotinib volgens de onderzoekers (overlijden door respiratoir falen bij mogelijk interstitieel longlijden veroorzaakt door tepotinib). Er werd geen associatie gevonden tussen het type exon 14 skipping-mutatie en de uitkomsten. Bij 51 patiënten was er serieel cfDNA liquid biopsy beschikbaar. Een moleculaire respons trad op bij 34 patiënten (67 procent), 27 patiënten hadden een complete respons en 7 een majeure moleculaire respons. Van deze 34 patiënten hadden 24 een partiële respons en 6 stabiele ziekte (een disease control rate van 88 procent bij een moleculaire respons). In 2022 werd een update gepubliceerd, met inmiddels 152 patienten.3 Hiervan waren 83 patiënten voorafgaand aan tepotinib al behandeld, conform de EMA-registratie. Deze groep had een onafhankelijk bepaalde ORR van 44,6 procent (95%-BI: 33,7%-55,9%). De mediane DoR was 11,1 maanden (95%-BI: 9,5-18,5 maanden) in deze groep. De bijwerkingen waren conform de eerdere studie.
5. Discussie
In deze single-arm, fase II-studie naar de effectiviteit en veiligheid van tepotinib werd voor patiënten met een METex14 skipping-gemuteerd, gemetastaseerd NSCLC een ORR van 46 procent gezien in alle patiënten. De responskans op eerstelijnsbehandeling was 44 procent, die voor tweedelijns of hogere behandeling (het EMA-label) was 44,6 procent (95%-BI: 33,7%-55,9%). De mediane duur van deze respons was 11,1 maanden voor de groep met het EMA-label. Er lijkt geen belangrijk verschil in effectiviteit te zijn van tepotinib in de manier waarop de MET-mutatie werd aangetoond (weefselbiopsie of liquid biopsy). Tepotinib lijkt ook effectief te zijn bij patiënten met hersenmetastasen. Tepotinib wordt goed verdragen, zonder nadelige effecten op de kwaliteit van leven. Tegelijk met de hier beschreven studie werd ook een studie met capmatinib in dezelfde populatie gepubliceerd, de GeoMETry-studie.4
6. Kosten
De behandeling met tepotinib kost per 4 weken bij 450 mg per dag toediening 8.499,70 euro (bron: www.medicijnkosten.nl d.d. 25 oktober 2023). Bij een mediane behandelduur van 6,9 maanden komen de totale kosten bij deze behandelduur daarmee uit op 63.748 euro.
7. Conclusie
Bij patiënten met gemetastaseerd MET exon 14 skipping-gemuteerd NSCLC geeft tepotinib in alle behandellijnen een ORR van 46 procent (95%-BI: 36-57) met een responsduur van mediaan 11,1 maanden (95%-BI: 7,2-tot niet-bereikt). Voor de behandelgroep volgens het EMA-label (de groep waarbij tepotinib in tweede of hogere lijn gegeven wordt) is de ORR 44,6 procent (95%-BI: 33,7-55,9), met ook een mediane duur van respons van 11,1 maanden. Deze uitkomsten voldoen aan de PASKWIL-criteria voor niet-gerandomiseerde studies voor een positief advies. De kosten voor de behandeling zijn hoog. Dit advies is tot stand gekomen op basis van de uitkomsten van niet gerandomiseerde onderzoek. De kwaliteit van het bewijs is matig. Het is waarschijnlijk dat met verder onderzoek de schatting van de grootte van het effect van de behandeling zal veranderen.

Referenties
- Dutch Lung Cancer Audit 2019 dica.nl/dlca.
- Paik PK, Felip E, Veillon R et al. Tepotinib in NSCLC with MET exon 14 skipping mutations. N Engl J Med 2020;383:931-43.
- Le X, Sakai H, Felip E et al. Tepotinib efficacy and safety in patients with MET exon 14 skipping mutation NSCLC: outcomes in patient subgroups in the VISION study with relevance for the clinical practice. Clin Cancer Res 2020;28(6):1117-26.
- Wolf J, Seto T, HanJY et al. Capmatinib in MET exon 14 mutated or MET amplified NSCLC. . N Engl J Med 2020; 383: 944-57.
- Drillon A, Clark JW, Weiss J et al. Antitumor activity of crizotinib in lung cancers harboring a MET exon 14 alteration. Nat Med 2020;26:47-51..