
Inleiding
Bij ongeveer 5 procent van alle patiënten met een mammacarcinoom is er sprake van een BRCA1- of BRCA2-kiembaanmutatie. De kans op deze mutaties is groter bij patiënten met een jonge leeftijd bij presentatie van het mammacarcinoom, bij een sterk belaste familieanamnese voor mamma- of ovariumcarcinoom, en bij een tripelnegatief mammacarcinoom.
Olaparib is een orale PARP-remmer, die momenteel toegepast wordt bij patiënten met een mammacarcinoom en een BRCA-kiembaanmutatie in de gemetastaseerde setting na eerdere chemotherapie,1 bij het ovariumcarcinoom met een BRCA-mutatie,2,3 bij het pancreascarcinoom na eerdere platinumbehandeling bij patiënten met een BRCA-kiembaanmutatie,4 en bij patiënten met een castratieresistent prostaatcarcinoom en een BRCA-mutatie.5
In de hier te bespreken OlympiA-studie wordt de effectiviteit van olaparib onderzocht bij patiënten met een niet-gemetastaseerd mammacarcinoom en een BRCA-kiembaanmutatie.6,7 De EMA heeft olaparib goedgekeurd voor de behandeling van patiënten met een BRCA-kiembaanmutatie en een niet-gemetastaseerd HER2-negatief mammacarcinoom die ondanks chemotherapie, gegeven voor of na de operatie, een hoog risico hebben op recidief.
1. Kankersoort en lijn van behandeling
Adjuvante behandeling met olaparib werd vergeleken met placebo bij patiënten met een niet-gemetastaseerd mammacarcinoom met een BRCA-kiembaanmutatie die ofwel geen complete pathologische respons (pCR) hebben na neoadjuvante chemotherapie ofwel een hoog risico op recidief hebben na adjuvante chemotherapie.
2. Vergelijking met de referentiebehandeling in Nederland
De huidige referentiebehandeling in Nederland bij tripelnegatief mammacarcinoom zonder pCR na neoadjuvante behandeling is adjuvante behandeling met 6-8 cycli capecitabine. Ten tijde van de inclusieperiode van de OlympiA-studie was capecitabine nog geen standaardbehandeling. Na adjuvante chemotherapie bij tripelnegatief mammacarcinoom wordt momenteel geen andere aanvullende behandeling gegeven. Bij patiënten met een hormoongevoelig mammacarcinoom wordt na de operatie adjuvante endocriene therapie gegeven. In het geval van een hormoongevoelig mammacarcinoom werd in de OlympiA-studie olaparib of een placebo toegevoegd aan adjuvante endocriene therapie. Hiermee voldoet de referentiebehandeling in de studie aan de standaardbehandeling in Nederland ten tijde van de inclusie.
3. Methode en kwaliteit van de studie
De OlympiA-studie is een dubbelblind, gerandomiseerde, placebogecontroleerde fase III-multicenterstudie voor patiënten met een nietgemetastaseerd HER2-negatief mammacarcinoom. Om voor inclusie in aanmerking te komen dienden patiënten een pathogene of vermoedelijk pathogene kiembaanmutatie te hebben in het BRCA1- of BRCA2-gen, 18 jaar of ouder te zijn, een ECOG-performancestatus van 0 of 1 te hebben, neoadjuvante of adjuvante chemotherapie en chirurgische en eventuele radiotherapeutische behandeling van de tumor in de mamma en eventueel de oksel te hebben ondergaan. Er moesten ten minste 6 cycli chemotherapie zijn toegediend, bestaande uit ten minste een anthracycline of een taxaan. Platinumbevattende chemotherapie was toegestaan. Adjuvante chemotherapie na eerdere neoadjuvante chemotherapie was niet toegestaan. Standaard disseminatieonderzoek was niet verplicht. Wel werd, indien er verhoogde serumleverwaarden waren bij screening, beeldvorming van de lever verricht (middels echo, CT of MRI) en bij een verhoogde waarde van het alkalische fosfatase of calcium werd beeldvorming van het skelet verricht (skeletscintigrafie of FDG-PET-scan). Patiënten met een tripelnegatief mammacarcinoom konden geïncludeerd worden indien er geen pCR was na neoadjuvante chemotherapie of na adjuvante chemotherapie bij status na resectie van een tumor van ten minste 2 centimeter of bij aanwezigheid van één of meer positieve okselklieren. Patiënten met een hormoongevoelig mammacarcinoom konden geïncludeerd worden na operatie en chemotherapie bij aanwezigheid van ten minste 4 positieve okselklieren of bij status na neoadjuvante chemotherapie en een Cinical and Pathological Stage plus Estrogen receptor status, nuclear Grade and postneoadjuvant chemotherapy pathological stage (CPS + EG) score van 3 of hoger. De CPS + EG-score bestaat uit een combinatie van het klinisch en pathologisch tumorstadium, aangevuld met de hormoonreceptorstatus en de histologische gradering.
Patiënten werden 1:1 gerandomiseerd tussen behandeling met olaparib 300 mg of placebo tweemaal daags per os gedurende 52 weken. De randomisatie werd gestratificeerd naar hormoonreceptorstatus (positief versus negatief), chemotherapie (neoadjuvant versus adjuvant) en het gebruik van platinumbevattende chemotherapie (ja versus nee). Dosisreductie of onderbreking van de behandeling vanwege toxiciteit was toegestaan volgens de richtlijnen beschreven in het protocol.
Anamnese en lichamelijk onderzoek werden verricht elke 4 weken gedurende de eerste 24 weken na randomisatie, daarna elke 3 maanden tot en met 2 jaar na randomisatie, elke 6 maanden in jaar 3 tot en met 5 en daarna jaarlijks. Jaarlijks werd een mammografie en/of een MRI-mamma verricht. Verdere beeldvorming werd verricht op indicatie op basis van klachten, bevindingen bij lichamelijk onderzoek of afwijkende laboratoriumuitslagen.
Het primaire eindpunt was invasieve ziektevrije overleving (IDFS) en werd gedefinieerd als de tijd vanaf randomisatie tot het eerste optreden van een ipsilateraal, locoregionaal of contralateraal invasief mammacarcinoom, metastasen op afstand, een tweede primaire maligniteit of overlijden. Secundaire eindpunten waren metastasevrije overleving (DDFS), overleving (OS) en veiligheid van de behandeling.
Kwaliteit-van-levenanalyse was onderdeel van de studie en werd gemeten met de EORTC QLQ-C30- en FACIT-fatiguevragenlijsten elke 6 maanden gedurende de eerste 2 jaar.
Volgens het ontwerp van de studie waren 1800 patiënten en 330 events nodig om met 90 procent power en een tweezijde alfa van 0,05 een hazard ratio (HR) van 0,7 voor invasieve ziekte of overlijden vast te stellen.
Een interim-analyse was gepland na 165 IDFS events in de eerste 900 (50 procent van totaal) geïncludeerde patiënten. Een analyse op het IDFS-eindpunt zou worden uitgevoerd op de intention-to-treat (ITT) populatie die op het moment van de interim-analyse zou zijn gerandomiseerd. Een ondersteunende analyse werd uitgevoerd op de eerste 900 patiënten op basis van ITT en dit werd het ‘mature’ cohort genoemd. De toevoeging van het mature cohort was bedoeld om het effect dat zou zijn waargenomen bij de interim-analyse ook met langere followuptijd te bevestigen. Ten tijde van de interim-analyse zou ook worden gekeken naar OS en DDFS. Volgens protocol zou na deze interim-analyse nog een analyse volgen halverwege de interimen eindanalyse (bij 330 IDFS-events, verwacht 10 jaar na randomisatie van de eerste patiënt). Voor de interim-analyse zou een hiërarchische testprocedure worden gebruikt. Voor IDFS in de ITT-populatie zou de volledige 2,5 procent eenzijdige alfa worden ingezet. Indien het resultaat significant was zou voor DDFS 2 procent en voor OS 0,5 procent gebruikt worden. Zolang de resultaten significant zijn, kan de alfa worden hergebruikt. Respectievelijk 3 en 4 analyses zijn gepland voor DDFS en OS. 10 jaar na inclusie van de laatste patiënt is de definitieve analyse voor OS gepland.
De hier gerapporteerde analyse van het primaire eindpunt IDFS is afkomstig van de interim-analyse (86 procent van de geplande eind-analyse).6 De hier gerapporteerde analyse van de OS is afkomstig van de tweede OS interim-analyse, gepland na 330 events (uiteindelijke IDFS analyse).7 Voor deze OS-analyse was de grens voor superioriteit een alfa kleiner dan 0,015.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen juni 2014 en mei 2019 werden 1836 patiënten geïncludeerd: 921 patiënten in de olaparibgroep en 915 patiënten in de placebogroep. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 42 versus 43 jaar, ruim 70 procent had een BRCA1-mutatie, de helft van de patiënten was neoadjuvant behandeld, ruim 80 procent had een tripelnegatieve tumor en 26 procent was behandeld met platinumbevattende chemotherapie.
Op het moment van de eerste analyse waren 284 events opgetreden, 106 in de olaparibgroep en 178 in de placebogroep. De mediane follow-upduur was 2,5 jaar in de ITT-populatie en 3,5 jaar in het mature cohort.
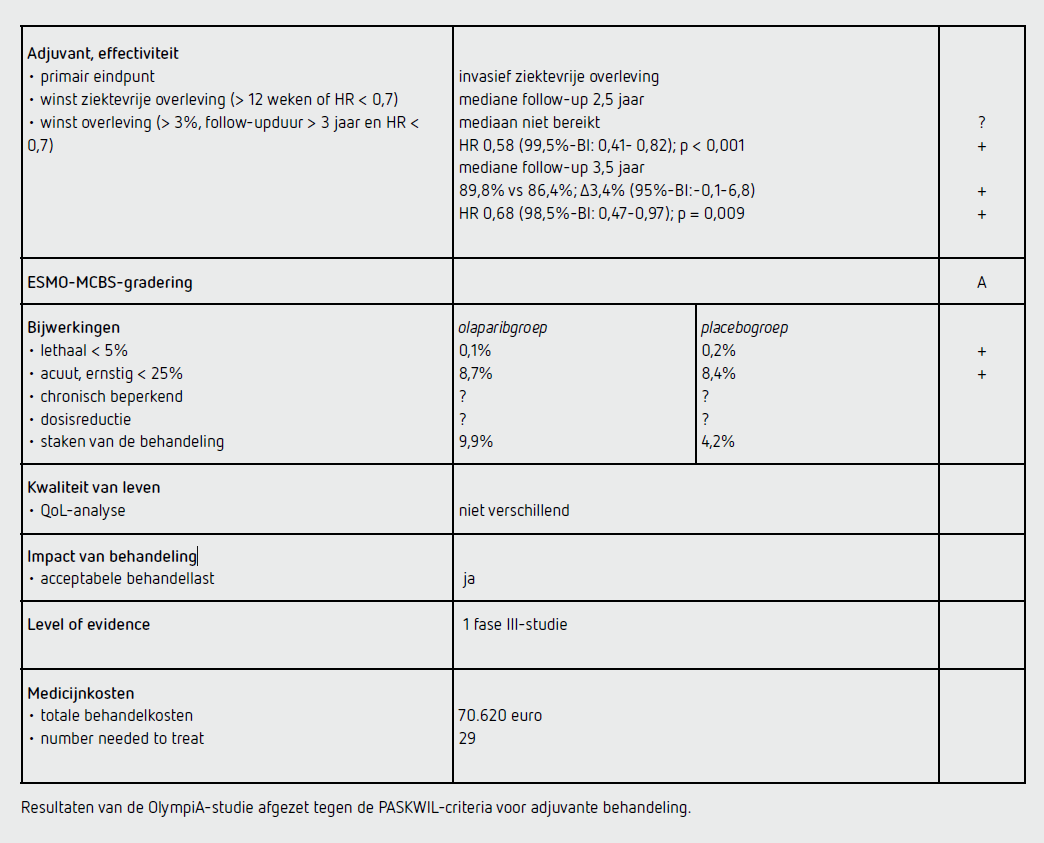
Het verschil in IDFS na 3 jaar bedroeg 8,8 procent (95%-BI: 4,5-13,0 procent), namelijk 85,9 procent in de olaparibgroep en 77,1 procent in de placebogroep. De IDFS was significant langer in de olaparibgroep dan in de placebogroep met een HR van 0,58 (99,5%-BI: 0,41-0,82; p < 0,001). De driejaars-DDFS was ook significant langer bij patiënten in de olaparibgroep dan in de placebogroep, namelijk 87,5 procent versus 80,4 procent (verschil 7,1 procent, 95%-BI: 3,0-11,1) (HR 0,57 [99%-BI: 0,39-0,83]; p < 0,001).
Bij de eerste analyse was het verschil in OS niet statistisch significant. De tweede OS interim-analyse werd verricht na een gemiddelde follow-upduur van 3,5 jaar en nadat 184 patiënten overleden waren: 75 (8,1 procent) in de olaparibgroep en 109 (11,9 procent) in de placebogroep. De OS was significant beter in de olaparibgroep dan in de placebogroep (HR 0,68 [98,5%-BI: 0,47-0,97]; p = 0,009), met een vierjaars-OS van 89,8 procent in de olaparibgroep en 86,4 procent in de placebogroep (verschil 3,4 procent, 95%-BI: -0,1-6,8).
Het verschil in IDFS en OS was consistent in alle vooraf gedefinieerde subgroepen, hoewel in absolute zin beperkter bij patiënten die behandeld waren met platinumbevattende chemotherapie.
Van de 921 patiënten in de olaparibgroep ontvingen 911 patiënten (98,9 procent) ten minste één gift. Mediaan was 94,8 procent van de geplande dosis olaparib gegeven. Bijwerkingen van graad 3 of hoger waren anemie (8,7 procent), leukopenie (3,0 procent) en neutropenie (4,8 procent). Bij 53 patiënten (5,8 procent) was ten minste één bloedtransfusie nodig. Bij 90 patiënten (9,9 procent) in de olaparibgroep werd de behandeling gestopt vanwege bijwerkingen. Ernstige bijwerkingen kwamen voor bij 79 patiënten (8,7 procent) en één patiënt overleed ten gevolge van een hartstilstand.
Van de 915 patiënten in de placebogroep hadden 904 patiënten ten minste één gift ontvangen (98,8 procent). Mediaan was 98,9 procent van de geplande dosis placebo gegeven. Er kwamen geen bijwerkingen van graad 3 of hoger voor bij meer dan 1 procent van de patiënten. Bij 8 patiënten (0,9 procent) is een bloedtransfusie gegeven. Bij 38 patiënten (4,2 procent) waren bijwerkingen de reden om de behandeling te staken. Ernstige bijwerkingen kwamen voor bij 76 patiënten (8,4 procent). Twee patiënten in de placebogroep zijn overleden ten gevolge van de behandeling (acute myeloïde leukemie (AML) en ovariumcarcinoom). Bijwerkingen die speciale aandacht behoeven, zoals pneumonitis, myelodysplastisch syndroom (MDS), AML of andere primaire maligniteiten traden niet frequenter op bij patiënten in de olaparib- dan in de placebogroep.
Analyse van de kwaliteit van leven liet geen afname zien na 12 maanden in de olaparib- en in de placebogroep. Er waren geen significante verschillen tussen de twee behandelgroepen.
Discussie
In de OlympiA-studie werd een statistisch significante verbetering gezien van de IDFS en de OS na behandeling met olaparib gedurende één jaar bij patiënten met een niet-gemetastaseerd HER2-negatief mammacarcinoom, een BRCA-kiembaanmutatie en een hoog risico op recidief na (neo)adjuvante chemotherapie. Het verschil in OS bedroeg 3,4 procent met een HR van 0,68 na een mediane followupduur van langer dan 3 jaar.
Deze uitkomsten voldoen aan de PASKWIL-criteria voor adjuvante studies voor een positief advies.
Het verschil in IDFS en OS werd gezien in alle vooraf geplande subgroepen, maar leek mogelijk geringer in de relatief kleine groep patiënten die behandeld waren met platinumbevattende chemotherapie. Zowel de PARP-remmer olaparib als platinumverbindingen ontlenen hun werking aan het ingrijpen op het herstelmechanisme na DNA-breuken. Bij het niet-gemetastaseerd mammacarcinoom zijn nog geen andere data beschikbaar over het effect van PARP-remmers na behandeling met platinumverbindingen. In de gemetastaseerde setting liet de OlympiAD-studie geen verschil in effect van olaparib zien in platinumvoorbehandelde versus nietvoorbehandelde patiënten.1 Inmiddels worden patiënten met een nonpCR na neoadjuvante chemotherapie en een tripelnegatief mammacarcinoom behandeld met capecitabine in de adjuvante setting. Dat was in de OlympiA-studie niet toegestaan. Hoe het effect van capecitabine zich verhoudt tot dat van olaparib bij patiënten met een BRCA-mutatie en een non-pCR na neoadjuvante chemotherapie is daarom niet duidelijk.
Een aanzienlijk deel van de vrouwen met een BRCA-kiembaanmutatie en mammacarcinoom is premenopauzaal. Er zijn sterke aanwijzingen dat olaparib het risico op aangeboren afwijkingen verhoogt.8 Tijdens behandeling zijn dus strikte, niet-hormonale contraceptieve maatregelen geïndiceerd. Over de fertiliteit na behandeling met olaparib is nog weinig bekend, behalve preklinische aanwijzingen ten aanzien van een ongunstig effect op de ovariële reserve,9 die ook al door de chemotherapie afgenomen is.
De huidige follow-upduur is onvoldoende voor een inschatting van de gevolgen op langere termijn van behandeling met olaparib, met name de kans op het ontwikkelen van een MDS of AML. In een recente meta-analyse van gerandomiseerde studies met een PARP-remmer10 vond men een risico op MDS en AML van 0,73 procent bij patiënten behandeld met een PARP-remmer versus 0,47 procent bij placebo met een odds ratio van 2,63. De resultaten van de geplande langetermijnfollow-upduur na 10 en 15 jaar van de OlympiA-studie zijn van belang in de afweging van deze risico’s.
Een overlevingswinst van 3,4 procent impliceert dat 29 patiënten behandeld moeten worden om één leven te redden. De kosten hiervan zullen ongeveer 2 miljoen euro bedragen.
5. Kosten
De behandeling met 2 d.d. 300 mg olaparib kost 193,48 euro per dag. De totale behandelkosten voor een jaar komen hiermee op 70.620 euro (bron: www.medicijnkosten.nl, d.d. 9 april 2023).
Conclusie
In de hier besproken OlympiA-studie wordt bij patiënten met een niet-gemetastaseerd HER2-negatief mammacarcinoom, een BRCA-kiembaanmutatie en een verhoogd risico op recidief na (neo)adjuvante chemotherapie na een follow-upduur van 3,5 jaar een statistisch significante verbetering gezien van de overleving bij behandeling met olaparib gedurende 1 jaar vergeleken met placebo (89,8 procent versus 86,4 procent; HR 0,68 [98,5%-BI: 0,47-0,97]; p = 0,009). Hiermee voldoet deze studie aan de PASKWIL-criteria voor een positief advies.
Referenties
- Robson M, Im SA, Senkus E, et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. N Engl J Med 2017; 377(6):523-33.
- Moore K, Colombo N, ScambiaCortes G, et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med 2018; 379(26):2495-505.
- Ledermann JA, Harter P, Gourley C, et al. Overall survival in patients with platinum-sensitive recurrent serous ovarian cancer receiving olaparib maintenance monotherapy: an updated analysis from a randomised, placebocontrolled, double-blind, phase 2 trial. Lancet Oncol 2016;17(11):1579-89.
- Golan T, Hammel P, Reni M, et al. Maintenance olaparib for germline BRCA-mutated metastatic pancreatic cancer. N Engl J Med 2019;381(4):317-27.
- de Bono J, Mateo J, Fizazi K, et al. Olaparib for metastatic castration-resistant prostate cancer. N Engl J Med 2020;382(22):2091-102.
- Tutt ANJ, Garber JE, Kaufman B, et al. Adjuvant olaparib for patients with BRCA1- or BRCA2-mutated breast cancer. N Engl J Med 2021;384(25):2394-405.
- Geyer CE Jr, Garber JE, Gelber RD, et al. Overall survival in the OlympiA phase III trial of adjuvant olaparib in patients with germline pathogenic variants in BRCA1/2 and high-risk, early breast cancer. Ann Oncol 2022;33(12):1250-68.
- farmacotherapeutischkompas.nl
- Nakamura K, Takae S, Shiraishi E, et al. Poly (ADPribose) polymerase inhibitor exposure reduces ovarian reserve followed by dysfunction in granulosa cells. Sci Rep 2020;10(1):17058.
- Morice PM, Leary A, Dolladille C, et al. Myelodysplastic syndrome and acute myeloid leukaemia in patients treated with PARP inhibitors: a safety meta-analysis of randomised controlled trials and a retrospective study of the WHO pharmacovigilance database. Lancet Haematol 2021;8(2):e122e34.