
Inleiding
Een activerende epidermale-groeifactorreceptormutatie (EGFR-mutatie) komt voor bij ongeveer 10 procent van de patiënten met niet-kleincellig longcarcinoom (NSCLC). Wanneer deze patiënten in palliatieve setting worden behandeld met een EGFR-tyrosinekinaseremmer (EGFR-TKI), is de progressievrije overleving (PFS) significant langer dan bij behandeling met chemotherapie en is er een betere kwaliteit van leven.1 Eerder heeft de derdegeneratie-EGFR-TKI osimertinib als monotherapie bij EGFR-gemuteerd NSCLC een betere PFS laten zien dan eerste generatie erlotinib of gefitinib.2
De hier te bespreken FLAURA2-studie onderzoekt het effect van osimertinib met chemotherapie als eerstelijnstherapie ten opzichte van osimertinib zonder chemotherapie bij patiënten met gevorderd NSCLC en een activerende EGFR-mutatie in exon 19 of exon 21 (de twee meest voorkomende EGFR-mutaties).3
EMA heeft osimertinib goedgekeurd als eerstelijnsbehandeling in combinatie met pemetrexed en platinumbevattende chemotherapie voor patiënten met een gevorderd of gemetastaseerd NSCLC met een activerende EGFR exon 19-deletie of exon 21-puntmutatie L858R.
Kankersoort en lijn van behandeling
Eerstelijnsbehandeling met osimertinib met chemotherapie werd onderzocht bij patiënten met een gevorderd of gemetastaseerd NSCLC met een activerende EGFR-mutatie (exon 19-deletie of exon 21-puntmutatie L858R).
Vergelijking met de referentiebehandeling in Nederland
In de FLAURA2-studie wordt osimertinib met chemotherapie vergeleken met osimertinib monotherapie. In Nederland wordt aan patiënten met een activerende EGFR-mutatie osimertinib monotherapie als standaardtherapie gegeven in de eerste lijn. Hiermee voldoet de controlegroep aan de Nederlandse praktijk.
Methoden van de studie
De FLAURA2-studie is een open-label, gerandomiseerde fase III-multicenterstudie voor patiënten met een gevorderd of gemetastaseerd NSCLC met een activerende EGFR exon 19-deletie of exon 21-puntmutatie L858R. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn, een ECOG-performancestatus van 0 of 1 te hebben, een lokaal gevorderd of gemetastaseerd NSCLC zonder eerdere systemische behandeling voor gevorderde ziekte. De EGFR exon 19-deletie of L858R-mutatie, alleen of in combinatie met andere EGFR-mutaties, werd centraal of lokaal vastgesteld. Patiënten met metastasen in het centrale zenuwstelsel bij wie de toestand neurologisch stabiel was, mochten deelnemen. Eventuele eerdere bestraling of behandeling met glucocorticoïden moest minstens 2 weken vóór de start van de behandeling zijn afgerond. Patiënten met een plaveiselcelcarcinoom of interstitiële longziekte werden geëxcludeerd. Eventuele (neo)adjuvante behandeling diende ten minste 12 maanden voor het ontstaan van recidief of metastasen te zijn afgerond.
Patiënten werden 1:1 gerandomiseerd tussen monotherapie osimertinib eenmaal daags 80 mg per os en osimertinib eenmaal daags 80 mg per os met chemotherapie. De chemotherapie bestond uit 4 3-wekelijkse kuren intraveneus pemetrexed (500 mg/m2) met cisplatine (75 mg/m2) of carboplatine (AUC 5), gevolgd door onderhoudsbehandeling met driewekelijks pemetrexed (500 mg/m2). De behandeling werd gecontinueerd tot aan progressie of onacceptabele toxiciteit, maar kon eventueel gecontinueerd worden na progressie als de patiënt volgens de onderzoeker er klinisch voordeel bij had. De behandeling werd gestratificeerd naar etniciteit (Chinees versus overig Aziatisch versus niet-Aziatisch), EGFR-mutatie (centraal versus lokaal bepaald) en ECOG-performancestatus (0 versus 1). Dosisaanpassing en behandelonderbreking tot maximaal 3 weken waren toegestaan. Bij toxiciteit werd als eerste de chemotherapie aangepast en daarna de dosering van osimertinib
Het primaire eindpunt van de studie was PFS vastgesteld volgens RECIST 1.1 en bepaald door de lokale onderzoeker. Secundaire eindpunten waren onder andere overleving (OS), objectieve responskans, kwaliteit van leven en veiligheid. Een CT- of MRI-scan voor evaluatie werd in de eerste 12 weken elke 6 weken en daarna elke 12 weken tot aan ziekteprogressie of terugtrekken uit het onderzoek gemaakt. Beeldvorming van de hersenen met MRI was verplicht bij inclusie. Follow-up van hersenen werd gedaan bij aanwezigheid van hersenmetastasen op alle momenten van de responsmeting. In de eerste 2 maanden werd wekelijks de kwaliteit van leven gemeten met de vragenlijsten EORTC QLQ-C30, LC13, en de EQ5D, nadien elke 3 weken. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0. Gegevens over de vervolgbehandelingen zijn verzameld in deze studie.
Volgens het ontwerp van de studie waren er 556 patiënten en 278 events nodig om met 90 procent power en een tweezijdige alfa van 5 procent een hazard ratio (HR) van 0,68 voor PFS te kunnen vaststellen. Dit komt overeen met een verbetering van de PFS van 19 naar 28 maanden. In een interim-analyse voor futiliteit werd voorzien (niet gerapporteerd). OS werd alleen getest indien de PFS significant was. OS zou worden getest ten tijde van de primaire PFS-analyse en op het moment van 60 procent datamaturiteit (nadat ongeveer 334 patiënten overleden waren). De hier gerapporteerde OS data zijn afkomstig van een additionele interim-analyse voor OS, gepresenteerd op het ELCC-congres 2024.4 De grens voor significantie van deze analyse was 0,000001.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen 1 juni 2020 en 22 december 2021 werden 557 patiënten geïncludeerd door centra in Noord- en Zuid-Amerika, Europa, Azië en Australië: 279 patiënten in de chemotherapiegroep en 278 patiënten in de controlegroep. De mediane follow-up bedroeg 19,5 maanden voor de chemotherapiegroep en 16,5 maanden voor de controlegroep. De mediane leeftijd was 61 jaar, 61 procent van de patiënten had een EGFR exon 19-deletie en 41 procent had hersenmetastasen. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar, behoudens iets meer patiënten met levermetastasen in de controlegroep (24 procent versus 15 procent in de chemotherapiegroep).
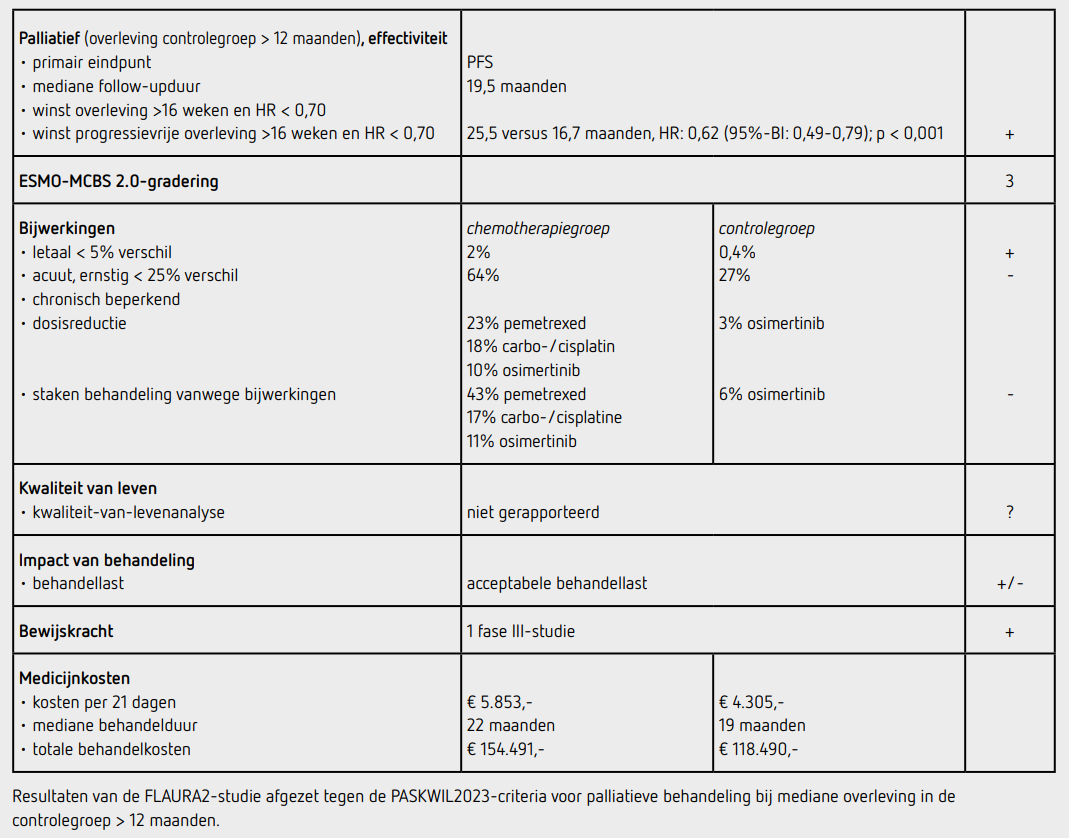
Er waren 286 patiënten met een recidief of overlijden, 120 in de chemotherapiegroep en 166 in de controlegroep. Het primaire eindpunt PFS was statistisch significant beter in de chemotherapiegroep dan in de controlegroep (HR: 0,62 [95%BI: 0,49-0,79]; p < 0,001). De mediane PFS bedroeg 25,5 maanden (95%-BI: 24,7-niet bereikt) in de chemotherapiegroep en 16,7 maanden (95%-BI: 14,1-21,3) in de controlegroep. De 2-jaars PFS was 57 procent in de chemotherapiegroep en 41 procent in de controlegroep. Een subgroep die meer baat leek te hebben van de combinatie van osimertinib met chemotherapie waren de patiënten met hersenmetastasen, met een HR van 0,47 (95%-BI: 0,33-0,66). Het effect op PFS was vergelijkbaar voor patiënten met een EGFR exon 19-deletie en patiënten met een L858R-mutatie (HR: 0,60 versus 0,63).
Bij de interim-analyse van OS was de mediane follow-upduur 31,7 maanden en was 41 procent van de patiënten overleden. De OS was niet statistisch significant langer in de chemotherapiegroep dan in de controlegroep (HR: 0,75 [95%-BI: 0,570,97] p = 0,0280), met een mediane OS die nog niet bereikt is in de chemotherapiegroep (95%-BI: 38-niet bereikt) en 36,7 maanden in de controlegroep (95%-BI: 33,2-niet bereikt). In de chemotherapiegroep ontvingen 276 patiënten (99 procent) ten minste 1 dosis medicatie en in de controlegroep ontvingen 275 patiënten (99 procent) ten minste 1 dosis medicatie. 211 patiënten (76 procent) ontvingen ten minste 4 cycli chemotherapie en er werden mediaan 4 cycli carboplatine of cisplatine gegeven en mediaan 12 cycli pemetrexed. Bijwerkingen die leidden tot dosisaanpassing van pemetrexed traden op bij 64 patiënten (23 procent) en 119 patiënten (43 procent) staakten de behandeling voortijdig vanwege bijwerkingen. Bijwerkingen die leidden tot dosisaanpassing van carboplatine of cisplatine traden op bij 49 patiënten (18 procent) en 46 patiënten (17 procent) staakten de behandeling voortijdig vanwege bijwerkingen. In de chemotherapiegroep was de mediane behandelduur met osimertinib 22,3 maanden en in de controlegroep 19,3 maanden. Osimertinib werd gestaakt vanwege bijwerkingen bij 30 patiënten (11 procent) in de chemotherapiegroep en bij 17 patiënten (6 procent) in de controlegroep.
In totaal hadden 176 patiënten (64 procent) in de chemotherapiegroep ten minste één bijwerking van graad 3 of hoger. In de controlegroep hadden 75 patiënten (27 procent) graad 3 of hogere bijwerkingen. De meest voorkomende bijwerkingen van graad 3 in de chemotherapiegroep waren anemie (20 procent) en neutropenie (11 procent). Bijwerkingen gerelateerd aan de behandeling met fatale afloop traden op bij 5 patiënten (2 procent) in de chemotherapiegroep en bij 1 patiënt (0,4 procent) in de controlegroep. Analyses van kwaliteit van leven zijn nog niet gerapporteerd.
Bij de chemotherapiegroep staakten 123 patiënten (44 procent) de studiebehandeling waarvan 57 patiënten (46 procent) een vervolgbehandeling kreeg. Bij 69 procent bestond dit uit chemotherapie en bij 32 procent was dit platinumbevattende chemotherapie. Bij de controlegroep staakten 151 patiënten (54 procent) de behandeling, waarvan 91 patiënten (60 procent) een vervolgbehandeling kreeg. Bij 81 procent bestond dit uit platinumbevattende chemotherapie.
Kwaliteit van de studie en interpretatie van de uitkomsten
Het schema en de dosering van osimertinib en chemotherapie (carboplatine/pemetrexed) zijn conform de standaard bij gemetastaseerd NSCLC zonder drivermutaties. Mediaan werden 4 cycli platinumbevattende chemotherapie en 12 cycli pemetrexed gegeven. In de PARAMOUNT-studie werden mediaan 4 cycli pemetrexed onderhoudsbehandeling gegeven.5 Kennelijk wordt de combinatie van osimertinib en pemetrexed bij veel patiënten redelijk verdragen, hoewel ruim 40 procent vanwege bijwerkingen stopt met pemetrexed. Hersenmetastasen, mits stabiel en behandeld, waren in de studie toegestaan, zodat de resultaten goed te vertalen zijn naar de dagelijkse praktijk. Er waren geen majeure tussentijdse wijzigingen in het ontwerp van de studie. De hier gepresenteerde OS-interim-analyse, verricht nadat 40 procent van de patiënten overleden was, staat niet beschreven in de beschikbare versies van het studieprotocol of het statistisch plan. Er lijkt dus sprake te zijn van een ongeplande extra OS-analyse, die ook nog niet gepubliceerd is.
De studie was open label (ongeblindeerd). Dit kan de betrouwbaarheid van PFS negatief hebben beïnvloed, temeer omdat het primaire eindpunt PFS door de lokale onderzoeker werd vastgesteld. Er heeft wel een sensitiviteitsanalyse plaatsgevonden waarbij PFS geblindeerd, centraal en onafhankelijk werd beoordeeld. Dit liet een vergelijkbaar resultaat zien. Bij progressie kreeg 60 procent in de controlegroep alsnog platinumbevattende chemotherapie versus 46 procent in de chemotherapiegroep. Er wordt niet vermeld hoeveel patiënten pemetrexed ontvingen. Het is dus niet goed te beoordelen in hoeverre de behandeling na progressie conform de standaard was. Het primaire eindpunt is PFS, waar dat in deze studie beter OS had moeten zijn om de toegevoegde waarde van chemotherapie toegevoegd aan de eerste lijn ten opzichte van uitstel tot de tweede lijn vast te kunnen stellen.
Discussie
In de FLAURA2-studie wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt PFS van eerstelijns palliatieve behandeling met osimertinib en chemotherapie ten opzichte van osimertinib monotherapie bij patiënten met een gevorderd of gemetastaseerd NSCLC met een EGFR-mutatie (exon 19-deletie of exon 21 L858R-puntmutatie) (HR: 0,62 [95%-BI: 0,49-0,79]; p < 0,001), met een toename in mediane PFS van 8,8 maanden. De resultaten van dit eindpunt voldoen aan de PASKWIL2023-criteria voor een positief advies voor palliatieve behandeling met mediane overleving in de controlegroep > 12 maanden.
De behandeling gaat wel gepaard met aanzienlijke toxiciteit waarbij de chemotherapie bij meer dan 40 procent voortijdig gestaakt werd vanwege bijwerkingen. Kwaliteit-van-levendata zijn wel verzameld maar nog niet gepubliceerd.
De OS is nog niet matuur. De vraag is of combinatietherapie uiteindelijk een betere OS oplevert dan sequentiële therapie (eerst een derdegeneratie-tyrosinekinaseremmer, daarna chemotherapie). Zodra de OS matuur is kan een betere inschatting gemaakt worden van de meerwaarde van gecombineerde versus sequentiële toepassing van osimertinib en chemotherapie. Ook is het de vraag of een betere OS opweegt tegen de toename in toxiciteit en kosten. Mogelijk is de combinatietherapie niet voor alle patiënten geschikt, maar is er een subgroep met meer voordeel (bijvoorbeeld patiënten met snelle progressie, grote tumorload of hersenmetastasen). Deze vragen worden niet beantwoord met de FLAURA2-studie. Inmiddels is ook amivantamab geregistreerd voor deze patiëntenpopulatie. In de eerste lijn laat amivantamab als combinatiebehandeling met lazertinib bij EGFR exon 19-deletie of exon 21 L858R-mutatie in de MARIPOSA-studie een toename in PFS zien die voldoet aan de PASKWIL2023-criteria.6 In tweede lijn na progressie op osimertinib laat amivantamab in de MARIPOSA2-studie een PFS-winst zien die niet voldoet aan de PASKWIL-criteria.7 Hoe de effectiviteit van de combinatie osimertinib en chemotherapie zich verhoudt tot amivantamab met lazertinib is nog niet onderzocht. Met deze verschillende behandelmogelijkheden in de eerste lijn bij EGFR-gemuteerd NSCLC zal een plaatsbepaling meer helderheid moeten verschaffen.
Kosten
De behandeling met osimertinib en pemetrexed kost bij een lichaamsoppervlak van 2,0 m2 5.853 euro per behandelcyclus van 21 dagen. De kosten van 21,8 maanden osimertinib komen op 135.915 euro en van 12 cycli pemetrexed op 18.576 euro. Hiermee komen de totale medicatiekosten in de chemotherapiegroep op 154.491 euro, exclusief de geringe kosten van cisplatine en carboplatine. De medicatiekosten van 19,0 maanden osimertinib in de controlegroep bedragen 118.490 euro (bron: medicijnkosten.nl d.d. juni 2025).
Conclusie
In de hier besproken FLAURA2-studie wordt bij patiënten met lokaal gevorderd of gemetastaseerd NSCLC met een EGFR exon 19-deletie of exon 21 L858R-puntmutatie na een follow-up van mediaan 19,5 maanden een statistisch significant langere PFS gezien na palliatieve behandeling met chemotherapie toegevoegd aan standaardbehandeling met osimertinib, met een toename van mediaan 8,8 maanden (HR: 0,62 [95%-BI: 0,49-0,79]; p < 0,001). Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij mediane overleving in de controlegroep > 12 maanden. De toxiciteit van deze behandeling is aanzienlijk.
Referenties
- Lee CK, Novello S, Rydén A, et al. Patient-reported symptoms and impact of treatment with osimertinib versus chemotherapy in advanced non-small-cell lung cancer: The AURA3 Trial. J Clin Oncol 2018;36(18):1853-60.
- Soria J-C, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018;378(2):113-25.
- Planchard D, Janne PA, Cheng Y, et al. Osimertinib with or without chemotherapy in EGFR-mutated advanced NSCLC. N Engl J Med 2023;389(21):1935-48.
- Valdiviezo N, Okamoto I, Hughes BGM, et al. First-line (1L) osimertinib (osi) +/- platinum-pemetrexed in EGFR-mutated (EGFRm) advanced NSCLC: FLAURA2 postprogression outcomes. ESMO Open 2024:9;102583.
- Paz-Ares LG, de Marinis F, Dediu M, et al. PARAMOUNT: Final overall survival results of the phase III study of maintenance pemetrexed versus placebo immediately after induction treatment with pemetrexed plus cisplatin for advanced nonsquamous nonsmall-cell lung cancer. J Clin Oncol 2013; 31(23):2895-902.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Amivantamab en lazertinib als eerstelijnsbehandeling bij EGFR-gemuteerd niet-kleincellig longcarcinoom. Med Oncol 2025;28(7):30-5.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Amivantamab en chemotherapie bij EGFR-gemuteerd gemetastaseerd niet-kleincellig longcarcinoom na progressie op osimertinib. Med Oncol 2025;28(3):31-4.