
Inleiding
Tussen de 20 en 30% van de patiënten met niet-kleincellig longcarcinoom (NSCLC) heeft bij diagnose stadium III (lokaal gevorderde) ziekte. Dat komt neer op ongeveer 3000 patiënten jaarlijks in Nederland.1 Ondanks de introductie van neoadjuvante chemo-immunotherapie is bijna 80% van de tumoren irresectabel. Voor deze patiënten is de combinatie van chemoradiotherapie bestaande uit een platinumbevattend doublet en 54-66 Gy radiotherapie de standaardbehandeling, gevolgd door durvalumab gedurende 1 jaar bij patiënten zonder progressie.2 Hiermee wordt een mediane overleving van 4 jaar bereikt.3
Een activerende epidermale-groeifactorreceptormutatie (EGFR-mutatie) komt voor bij ongeveer 10% van de patiënten met NSCLC. De derdegeneratie-EGFR-tyrosinekinaseremmer (TKI) osimertinib is de behandeling van keuze zowel in de palliatieve setting bij stadium IV als adjuvant na resectie van stadium IB-IIIA NSCLC bij patiënten met EGFR exon 19-deletie of L858R-puntmutatie.4,5 Bij stadium III NSCLC is een EGFR-mutatie geassocieerd met een lagere kans op lokale controle en een grotere kans op metastasering, ook in het centraal zenuwstelsel (CZS). Bovendien lijkt de effectiviteit van immuuntherapie met checkpointremmers zeer beperkt in aanwezigheid van een EGFR-mutatie.6
In de hier te bespreken LAURA-studie wordt de effectiviteit onderzocht van osimertinib als adjuvante therapie na chemoradiotherapie bij patiënten met stadium III EGFR-gemuteerd NSCLC.7 EMA heeft osimertinib geregistreerd voor patiënten met lokaal uitgebreid irresectabel NSCLC met een EGFR exon 19-deletie of exon 21 (L858R)-mutatie zonder ziekteprogressie na platinumbevattende chemoradiotherapie.
Kankersoort en lijn van behandeling
Adjuvante therapie met osimertinib werd onderzocht bij patiënten met een EGFR-gemuteerd irresectabel stadium III NSCLC, die geen progressie hadden na chemoradiotherapie.
Vergelijking met de referentiebehandeling in Nederland
In de LAURA-studie wordt osimertinib vergeleken met placebo. Volgens de huidige richtlijn NSCLC en het EMA-label kan aan patiënten met stadium III NSCLC ongeacht de mutatiestatus durvalumab als adjuvante behandeling worden gegeven. Er zijn echter sterke aanwijzingen dat immuuntherapie bij een EGFR-mutatie nauwelijks effectief is.6 In de praktijk wordt hier regelmatig al van afgezien. In de lijst Klinisch Noodzakelijke Targets (KNT) wordt geadviseerd bij NSCLC stadium III moleculair onderzoek te verrichten en alleen bij afwezigheid van een EGFR-mutatie adjuvant durvalumab te overwegen.8 Derhalve komt de referentiebehandeling vrijwel overeen met de Nederlandse praktijk.
Methoden van de studie
De LAURA-studie is een dubbelblind placebogecontroleerde gerandomiseerde multicenter fase III-studie. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1 en een lokaal gevorderd irresectabel stadium III NSCLC (8e editie IASLC), met een exon 19-deletie of L858R EGFR-mutatie (lokaal of centraal bepaald) te hebben. Een FDG-PET-scan ter uitsluiting van afstandsmetastasen was niet verplicht. Patiënten moesten behandeld zijn met gelijktijdige of sequentiële chemoradiotherapie die maximaal 6 weken voor inclusie in de studie was afgerond. Er mocht na de chemoradiotherapie geen sprake zijn van ziekteprogressie op CT van thorax en abdomen en MRI van de hersenen. De behandeling moest hebben bestaan uit minstens twee cycli platinumbevattende chemotherapie en 60 Gy (+/-10%) radiotherapie. Patiënten met aanhoudende bijwerkingen van graad 2 of hoger door de chemoradiatie en patiënten met een interstitiële longziekte mochten niet deelnemen.
Patiënten werden 2:1 gerandomiseerd tussen behandeling met osimertinib 80 mg of placebo eenmaal daags oraal ingenomen. Er werd gestratificeerd naar stadium (IIIA versus IIIB en IIIC), chemoradiatieschema (concurrent versus sequentieel) en afkomst (Chinese patiënten geïncludeerd in China versus niet-Chinese patiënten of patiënten geïncludeerd buiten China). De behandeling werd gestaakt bij progressie, onaanvaardbare toxiciteit of op verzoek van patiënt of arts. Dosisaanpassingen waren toegestaan volgens protocol. Bij progressie kon in beide groepen de behandeling gedeblindeerd worden en bestond de optie osimertinib open-label te continueren bij patiënten in de osimertinibgroep waarbij de inschatting was dat er nog klinisch voordeel was, of dit te starten bij patiënten in de placebogroep.
Responsmeting met CT-thorax en -abdomen en MRI-hersenen werd elke 8 weken verricht gedurende de eerste 48 weken en nadien elke 12 weken. Respons werd bepaald met RECIST 1.1. Toxiciteit werd bepaald volgens CTC-AE 5.0. Kwaliteit van leven werd onder andere bepaald met de vragenlijsten EORTC QLQ-LC13 en QLQ-C30 en de EQ-5D-5L, de eerste 8 weken wekelijks, nadien elke 4 weken. Data over vervolgbehandelingen zijn verzameld. Het primaire eindpunt van de studie was progressievrije overleving (PFS), onafhankelijk en geblindeerd centraal vastgesteld. De belangrijkste secundaire eindpunten waren overleving (OS), PFS zonder CZS-progressie, objectieve responskans (ORR), duur van de respons (DoR), kwaliteit van leven en veiligheid.
Voor de primaire analyse waren ongeveer 200 patiënten en 120 PFS-events nodig om met 90% power een hazard ratio (HR) van 0,53 (wat neerkomt op een mediane PFS van 8 maanden in de placebogroep en 15 maanden in de osimertinibgroep) vast te stellen met een tweezijdige alfa van 5%. Hierna werd er hiërarchisch getest: indien de PFS significant was werd vervolgens OS en daarna PFS zonder CZS-progressie getest met hergebruik van de alfa. Een interim-analyse voor OS vond plaats ten tijde van de PFS-analyse. De finale OS-analyse wordt verricht bij ongeveer 60% maturiteit (bij 120 overlijdens), waarbij de beschikbare alfa voor beide OS-meetpunten verdeeld wordt met de Lan-DeMets-spendingfunctie.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen
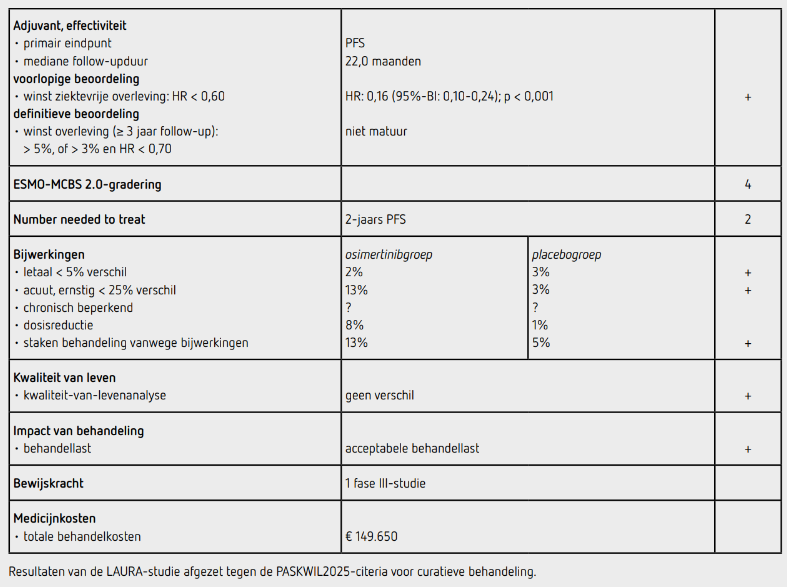
Tussen augustus 2018 en juli 2022 werden 216 patiënten gerandomiseerd: 143 in de osimertinibgroep en 73 in de placebogroep. Ongeveer 60% was vrouw, de mediane leeftijd was 63 jaar en 70% had nooit gerookt. Het percentage patiënten met een ECOG-performancestatus van 0 was met 56% versus 42% hoger in de osimertinibgroep dan in de placebogroep. In de osimertinibgroep en de placebogroep had respectievelijk 81% en 85% een Aziatische afkomst, 52% en 59% een EGFR exon 19-deletie en 92% en 85% ontving concurrente chemoradiotherapie. Ten tijde van de data-cutoff (5 januari 2024) was 44% van de patiënten in de osimertinibgroep en 90% van de patiënten in de placebogroep gestopt met de behandeling. De mediane follow-upduur was 22,0 maanden in de osimertinibgroep en 5,6 maanden in de placebogroep. Ten tijde van deze finale PFS-analyse hadden zich 120 events voorgedaan, 57 in de osimertinibgroep en 63 in de placebogroep. De mediane PFS in de osimertinibgroep was 39,1 maanden (95%-BI: 31,5-niet bereikt) en 5,6 maanden (95%-BI: 3,7-7,4) in de placebogroep, met een HR van 0,16 (95%-BI: 0,10-0,24; p < 0,001). De PFS na 12 en 24 maanden was 74% en 65% in de osimertinibgroep, en 22% en 13% in de placebogroep. Dit verschil in PFS werd gezien in alle vooraf gespecificeerde subgroepen. Het risico op optreden van hersenmetastasen was lager bij osimertinib dan bij placebo (8% versus 29%).
Ten tijde van de geplande interim-analyse voor OS waren 43 patiënten overleden (20% maturiteit). De 3-jaars OS was 84% in de osimertinibgroep en 74% in de placebogroep (HR: 0,81 [95%-BI: 0,42-1,56]; p = 0,53).
Alle geïncludeerde patiënten hadden ten minste 1 dosis medicatie ontvangen. De mediane behandelduur was 24,0 maanden in de osimertinibgroep en 8,3 maanden in de placebogroep. Behandelingsgerelateerde bijwerkingen van graad 3 of hoger kwamen voor bij 19 patiënten (13%) in de osimertinibgroep en bij 2 patiënten (3%) in de placebogroep. Radiatiepneumonitis in alle graderingen kwam voor in 48% versus 38% respectievelijk, waarbij in 87% van de gevallen de osimertinib gecontinueerd of hervat kon worden. In de osimertinibgroep kregen 12 patiënten (8%) ten minste 1 dosisreductie en staakten 18 patiënten (13%) de behandeling vanwege bijwerkingen. In de placebogroep kreeg 1 patiënt (1%) ten minste 1 dosisreductie en 4 patiënten (5%) staakten de behandeling vanwege bijwerkingen. In de osimertinibgroep zijn 3 patiënten (2%) overleden als gevolg van een bijwerking (pneumonitis, pneumonie en verkeersongeval) en in de placebogroep zijn 2 patiënten (3%) overleden (myocardinfarct en aortaruptuur).
Analyse van kwaliteit van leven liet geen verschil tussen beide groepen zien.9 Na progressie kregen 42 patiënten (29%) in de osimertinibgroep een vervolgbehandeling, waarvan 15 patiënten (24%) osimertinib en 21 patiënten (33%) chemotherapie. In de placebogroep kregen 57 patiënten (78%) een vervolgbehandeling na progressie, waarvan 51 patiënten (77%) osimertinib en 11 patiënten (17%) chemotherapie.
Kwaliteit van de studie en interpretatie van de uitkomsten
De LAURA-studie is een dubbelblind placebogecontroleerde fase III-studie. OS is geen primair eindpunt in deze adjuvante studie. De studie is ook niet gepowerd op het aantonen van een overlevingsvoordeel. PFS is in deze setting met nog restafwijkingen na chemoradiotherapie een terecht eindpunt in plaats van ziektevrije overleving (DFS). Opvallend is dat er een objectieve respons werd gemeten van de reeds eerder bestraalde laesie. Dit is niet zinvol of logisch en wordt derhalve ook niet in dit rapport beschreven.
De placebogroep wordt behandeld conform de huidige standaard in Nederland. Minder dan 20% van de patiënten was niet-Aziatisch. In deze kleine subgroep was de HR 0,48 (95%-BI: 0,20-1,19). Omdat de werking van osimertinib mutatiegedreven is, is de verwachting dat de resultaten van de studie te extrapoleren zijn naar de niet-Aziatische populatie. De onbeperkte behandelduur lijkt een logische keuze omdat in vergelijkbare studies veel patiënten recidief of metastasen ontwikkelden binnen 1 jaar na het beëindigen van de behandeling10, en er bij neoadjuvante osimertinib geen complete responsen worden gezien.11 Anderzijds is de basis van adjuvante behandeling het vergroten van de kans op genezing en niet het uitstellen van de tijd tot recidief door behandeling. Een goede selectiemethode om te bepalen welke patiënt voordeel heeft van adjuvante therapie ontbreekt echter. Ook de mogelijkheid van doorbehandelen met osimertinib na progressie is de gangbare praktijk bij geselecteerde patiënten met langzame of beperkte progressie.
Cross-over naar osimertinib in de placebogroep was toegestaan en werd gegeven in 86% van de patiënten in de placebogroep met progressie. Dit is hoog, ondanks het feit dat osimertinib niet vanuit het studieteam verstrekt lijkt te zijn. Ook zit er een niet goed te verklaren verschil van 15 maanden tussen de mediane behandelduur van 24 maanden en de mediane PFS van 39 maanden met weinig staken van medicatie en wel de optie om door te gaan na progressie. Dit maakt de schatting van de werkelijke kosten van de behandeling minder betrouwbaar. De placebogroep had iets slechtere uitgangskarakteristieken met 14% meer ECOG-performancestatus 1 (58 vs. 44%). Dit heeft mogelijk de resultaten van de (nog immature) OS beïnvloed.
Discussie
In de LAURA-studie wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt PFS van adjuvante behandeling met osimertinib vergeleken met placebo na chemoradiatie bij stadium III NSCLC met een EGFR-mutatie, met een toename van de mediane PFS van 33,5 maanden met een HR van 0,16. Deze resultaten voldoen aan de PASKWIL2025-criteria voor curatieve behandeling voor een voorlopig positief advies.
De finale OS-analyse volgt nog; bij 20% maturiteit is de OS bij de interim-analyse niet significant verschillend met 86% cross-over in de placebogroep naar osimertinib bij progressie. De behandeling wordt goed verdragen en leidt niet tot afname van de kwaliteit van leven. Er werd geen significant verschil gezien in het optreden van radiatiepneumonitis; deze waren meestal mild, net als bij het optreden van interstitiële pneumonitis. Osimertinib lijkt daarmee veilig in deze populatie. Bij een stadium III NSCLC is het bepalen van de mutatiestatus momenteel al geadviseerd waardoor er geen extra diagnostiek hoeft te worden verricht. De PFS in de placebogroep is korter dan gebruikelijk in stadium III NSCLC na chemoradiotherapie. Dit kan komen door een niet-adequate stadiëring van stadium III aangezien een PET-scan niet verplicht was waardoor stadium IV ziekte gemist kan zijn. Tevens speelt mogelijk mee dat een EGFR-mutatie bij stadium III een negatieve prognostische waarde heeft. Dat roept vervolgens de vraag op of dit nog wel een adjuvante therapie is of een heel vroege behandeling van stadium IV ziekte. Omdat bij stadium III NSCLC sprake is van een curatieve behandelintentie is deze studie wel volgens de adjuvante PASKWIL-criteria beoordeeld.
Met dit grote verschil in PFS maar zonder significant OS-verschil in de interim-analyse voor OS is het voordeel van direct starten na chemoradiotherapie ten opzichte van starten bij progressie op dit moment nog niet aangetoond. De finale OS-analyse zal hier te zijner tijd uitsluitsel over geven.
Kosten
Osimertinib 80 mg kost per dag 205 euro (bron: medicijnkosten.nl d.d. december 2025). Bij een mediane behandelduur van 24 maanden zijn de totale kosten 149.650 euro. Mogelijk zijn de werkelijke kosten hoger gezien de mediane PFS van 39 maanden en de optie tot doorbehandelen na progressie.
Conclusie
In de hier besproken LAURA-studie wordt bij patiënten met irresectabel stadium III NSCLC met een EGFR-mutatie zonder progressie na chemoradiotherapie een statistisch significant langere PFS gezien door adjuvante behandeling met osimertinib ten opzichte van placebo (HR: 0,16 [95%-BI: 0,10-0,24]; p < 0,001). De OS-data zijn immatuur. Dit resultaat voldoet aan de criteria voor een voorlopig positief advies volgens de PASKWIL2025-criteria voor curatieve behandeling. De kosten zijn hoog.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Durvalumab als consolidatietherapie na chemoradiatie bij stadium III NSCLC. Med Oncol 2020;23(10):31-5.
- Faivre-Finn C, Vicente D, Kurata T et al. Durvalumab after chemoradiotherapy in stage III NSCLC: 4-year survival update from the phase III PACIFIC trial. Ann Oncol 2020;31(suppl_4):S1142-215.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Osimertinib als eerstelijns behandeling voor patiënten met EGFR-gemuteerd niet-kleincellig longcarcinoom. Med Oncol 2018;21(7):57-60.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Osimertinib als adjuvante therapie bij patiënten met een gereseceerd EGFR-gemuteerd niet-kleincellig longcarcinoom Med Oncol 2023;26(8):33-4.
- Gainor JF, Shaw AT, Sequist LV et al. EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non–small cell lung cancer: A retrospective analysis. Clin Cancer Res 2016;22(18):4585-93.
- Lu S, Kato T, Dong X et al. Osimertinib after chemoradiotherapy in stage III EGFR mutated NSCLC. N Engl J Med 2024;391(7):585-97.
- KNT-lijsten (nvmo.org/zorg/moleculaire-diagnostiek/knt-lijsten)
- Arriola Aperribay E, Casarini I, Ozurgulu M et al. Patient-reported outcomes (PROs) from the LAURA study: Osimertinib (osi) in patients with unresectable (UR) stage III EGFR-mutated (EGFRm) non-small cell lung cancer (NSCLC) without progression after definitive chemoradiotherapy (CRT). J Thorac Oncol 2025;20(3S1):S133-4.
- Tada H, Mitsudomi T and Misuma T. Randomized phase III study of gefitinib versus cisplatin plus vinorelbine for patients with resected stage II-IIIA NSCLC with EGFR mutation (IMPACT). J Clin Oncol 2022;40:231-41.
- Blakely CM, Urisman A, Gubens MA et al. Neo-adjuvant osimertinib for the treatment of stage I-IIIA EGFR mutated NSCLC: a phase 2 multicenter study. J. Clin Oncol 2024;42:3105-14