Inleiding
De incidentie van het cervixcarcinoom in Nederland is de laatste decennia stabiel met 700 tot 800 diagnoses per jaar.1 Naar verwachting zal de incidentie door het ingestelde HPV-vaccinatieprogramma in de toekomst afnemen. Door radicale chirurgische en radio(chemo)therapeutische behandelmogelijkheden is de prognose in het vroege stadium van de ziekte (< FIGO IIa, tumor beperkt tot de cervix) goed. Zowel bij gerecidiveerde als bij gevorderde of gemetastaseerde ziekte is de prognose somber, met een 5-jaarsoverleving van 10 procent.2 Jaarlijks overlijden ruim 200 patiënten in Nederland aan cervixcarcinoom.
De behandelmogelijkheden bij het gevorderd of gemetastaseerd cervixcarcinoom bestaan uit chemotherapie (cisplatine gecombineerd met paclitaxel of topotecan3 of carboplatine met paclitaxel). In de GOG 240-studie waarin het toevoegen van bevacizumab aan chemotherapie werd onderzocht, was de mediane overleving in de groep patiënten behandeld met chemotherapie en bevacizumab 17 maanden, waarbij het toevoegen van bevacizumab aan een cisplatine-bevattend regime resulteerde in een mediane overlevingswinst van bijna 4 maanden.4 Momenteel worden meerdere checkpointremmers in de behandeling van het cervixcarcinoom onderzocht. In de hier te bespreken KEYNOTE-826-studie wordt behandeling met pembrolizumab vergeleken met placebo bij patiënten met een persisterend, recidiverend of gemetastaseerd cervixcarcinoom.5 De EMA heeft pembrolizumab in combinatie met chemotherapie met of zonder bevacizumab geregistreerd voor de behandeling van volwassen patiënten met een persisterend, recidiverend of gemetastaseerd cervixcarcinoom met een PD-L1-expressie met een combined positive score (CPS) van 1 of hoger.
1. Kankersoort en lijn van behandeling
Pembrolizumab met chemotherapie werd vergeleken met placebo met chemotherapie bij patiënten met een cervixcarcinoom waarbij er geen curatieve behandelopties waren en patiënten niet eerder met systemische chemotherapie waren behandeld.
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland wordt aan patiënten met een cervixcarcinoom in de palliatieve setting systemische behandeling gegeven bestaande uit carboplatine of cisplatine in combinatie met paclitaxel. Bevazicumab kan toegevoegd worden aan een cisplatine-bevattend regime. De standaardarm in deze studie voldoet hiermee aan de referentiebehandeling in Nederland.
3. Methode en kwaliteit van de studie
De KEYNOTE-826 is een dubbelblind gerandomiseerde fase III-multicenterstudie voor patiënten met een persisterend, recidiverend of gemetastaseerd cervixcarcinoom. Patiënten met een adeno-, adenosquameus- of plaveiselcarcinoom konden geïncludeerd worden. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn, een ECOG-performancestatus van 0 of 1 te hebben en goede orgaanfuncties. Patiënten mochten geen eerdere systemische behandeling voor het cervixcarcinoom hebben gehad. Patiënten mochten eerder behandeld zijn met (chemo)radiotherapie, maar deze behandeling moest ten minste 2 weken voor randomisatie zijn afgerond en bijwerkingen van deze behandeling mochten niet meer aanwezig zijn. Indien patiënten palliatieve radiotherapie hadden gehad voor metastasen buiten het centraal zenuwstelsel, dan was 1 week interval voldoende. Ook moest tumorweefsel beschikbaar zijn om de PD-L1-status vast te kunnen stellen.
Exclusiecriteria waren: groeiende metastasen in het centraal zenuwstelsel, actieve auto-immuunziekten, actieve infectie waarvoor behandeling nodig is, actieve virale hepatitis, hiv-infectie en immuundeficiëntie of actieve behandeling met immunosuppressiva of steroïden (gelijkwaardig aan > 10 mg prednisolon per dag).
Patiënten werden 1:1 gerandomiseerd tussen behandeling met pembrolizumab en placebo met chemotherapie, met of zonder bevacizumab. De behandeling werd gestratificeerd naar het aanwezig zijn van metastasen bij primaire diagnose (ja versus nee), geplande behandeling met bevacizumab (ja versus nee) en PD-L1-expressie (CPS < 1 versus 1 tot 10 versus 10 of hoger).
Pembrolizumab (200 mg flat dose) werd iedere 3 weken i.v. toegediend met een maximum van 35 cycli. Alle patiënten werden behandeld met paclitaxel 175 mg/m2 gecombineerd met cisplatine 50 mg/m2 of carboplatine AUC5 op dag 1 van een 3-wekelijks schema. De onderzoeker bepaalde of patiënten cisplatine of carboplatine kregen. Ook kon de onderzoeker bepalen of bevacizumab in een dosering van 15 mg/kg aan elke cyclus werd toegevoegd. Alle middelen werden intraveneus toegediend. Bij het tweede protocolamendement werd het aantal kuren met platinum en paclitaxel gelimiteerd tot maximaal 6, waarbij er een uitzondering gemaakt kon worden door de sponsor als er sprake was van ongoing clinical benefit zonder onacceptabele bijwerkingen.
Dosisreductie van alle middelen behalve pembrolizumab werd toegestaan. De behandeling met pembrolizumab kon maximaal 12 weken uitgesteld worden. De behandeling werd gestaakt na het bereiken van het maximumaantal cycli, bij ziekteprogressie, om veiligheidsredenen, vanwege het starten van een andere oncologische behandeling of bij het intrekken van toestemming. De behandeling mocht worden gestaakt indien er sprake was van een bevestigde complete respons na ten minste 8 cycli pembrolizumab, met ten minste 2 cycli na het bereiken van een complete respons. De duale primaire eindpunten van de studie waren overleving (OS) en progressievrije overleving (PFS) volgens RECIST 1.1 vastgesteld door de onderzoeker. Secundaire eindpunten waren het percentage patiënten met een bevestigde complete of partiële respons, de responsduur en het percentage nog levende patiënten zonder ziekteprogressie na 12 maanden op basis van RECIST 1.1 vastgesteld door de onderzoeker.
Ook waren secundaire eindpunten de PFS na centrale beoordeling en de veiligheid van de behandeling. Vooraf bepaalde exploratieve analyses betroffen de tijd tot verslechtering en de proportie patiënten met een verbeterde of stabiele visueel analoge schaal van de EQ-5D-5L.
Effectiviteit werd getest in de intention to treatpopulatie (ITT-populatie) en veiligheid werd getest bij alle behandelde patiënten. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.0. Tumormeting werd gedaan met een CT-thorax en MRI-scan van de buik bij start, vervolgens iedere 9 weken gedurende de eerste 54 weken, daarna iedere 12 weken tot ziekteprogressie, start nieuwe behandeling of intrekken van toestemming. Indien patiënten botmetastasen en/of hersenmetastasen hadden, werden bij screening en tijdens de behandeling ook botscans en MRI’s van het cerebrum verricht.
De PD-L1-expressie werd tijdens de screeningsperiode centraal bepaald door middel van de IHC 22C3 pharmDx assay (Agilent Technologies); vervolgens werd de expressie in tumor en het omgevende stroma berekend met behulp van de CPS waarbij zowel 1 als 10 als afkapwaarden werden gebruikt.
In het ontwerp van de studie waren 600 patiënten nodig waarvan de verwachting was dat 510 patiënten een PD-L1 expressie met een CPS van 1 of hoger en 300 patiënten een CPS van 10 of hoger zouden hebben. Met ongeveer 435 patiënten met ziekteprogressie en ongeveer 378 overleden patiënten in de ITT-populatie met CPS van 1 of hoger is er circa 90 procent power met een eenzijdige alfa van 0,004 om een hazard ratio (HR) van 0,68 voor ziekteprogressie of een HR van 0,70 voor overlijden vast te kunnen stellen met een eenzijdige alfa van 0,016.
Binnen de coprimaire eindpunten OS en PFS was een hiërarchische analyse gepland: eerst PFS bij patiënten met een PD-L1-expressie met een CPS van 1 of hoger, dan PFS in de ITT-populatie en ten slotte PFS in de subgroep van patiënten met een PD-L1 expressie met een CPS van 10 of hoger, vervolgens OS bij patiënten met een PD-L1-expressie met een CPS van 1 of hoger, OS in de ITT-populatie, en OS bij patiënten met een PD-L1-expressie met een CPS 10 of hoger.
Het studieprotocol voorzag in twee interim-analyses. De eerste interim-analyse, waarvan de resultaten hier gepresenteerd zijn, was gepland bij progressie of overlijden van ongeveer 370 patiënten en overlijden van 246 patiënten, beide in de groep patiënten met een tumor-CPS van 1 of hoger. De eenzijdig alfa van 0,025 werd verdeeld over deze zes eindpunten, de definitieve analyse en twee interimanalyses, en gecorrigeerd voor meervoudig testen. De alfa die uiteindelijk voor de verschillende primaire eindpunten gebruikt werd bij de eerste interim-analyse was hierdoor een stuk lager, namelijk voor progressie of overlijden 0,00144 bij een CPS van 1 of hoger, 0,00128 in de ITT-populatie en 0,00196 bij een CPS van 10 of hoger. Voor overlijden was de geplande alfa 0,00549 bij een CPS van 1 of hoger, 0,00491 in de ITT-populatie en 0,0115 bij een CPS van 10 of hoger.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen november 2018 en januari 2020 werden 883 patiënten gescreend door 151 centra in 19 landen. Uiteindelijk werden 617 patiënten geïncludeerd: 308 patiënten in de pembrolizumab- groep en 309 patiënten in de placebogroep. Op het moment van deze eerste interim-analyse (data-cutoff mei 2021) bedroeg de mediane follow-up 22,0 maanden (range: 15,1-29,4). Eén patiënt in de pembrolizumab-groep heeft geen pembrolizumab-behandeling gekregen. Op het moment van data-cutoff werden in de pembrolizumab-groep 104 patiënten (33,9 procent) en in de placebogroep 54 patiënten met nog ten minste één middel behandeld.
De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 50 jaar, iets meer dan de helft had een Kaukasische achtergrond, 55 procent had een ECOG-performancestatus van 0, ongeveer 20 procent had bij randomisatie niet eerder behandelde gemetastaseerde ziekte en 55 procent van de patiënten had eerdere behandeling met radiochemotherapie, al dan niet in combinatie met chirurgie, gehad. Ongeveer 63 procent van de patiënten kreeg behandeling met bevacizumab. In de pembrolizumab-groep en de placebogroep had respectievelijk 18,2 en 27,2 procent een adenocarcinoom. Bij respectievelijk 37,3 en 37,5 procent van de patiënten had het cervixcarcinoom een PD-L1-expressie met een CPS van 1 tot 10 en bij respectievelijk 51,3 en 51,5 procent was de CPS 10 of hoger.
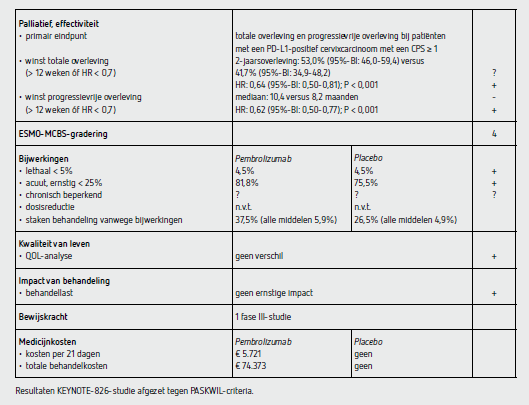
Het duale primaire eindpunt PFS was significant beter in de pembrolizumab-groep dan in de placebogroep bij patiënten met een PD-L1-expressie met een CPS van 1 of hoger (HR: 0,62 [95%-BI: 0,50-0,77]; P < 0,001). De mediane PFS was in de pembrolizumab-groep 10,4 maanden (95%-BI: 9,7-12,3) en in de placebogroep 8,2 maanden (95%-BI: 6,3-8,5). In de ITT-populatie en de groep patiënten met een PD-L1-expressie met een CPS van 10 of hoger waren de mediane PFS in de pembrolizumab-groep en placebogroep vergelijkbaar met de patiënten met een PD-L1-expressie met een CPS van 1 of hoger. Het percentage patiënten zonder progressie na 12 maanden in de groep patiënten met een PD-L1-expressie met een CPS van 1 of hoger was 45,5 procent (95%-BI: 39,2-51,5) in de pembrolizumab-groep en 34,1 procent (95%-BI: 28,3-40,0) in de placebogroep (Δ 11,4 procent). De centraal onafhankelijk beoordeelde PFS in de groep patiënten met een PD-L1-expressie met een CPS van 1 of hoger was vergelijkbaar met de PFS zoals door de onderzoeker vastgesteld: mediaan 12,8 en 8,3 maanden respectievelijk voor de pembrolizumab-groep en de placebogroep (HR: 0,60 [95%-BI 0,48-0,75]).
Het duale primaire eindpunt OS was ook significant beter in de pembrolizumab-groep dan in de placebogroep bij patiënten met een PD-L1-expressie met een CPS van 1 of hoger (HR: 0,64 [95%-BI: 0,50-0,81]; P < 0,001). De geschatte 2-jaarsoverleving was respectievelijk 53,0 procent (95%-BI: 46,0-59,4) en 41,7 procent (95%-BI: 34,9-48,2) in de pembrolizumab-groep en de placebogroep. In de ITT-populatie en de groep patiënten met een PD-L1-expressie met een CPS van 10 of hoger was de geschatte 2-jaarsoverleving in de pembrolizumab- groep en placebogroep vergelijkbaar met de groep patiënten met een PD-L1-expressie met een CPS van 1 of hoger. De mediane OS was nog niet bereikt in de subgroepen op basis van PD-L1-expressie. In de vooraf gedefinieerde subgroepanalyses was er voor zowel PFS als OS een verbetering in de pembrolizumab-groep ten opzichte van de placebogroep voor patiënten jonger dan 65 jaar en concomitant bevacizumabgebruik. Voor patiënten met metastasen bij diagnose was er geen verschil tussen de pembrolizumab-groep en de placebogroep.
Het aantal patiënten met een bevestigde respons was 68,1 procent (complete respons 22,7 procent) in de pembrolizumab- groep en 50,2 procent (complete respons 13,1 procent) in de placebogroep bij patiënten met een PD-L1-expressie met een CPS van 1 of hoger (Δ 17,9 procent). De mediane behandelduur was 10,0 maanden in de pembrolizumabgroep en 7,7 maanden in de placebogroep. Het mediane aantal toegediende cycli pembrolizumab was 13 (range: 1-35).
In totaal 81,8 procent van de patiënten behandeld met pembrolizumab en 75,1 procent van de patiënten behandeld met placebo had ten minste één bijwerking van graad 3 of hoger. Bijwerkingen die resulteerden in het beëindigen van één van de middelen traden op bij respectievelijk 37,5 en 26,5 procent van de patiënten behandeld met pembrolizumab of placebo. Ten gevolge van bijwerkingen werd de hele behandeling gestopt in respectievelijk 5,9 en 4,9 procent van de patiënten behandeld met pembrolizumab of placebo. In beide groepen overleden 14 patiënten tijdens de behandeling. In de pembrolizumab-groep werden 2 overlijdens (0,7 procent) toegeschreven aan de behandeling en in de placebogroep 4 overlijdens (1,3 procent). De meest voorkomende bijwerkingen van graad 3 of hoger waren anemie (30,3 versus 26,9 procent), neutropenie (12,4 versus 9,7 procent) en hypertensie (9,4 versus 10,7 procent).
De meest voorkomende aan immuuntherapie gerelateerde bijwerkingen van graad 3 of hoger (totaal 11,4 procent) waren huidreactie (3,9 procent), colitis (1,6 procent) en hypothyreoïdie (1,3 procent). In de pembrolizumab-groep overleed 1 patiënt ten gevolge van een immuungerelateerde bijwerking (encefalitis).
De kwaliteit-van-levenanalyse liet zien dat de tijd tot verslechtering langer was in de pembrolizumab-groep dan in de placebogroep (geschatte 1 jaar zonder verslechtering: 58,2 versus 44,8 procent met een HR van 0,75 [95%-BI: 0,58-0,97]).
Discussie
In de dubbelblind gerandomiseerde fase III-multicenterstudie KEYNOTE-826 wordt een statistisch significant voordeel aangetoond voor de duale primaire eindpunten PFS en OS voor het toevoegen van pembrolizumab aan chemotherapie al dan niet met bevacizumab, zowel bij patiënten met een PD-L1-expressie met een CPS van 1 of hoger als in de ITT-populatie en bij de patiënten met een CPS van 10 of hoger. De resultaten van deze eindpunten, waarbij het eindpunt OS belangrijker is dan het eindpunt PFS, voldoen aan de PASKWIL-criteria voor palliatieve studies voor een positief advies.
Het PFS- en OS-voordeel voor pembrolizumab werd gezien in meerdere geplande subgroepanalyses. De EMA heeft pembrolizumab geautoriseerd voor patiënten met een PD-L1-expressie met een CPS van 1 of hoger. Een in opdracht van de EMA uitgevoerde nietgeplande subgroepanalyse voor PFS bij patiënten met een CPS lager dan 1 (11 procent van de ITT-populatie) toonde een HR van 0,94 met een zeer breed 95%-BI waaruit geen effect voor deze subgroep blijkt. In de studie kon door de onderzoeker gekozen worden tussen behandeling met cisplatine of carboplatine. Hoeveel patiënten in beide groepen met welk middel behandeld zijn, valt niet te achterhalen. Wel kregen de meeste patiënten 6 cycli met chemotherapie, zoals in Nederland ook meestal voorgeschreven wordt.
Het in deze studie beschreven bijwerkingenprofiel van pembrolizumab komt overeen met wat bekend is van andere studies. De behandeling wordt over het algemeen goed verdragen en de bijwerkingen zijn hanteerbaar.
5. Kosten
De behandeling met pembrolizumab 200 mg kost 5.721 euro per behandelcyclus van 21 dagen (bron: medicijnkosten.nl d.d. 11 maart 2022). De mediane behandelduur is 13 cycli. De extra medicatiekosten komen daarmee op 74.373 euro per patiënt.
Conclusie
In de hier besproken KEYNOTE-826-studie wordt bij patiënten met een progressief gerecidiveerd of gemetastaseerd cervixcarcinoom een statistisch significant langere PFS en OS gezien bij de patiënten die naast platinumbevattende chemotherapie, met of zonder bevacizumab, ook behandeling met pembrolizumab kregen. De EMA heeft deze behandeling geautoriseerd voor patiënten met een PD-L1- expressie met een CPS van 1 of hoger. Het duale primaire eindpunt PFS was significant beter in de pembrolizumabgroep dan in de placebogroep bij patiënten met een PD-L1- expressie met een CPS van 1 of hoger (HR: 0,62 [95%-BI: 0,50-0,77]; P < 0,001). De mediane PFS was in de pembrolizumab- groep 10,4 maanden (95%-BI: 9,7-12,3) en in de placebogroep 8,2 maanden (95%-BI: 6,3-8,5). Ook het primaire eindpunt OS was significant beter in de pembrolizumab- groep dan in de placebogroep bij patiënten met een PD-L1-expressie met een CPS van 1 of hoger (HR: 0,64 [95%-BI: 0,50-0,81]; P < 0,001). De geschatte 2-jaarsoverleving was respectievelijk 53,0 procent (95%-BI: 46,0-59,4) en 41,7 procent (95%-BI: 34,9-48,2) in de pembrolizumabgroep en de placebogroep. De huidige resultaten voldoen aan de criteria voor een positief advies volgens de PASKWIL-criteria voor palliatieve behandeling.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Wenzel HHB, Bekkers RLM, Lemmens VEPP, et al. No improvement in survival of older women with cervical cancer: a nationwide study. Eur J Cancer 2021;151:15967.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Cisplatine in combinatie met topotecan bij gerecidiveerd of gemetastaseerd cervixcarcinoom. Med Oncol 2008;11(1):4950.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Bevacizumab bij de palliatieve behandeling van het cervixcarcinoom. Med Oncol 2015;18(4):2730.
- Colombo N, Dubot C, Lorusso D, et al; KEYNOTE826 Investigators. Pembrolizumab for persistent, recurrent, or metastatic cervical cancer. N Engl J Med 2021;385(20):185667.