
1. Inleiding
In Nederland wordt jaarlijks bij ongeveer 1.600 patiënten de diagnose maagcarcinoom of carcinoom van het gastro-oesofageale overgangsgebied gesteld. De meeste patiënten presenteren zich met irresectabele of gemetastaseerde ziekte en hebben een slechte prognose. De 5-jaarsoverleving is 5 tot 20 procent en de mediane overleving van gemetastaseerd maagcarcinoom is minder dan 1 jaar. In 95 procent van de gevallen betreft het een adenocarcinoom.1 De landelijke richtlijn stelt dat het standaardbeleid bij lokaal voortgeschreden of gemetastaseerd maagcarcinoom bij patiënten in een goede conditie bestaat uit chemotherapie, eventueel gecombineerd met doelgerichte therapie. De eerstelijnsbehandeling is meestal in de vorm van 5-FU/ capecitabine in combinatie met een platinumderivaat (bij voorkeur oxaliplatine gezien het gunstiger bijwerkingenprofiel ten opzichte van cisplatine), gecombineerd met trastuzumab indien sprake is van HER2-overexpressie.2 Nivolumab is geregistreerd voor de eerstelijnsbehandeling van HER2-negatief gevorderd of gemetastaseerd adenocarcinoom van de maag, gastrooesofageale overgang of oesofagus waarbij de tumor PDL1expressie vertoont met een combined positive score (CPS) ≥ 5, in combinatie met fluoropyrimidine en platinabevattende chemotherapie en werd voor deze indicatie positief beoordeeld door cieBOM.3
In de hier te bespreken KEYNOTE-859-studie wordt behandeling met chemotherapie (CAPOX of cisplatine-5-FU) vergeleken met chemotherapie met pembrolizumab bij patiënten met een lokaal gevorderd of gemetastaseerd HER2-negatief adenocarcinoom van de maag of gastrooesofageale overgang.4 EMA heeft pembrolizumab in combinatie met fluoropyrimidine en platinumbevattende chemotherapie goedgekeurd voor de eerstelijnsbehandeling van het lokaal gevorderd, inoperabel of gemetastaseerd HER2-negatief adenocarcinoom van de maag of van de gastrooesofageale overgang bij volwassenen bij wie de tumor PD-L1-expressie vertoont met een CPS ≥ 1.
2. Kankersoort en lijn van behandeling
Eerstelijns palliatieve behandeling met pembrolizumab en chemotherapie werd onderzocht bij patiënten met een gemetastaseerd HER2-negatief adenocarcinoom van de maag of gastro-oesofageale overgang.
3. Vergelijking met de referentiebehandeling in Nederland
In Nederland wordt aan patiënten met een gemetastaseerd HER2-negatief adenocarcinoom van de maag, gastro-oesofageale overgang of oesophagus een systemische behandeling gegeven met chemotherapie bestaande uit een combinatie van een 5-FU-derivaat en een platinumderivaat (oxaliplatine of cisplatine). De inclusieperiode van de KEYNOTE-859-studie liep van 2018 tot 2021. In die periode was de toevoeging van nivolumab aan eerstelijnsbehandeling met chemotherapie nog geen standaard zorg waarmee de controlegroep van deze studie overeenkomt met de destijds geldende Nederlandse praktijk.
4. Methode en kwaliteit van de studie
De KEYNOTE-859-studie is een dubbelblind placebogecontroleerde gerandomiseerde fase III-multicenterstudie voor patiënten met een histologisch of cytologisch bevestigde diagnose van lokaal gevorderd, inoperabel of gemetastaseerd HER2-negatief adenocarcinoom van de maag of gastrooesofageale overgang. HER2-negativiteit was gedefinieerd als IHC 0 of 1+ of ISH-negatief. Overige inclusiecriteria waren een bekende PD-L1-expressiestatus, leeftijd 18 jaar of ouder en ECOG-performancestatus van 0 of 1. Exclusiecriteria waren onder meer perifere neuropathie graad 2 of hoger, eerdere therapie gericht tegen PD-1, PD-L1 of PD-L2, en operatie in de vier weken voorafgaand aan randomisatie.
Patiënten werden 1:1 gerandomiseerd tussen de interventiegroep (pembrolizumab 200 mg intraveneus elke drie weken, gecombineerd met cisplatine-5-FU of CAPOX) en de placebogroep (placebo plus cisplatine-5-FU of CAPOX). Cisplatine-5-FU bestond uit fluorouracil 800 mg/m2 continu intraveneus per dag op dag 1 tot 5 elke 3 weken en cisplatine 80 mg/m2 intraveneus op dag 1 elke 3 weken. CAPOX bestond uit capecitabine 1000 mg/m2 tweemaal daags per os gedurende 14 dagen elke 3 weken en oxaliplatine 130 mg/m2 intraveneus op dag 1 elke 3 weken. De soort chemotherapie was naar keuze van de behandelend arts. Pembrolizumab werd gedurende maximaal 35 cycli gegeven, oxaliplatine en cisplatine mochten na 6 cycli gestaakt worden. De behandeling werd gestratificeerd naar regio (West-Europa, Israël, Noord-Amerika en Australië versus Azië versus de rest van de wereld), PD-L1 CPS (< 1 versus ≥ 1) en soort chemotherapie (cisplatine-5-FU versus CAPOX). Cross-over tussen behandelgroepen was niet toegestaan. De toediening van alle middelen mocht worden uitgesteld of onderbroken (met een maximum van 12 weken voor pembrolizumab). Radiologische evaluatie middels CT- of MRI-scan, geblindeerd en centraal beoordeeld middels RECIST 1.1, werd elke 6 weken verricht. Het primaire eindpunt was overleving (OS). De secundaire eindpunten waren progressievrije overleving (PFS), objectieve respons (OR), en duur van de respons (DoR). Vooraf vastgestelde exploratieve eindpunten waren tijdtotverslechtering en pijnscores, gemeten door middel van de vragenlijsten European Organisation for Research and Treatment of Cancer (EORTC) QLQ-C30 en QLQ-STO22.
Het oorspronkelijke doel van de studie was inclusie van 780 patiënten, maar na analyse van de KEYNOTE-062-resultaten5 werd dit verhoogd naar 1542 patiënten. In november 2022 werd de inclusie verder verhoogd naar 1579 patiënten om patiënten uit China, waar de studie pas laat geopend was voor inclusie, de kans te geven in deze studie te participeren. De geplande grootte van de groep patiënten met CPS ≥ 1 was 1235 en voor CPS ≥ 10 551. De eenzijdige alfa van 0,025 werd verdeeld over verschillende toetsen; initieel werd een grens van 0,008 gebruikt voor de analyse van de OS in de intention-to-treat (ITT)-populatie en 0,017 voor OS in het cohort met CPS ≥ 10. Als de OS in het cohort met CPS ≥ 10 significant was werd de OS getest bij patiënten met CPS ≥ 1 met dezelfde eenzijdige alfa van 0,017 en PFS bij patiënten met CPS ≥ 10 met een alfa van 0,0001. In totaal waren in de ITT-populatie 1358 overlijdens nodig om met 84 procent power en een eenzijdige alfa van 0,008 een hazard ratio (HR) van 0,83 vast te kunnen stellen voor overlijden. In het cohort met CPS ≥ 1 waren 1057 overlijdens nodig om met 90 procent power en een eenzijdige alfa van 0,017 een HR van 0,81 vast te kunnen stellen voor overlijden. In het cohort met CPS ≥ 10 waren 463 overlijdens nodig om met 87 procent power en een eenzijdige alfa van 0,017 een HR van 0,73 vast te kunnen stellen voor overlijden. Een interim-analyse was gepland na 403 OS-events in het cohort met CPS ≥ 10, ongeveer 12 maanden na randomisatie van de laatste patiënt. In dit rapport worden de resultaten van deze interim-analyse weergegeven.
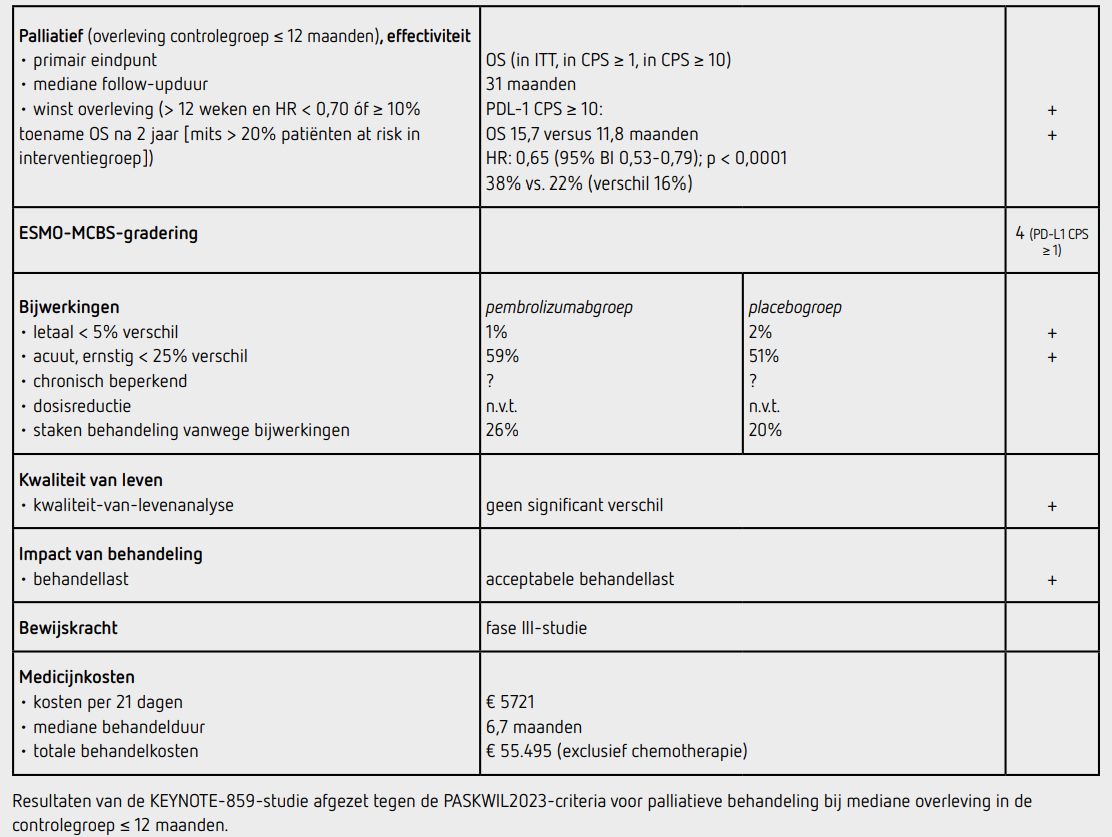
5. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen 8 november 2018 en 11 juni 2021 werden 2409 patiënten gescreend en werden 790 patiënten gerandomiseerd voor de pembrolizumabgroep en 789 patiënten voor de controlegroep. In de ITT-populatie hadden 1235 patiënten (78 procent) een tumor met CPS ≥ 1 en 551 patiënten (35 procent) een CPS ≥ 10. In de pembrolizumabgroep kregen 682 patiënten (86 procent) CAPOX en in de placebogroep 681 patiënten (86 procent). De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 62 jaar, ongeveer 68 procent was man, 55 procent was wit, 34 procent Aziatisch, ongeveer 79 procent had de primaire tumor in de maag en ongeveer 40 procent had levermetastasen. De mediane follow-upduur bedroeg 31,0 maanden. Ten tijde van deze analyse waren 414 patiënten overleden in de groep met CPS ≥ 10, 188 in de pembrolizumabgroep en 226 in de placebogroep. In de ITT-populatie was de mediane OS 12,9 maanden (95%-BI: 11,9-14,0) in de pembrolizumabgroep vergeleken met 11,5 maanden (95%-BI: 10,6-12,1) in de placebogroep (HR: 0,78 [95%-BI: 0,70-0,87]; p < 0,0001). In de groep patiënten met CPS ≥ 1 was de mediane OS 13,0 maanden (95%-BI: 11,6-14,2) in de pembrolizumabgroep versus 11,4 maanden (95%-BI: 10,5 12,0) in de placebogroep (HR: 0,74 [95%-BI: 0,65-0,84]; p < 0,0001). In de groep patiënten met CPS ≥ 10 was de mediane OS in de pembrolizumabgroep 15,7 maanden (95%-BI: 13,8-19,3), vergeleken met 11,8 maanden (95%-BI: 10,3-12,7) in de placebogroep (HR: 0,65 [95%-BI: 0,53-0,79]; p < 0,0001). Het verschil in OS tussen de pembrolizumabgroep en de placebogroep was grotendeels gelijk in alle vooraf gespecificeerde subgroepen met uitzondering van CPS. In de ITT-populatie was de mediane PFS 6,9 maanden (95%-BI: 6,3-7,2) in de pembrolizumabgroep vergeleken met 5,6 maanden (95%-BI: 5,5-5,7) in de placebogroep (HR: 0,76 [95%-BI: 0,670,85]; p < 0,0001). In de groep patiënten met CPS ≥ 1 was de mediane PFS 6,9 maanden (95%-BI: 6,0-7,2) in de pembrolizumabgroep versus 5,6 maanden (95%-BI: 5,4-5,7) in de placebogroep (HR: 0,72 [95%-BI: 0,63-0,82]; p < 0,0001). In de groep patiënten met CPS ≥ 10 was de mediane PFS in de pembrolizumabgroep 8,1 maanden (95%-BI: 6,8-8,5), vergeleken met 5,6 maanden (95%-BI: 5,4-6,7) in de placebogroep (HR: 0,62 [95%-BI: 0,51-0,76]; p < 0,0001). In de pembrolizumabgroep kregen 355 (45 procent) patiënten na progressie een vervolgbehandeling waarvan 339 (43 procent) chemotherapie, 66 (8 procent) een PD-1/L1-remmer en 137 (17 procent) een VEGF/VEGFR-remmer. In de placebogroep kregen 369 (47 procent) patiënten na progressie een vervolgbehandeling waarvan 346 (44 procent) chemotherapie, 72 (9 procent) een PD-1/L1-remmer en 138 (17 procent) een VEGF/VEGFR-remmer.
Tijdens het ASCO-congres van 2024 werden de overlevingscijfers na een mediane followup van 41,6 maanden gepresenteerd.6 De HR voor OS bedroeg op dat moment 0,75 (95%-BI: 0,660 0,842), 0,85 (95%-BI: 0,730-1,000) en 0,64 (95%-BI: 0,529 0,772) voor de groep patiënten met CPS ≥ 1, CPS 1-9 en CPS ≥ 10, respectievelijk. In de groep patiënten met CPS ≥ 1 waren na 25 maanden in de pembrolizumabgroep nog 173 patiënten (28 procent) in leven en was de 2-jaars OS 29 procent versus 18 procent in de placebogroep (verschil 11 procent). In de groep patiënten met CPS ≥ 10 waren na 25 maanden in de pembrolizumabgroep nog 102 patiënten (36 procent) in leven en was de 2-jaars OS 38 procent versus 22 procent voor de placebogroep (verschil 16 procent). Omdat het een nested subgroepanalyse betrof kon hieruit de OS in de groep patiënten met CPS 1-9 berekend worden. In de groep patiënten met CPS 1-9 waren na 25 maanden nog 71 patiënten (21 procent) in de pembrolizumabgroep in leven en was de 2-jaars OS 21,5 procent versus 14,8 procent in de placebogroep (verschil 6,7 procent). In de pembrolizumabgroep ontvingen 785 patiënten (99 procent) ten minste 1 behandeling en in de placebogroep waren dat 787 patiënten (> 99 procent). Bij 207 patiënten (26 procent) in de pembrolizumabgroep en bij 158 patiënten (20 procent) in de placebogroep werd de behandeling voortijdig gestaakt vanwege behandelingsgerelateerde bijwerkingen. Dosisreductie van de chemotherapie werd toegepast bij 37 procent van de patiënten in de pembrolizumabgroep en bij 39 procent in de placebogroep. De mediane behandelduur was 6,7 maanden in de pembrolizumabgroep en 5,6 maanden in de placebogroep. Behandelingsgerelateerde bijwerkingen van graad 3 of hoger kwamen voor bij 466 patiënten (59 procent) in de pembrolizumabgroep en bij 404 patiënten (51 procent) in de placebogroep. De meest voorkomende bijwerkingen van graad 3 of hoger waren anemie (bij 12 procent en 10 procent van de patiënten in de pembrolizumabgroep en placebogroep, respectievelijk) en neutropenie (bij 10 respectievelijk 8 procent van de patiënten). 8 patiënten (1 procent) in de pembrolizumabgroep en 16 patiënten (2 procent) in de placebogroep overleden ten gevolge van de behandeling. Mogelijk immuun-gemedieerde bijwerkingen van graad 3 of hoger kwamen voor bij 62 patiënten (8 procent) in de pembrolizumabgroep en 13 patiënten (2 procent) in de placebogroep. Kwaliteit-van-levenanalyse liet geen significant verschil zien tussen beide groepen met in beide groepen een afname van pijnklachten na 18 weken.
6. Discussie
Bij patiënten met een lokaal gevorderd, inoperabel of gemetastaseerd HER2-negatief adenocarcinoom van de maag of gastro-oesofageale overgang zorgt behandeling met pembrolizumab plus chemotherapie in vergelijking tot behandeling met placebo plus chemotherapie voor een langere OS waarbij de overlevingswinst toeneemt bij hogere tumor PD-L1 CPS. Bij patiënten met een tumor met een CPS ≥ 10 bedraagt de mediane OS 15,7 maanden in de pembrolizumabgroep versus 11,8 maanden in de placebogroep met een HR voor overlijden van 0,65 (95%-BI: 0,53-0,79; p < 0,0001). Dit verschil leidt tot een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij mediane overleving in de controlegroep ≤ 12 maanden. Voor patiënten met CPS ≥ 1 werd een mediane OS van 13,0 maanden versus 11,4 maanden (HR: 0,74, p < 0,0001) gezien bij behandeling met pembrolizumab en chemotherapie versus placebo en chemotherapie. Dit verschil voldoet niet aan de PASKWIL2023-criteria voor palliatieve behandeling. De geüpdatete overlevingscijfers lieten bij patiënten met een tumor CPS ≥ 1 een overlevingswinst na 2 jaar zien van meer dan 10 procent voor pembrolizumab. Bij nadere analyse bleek dit verschil echter grotendeels verklaard te worden door de subgroep van patiënten met een tumor CPS ≥ 10. Dit positieve advies voor patiënten met tumor CPS ≥ 10 is strikter dan het EMAlabel voor patiënten met tumor CPS ≥ 1.
De behandeling in de controlegroep komt overeen met de Nederlandse richtlijn, lopende studies en praktijk tijdens de studieperiode. Opvallend is wel dat het aantal te includeren patiënten tweemaal verhoogd werd; eenmaal werd het aantal te includeren patiënten verdubbeld vanwege de resultaten van de KEYNOTE-062-studie waar geen significante winst in overleving werd gezien door toevoeging van pembrolizumab aan chemotherapie als eerstelijnsbehandeling van het HER2-negatieve maagcarcinoom, noch bij patiënten met tumor CPS ≥ 1, noch bij tumor CPS ≥ 10.5 De tweede verruiming van het aantal inclusies betrof 37 patiënten uit China waar de studie laat op gang was gekomen.
Recent zijn meerdere andere studies gepubliceerd waarbij de winst van immuuntherapie in de eerste lijn werd onderzocht bij patiënten met een gemetastaseerd maag- of slokdarmcarcinoom. De CheckMate 649-studie onderzocht de effectiviteit van nivolumab toegevoegd aan chemotherapie bij patiënten met HER2-negatief maag- of slokdarmcarcinoom. In die studie werd bij patiënten met CPS ≥ 5 een significante winst in OS gezien door toevoeging van nivolumab aan chemotherapie maar bij patiënten met CPS lager dan 5 niet.3 In de KEYNOTE-590-studie werden patiënten met een gevorderd adeno of plaveiselcelcarcinoom van de oesofagus, of HER2-negatief adenocarcinoom van de gastro-oesofageale overgang gerandomiseerd tussen fluorouracil en cisplatine met placebo of pembrolizumab.7 Bij patiënten met een PD-L1 CPS ≥ 10 werd de grootste OS-winst van pembrolizumab gezien (13,9 versus 8,8 maanden; HR 0,57,). Deze twee studies en de alhier besproken KEYNOTE-859-studie laten alle voordeel zien van de toevoeging van immuuntherapie in de eerste lijn bij de groep met hoge PD-L1-expressie. Patiënten in deze studies met een tumor met lage PD-L1-expressie lijken onvoldoende baat te ondervinden van toevoeging van immuuntherapie.
In de KEYNOTE-859 was, in tegenstelling tot meerdere andere studies bij patiënten met maagcarcinoom, twee derde van de geïncludeerde patiënten afkomstig uit niet-Aziatische landen, waardoor de resultaten goed te interpreteren zijn voor de Nederlandse populatie. Bijwerkingen waren vergelijkbaar in beide behandelgroepen en in het algemeen goed hanteerbaar.
7. Kosten
De behandeling met mediaan 9,7 cycli pembrolizumab kost 5721 euro per 3-wekelijkse cyclus. De totale behandelkosten komen hiermee op 55.495 euro (bron: medicijnkosten.nl, d.d. januari 2025). De kosten van de chemotherapie moeten hierbij worden opgeteld.
8. Conclusie
In de hier besproken KEYNOTE-859-studie wordt bij patiënten met een lokaal gevorderd, irresectabel of gemetastaseerd HER2-negatief adenocarcinoom van de maag- of gastro-oesofageale overgang een significant langere OS gezien na palliatieve behandeling met pembrolizumab toegevoegd aan fluoropyrimidine en platinumbevattende chemotherapie. Dit effect is het grootst in de subgroep van patiënten met een tumor met PD-L1 CPS ≥ 10 (verbetering mediane OS met 3,9 maanden; HR 0,65). De resultaten voor deze subgroep van patiënten met een tumor met PD-L1 CPS ≥ 10 voldoen aan de PASKWIL2023-criteria voor palliatieve behandeling bij studies waarin de mediane overleving in de placebogroep 12 maanden of korter is, voor een positief advies.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Landelijke richtlijn maagcarcinoom 2021 (richtlijnendatabase.nl).
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Nivolumab en chemotherapie als eerstelijnsbehandeling van het gemetastaseerd HER2-negatief adenocarcinoom van de maag, gastro-oesofageale overgang of oesofagus. Med Oncol 2022;25(4):29-34.
- Rha SY, Oh DY, Yaez P, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2-negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, doubleblind, phase 3 trial. Lancet Oncol 2023;24:1181-95.
- Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet 2021;398(10294):27-40.
- Rha SY, Wyrwitz L, Yanez Weber P, et al. Pembrolizumab plus chemotherapy for advanced HER2-negative gastric or gastroesophageal junction cancer: updated results from the KEYNOTE-859 study. J Clin Oncol 42;16: suppl 4045.
- Sun JM, Shen L, A Shah M, et al; KEYNOTE-590 Investigators. Pembrolizumab plus chemotherapy versus chemotherapy alone for firstline treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet 2021;398(10302):759-71.