Inleiding
De incidentie van het oesofaguscarcinoom in Nederland is de laatste 30 jaar fors toegenomen: van 683 diagnoses in 1989 naar ongeveer 2.600 diagnoses in 2021. Deze stijging is groter dan verklaard kan worden door de bevolkingsgroei en stijging van de gemiddelde leeftijd. Het betreft vooral adenocarcinomen van de oesofagus ten gevolge van een hogere incidentie van overgewicht en daaraan gerelateerd refluxziekten. Het percentage plaveiselcelcarcinomen is in Nederland rond 25 procent van het totaal aantal oesofaguscarcinomen, terwijl het wereldwijd ongeveer 90 procent betreft.
Bijna de helft van de patiënten met een oesofaguscarcinoom heeft reeds metastasen op afstand bij het stellen van de diagnose. Bij een gemetastaseerd oesofaguscarcinoom is de mediane overleving ongeveer 6 maanden en de 1-jaarsoverleving ongeveer 25 procent.1 De Nederlandse richtlijn voor oesofaguscarcinoom uit 2005 (richtlijnendatabase.nl) stelt dat chemotherapie kan worden overwogen bij patiënten met een goede performancestatus en beperkte metastasering. Combinatiebehandeling met een fluoropyrimidine- (5-FU) en een platinumderivaat wordt gezien als een acceptabele eerstelijns behandeloptie, ongeacht het histologische subtype. De ESMO-richtlijn uit 2016 adviseert palliatieve systeembehandeling voor geselecteerde patiënten met gevorderd of gemetastaseerd oesofaguscarcinoom en goede performancestatus en stelt dat het adenocarcinoom van de distale oesofagus in het algemeen behandeld wordt zoals het adenocarcinoom van de maag. In Nederland wordt meestal een combinatiebehandeling met capecitabine en oxaliplatine (CAPOX) of 5-FU (mFOLFOX6) gegeven. In het geval van distaal gelegen adenocarcinoom met HER2-overexpressie wordt trastuzumab aan de behandeling toegevoegd en in de tweede lijn kan, onafhankelijk van HER2-overexpressie, een taxaan – al dan niet in combinatie met ramucirumab – overwogen worden. Patiënten met een progressief gevorderd of gemetastaseerd plaveiselcelcarcinoom van de oesofagus hebben na combinatiebehandeling met een fluoropyrimidine en een platinumderivaat statistisch gezien maar een beperkt betere mediane overleving met tweedelijnsbehandeling met nivolumabmonotherapie in vergelijking met taxaanbevattende chemotherapie. Deze behandeling voldoet niet aan de PASKWIL-criteria voor een positief advies.2-3
Recentelijk zijn de resultaten gepubliceerd van de CheckMate-649-studie, waarin de toevoeging van nivolumab aan 5-FU en een platinumderivaat als eerstelijnsbehandeling voor het adenocarcinoom van de maag, gastro-oesofageale overgang en oesofagus is onderzocht.4
Pembrolizumab is een monoklonaal antilichaam gericht tegen de immune-checkpoint programmed death-1 receptor (PD-1-receptor) op T-cellen met aangetoonde antitumoractiviteit in diverse kankersoorten. In de KEYNOTE-590-studie is de meerwaarde onderzocht van pembrolizumab toegevoegd aan eerstelijnschemotherapie bij patiënten met een lokaal gevorderd irresectabel of gemetastaseerd oesofaguscarcinoom.5
1. Kankersoort en lijn van behandeling
Op basis van de KEYNOTE-590-studie heeft de EMA pembrolizumab in combinatie met een platinum- en fluoropyrimidinebevattend chemotherapieregime geregistreerd als eerstelijnsbehandeling voor volwassen patiënten met lokaal gevorderd irresectabel of gemetastaseerd carcinoom van de oesofagus, of HER2-negatief adenocarcinoom van de gastro-oesofageale overgang, bij wie de tumor PD-L1-expressie vertoont met een combined positivity score (CPS) van 10 of hoger.
2. Vergelijking met de referentiebehandeling in Nederland
In de KEYNOTE-590 studie wordt palliatieve behandeling met pembrolizumab en chemotherapie vergeleken met placebo en chemotherapie als eerstelijnsbehandeling bij patiënten met een lokaal gevorderd irresectabel of gemetastaseerd carcinoom van de oesofagus, of HER2-negatief adenocarcinoom van de gastro-oesofageale overgang. De chemotherapie bestond uit cisplatine én 5-FU. In Nederland wordt meestal een combinatiebehandeling met capecitabine en oxaliplatine (CAPOX) of 5FU (FOLFOX) aan patiënten gegeven. De studiebehandeling is derhalve vergelijkbaar met de Nederlandse praktijk.
3. Methode en kwaliteit van de studie
KEYNOTE-590 is een dubbelblind gerandomiseerde fase III-multicenterstudie voor patiënten met een histologisch bewezen lokaal gevorderd, irresectabel of gemetastaseerd adeno- of plaveiselcelcarcinoom van de oesofagus, of HER2-negatief adenocarcinoom van de gastro-oesofageale overgang (Siewert type 1). Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1, een adequate orgaanen beenmergfunctie en meetbare ziekte volgens RECIST 1.1 te hebben. Patiënten mochten niet eerder systeemtherapie in de gemetastaseerde setting ontvangen hebben en tumorweefsel moest beschikbaar zijn voor centraal uitgevoerde PD-L1-bepaling. Patiënten konden onafhankelijk van de PD-L1-status geïncludeerd worden.
Patiënten bekend met pneumonitis, interstitiële longziekte, longfibrose, auto-immuunziekten waarvoor systemische behandeling in de afgelopen 2 jaar nodig was, actieve infectie, recente grote operatie of trauma, secundaire maligniteit of symptomatische hersen- of leptomeningeale metastasen konden niet aan de studie deelnemen. Eveneens werden patiënten met een indicatie voor corticosteroïden (> 10 mg prednison per dag) of andere immunosuppressiva geëxcludeerd. Geïncludeerde patiënten werden 1:1 gerandomiseerd tussen chemotherapie met pembrolizumab of met placebo.
De dosering pembrolizumab was 200 mg elke 3 weken. De chemotherapie bestond uit cisplatine 80 mg/m2 op dag 1 en 5FU 800 mg/m2 op dagen 1 tot en met 5, via continu infuus, elke 3 weken. Alle middelen werden intraveneus toegediend (pembrolizumab en placebo waren geblindeerd). De behandeling werd gegeven tot ziekteprogressie, onacceptabele toxiciteit of complete respons. Cisplatine werd maximaal 6 keer, en 5-FU en pembrolizumab of placebo werden maximaal 35 keer toegediend.
De randomisatie werd gestratificeerd naar geografische regio (Azië versus non-Azië), histologie (plaveiselcelcarcinoom versus adenocarcinoom) en performancestatus (0 versus 1). Cross-over tussen behandelgroepen was niet toegestaan. De vervolgbehandelingen werden bijgehouden. Alle patiënten werden voor start van de behandeling en daarna elke 9 weken geëvalueerd middels CT-scan, beoordeeld volgens RECIST 1.1, tijdens en na chemotherapie tot aan progressie. Bij complete respons, partiële respons of progressie werd bevestiging na minimaal 4 weken geadviseerd. PD-L1-expressie werd centraal bepaald met behulp van immunohistochemie middels de assay PD-L1 IHC 22C3 (Agilent Technologies).
De (zeven) hiërarchisch geteste coprimaire eindpunten van de studie waren:
- totale overleving (OS) bij alle patiënten;
- OS bij alle patiënten met een CPS van 10 of hoger;
- OS bij patiënten met een plaveiselcelcarcinoom;
- OS bij patiënten met een plaveiselcelcarcinoom en een CPS van 10 of hoger;
- progressievrije overleving (PFS) bij alle patiënten;
- PFS bij alle patiënten met een CPS van 10 of hoger;
- PFS bij patiënten met een plaveiselcelcarcinoom.
Secundaire eindpunten waren:
- objectieve responskans (ORR) bij alle patiënten;
- ORR bij alle patiënten met een CPS van 10 of hoger;
- ORR bij patiënten met een plaveiselcelcarcinoom;
- ORR bij patiënten met een plaveiselcelcarcinoom en een CPS van 10 of hoger;
- responsduur (DoR) in de verschillende groepen;
- bijwerkingen (vastgesteld volgens CTCAE 4.0);
- kwaliteit van leven (gemeten met de vragenlijsten EORTC-QLQ-C30 global health status (GHS)/QoL and physical functioning en QLQ-OES18).
Volgens het ontwerp van de studie waren ruim 700 patiënten met een oesofaguscarcinoom, waarvan 547 met een plaveiselcelcarcinoom, met minimaal 13 maanden follow-up en 460 PFS-events nodig om met 82,8 procent power en een eenzijdige alfa van 0,2 procent een hazard ratio (HR) van 0,7 voor het primaire eindpunt PFS in de plaveiselcelcarcinoompopulatie vast te kunnen stellen middels een gestratificeerde logranktest. Voor OSanalyse was er een eenzijdige alfa van respectievelijk 1,2 procent en 1,1 procent voor patiënten met een plaveiselcelcarcinoom en een CPS van 10 of hoger en voor alle patiënten met plaveiselcelcarcinoom. Na analyse van de KEYNOTE-181-studie6, waarin het effect van pembrolizumab als tweedelijnsbehandeling voor het oesofaguscarcinoom werd onderzocht, en na volledige accrual van de KEYNOTE-590-studie en alvorens deze werd geanalyseerd, werd het studieprotocol geamendeerd en werden de primaire en secundaire eindpunten van de studie uitgebreid met specifieke definities van subgroepen op basis van histologie (plaveiselcelcarcinoom) en PD-L1- expressie (wel of geen CPS ≥ 10). Aanvankelijk werd responsbeoordeling centraal uitgevoerd, maar wegens grote discrepanties met de lokale beoordeling, en hierdoor frequente censoring, werd het protocol geamendeerd naar lokale responsbeoordeling. De resultaten van de enige interim-analyse, en tevens definitieve PFS-analyse, worden hier gerapporteerd. De coprimaire eindpunten PFS en OS werden parallel getest voor patiënten met een plaveiselcelcarcinoom en, indien deze positief waren, vervolgens hiërarchisch getest op basis van de vooraf gedefinieerde volgorde.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen juli 2017 en juni 2019 werden 1.020 patiënten gescreend, waarvan 749 patiënten door 168 centra in 26 landen zijn geïncludeerd: 373 patiënten in de pembrolizumab-groep en 376 patiënten in de controlegroep. Alle patiënten werden geïncludeerd in de intention to treat-analyse (ITT-analyse). De uitgangskarakteristieken in beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 63 jaar, 90 procent had primair gemetastaseerd ziekte, ruim 80 procent was man, 60 procent had een ECOG-performancescore 1,37 procent was Kaukasisch en 54 procent was Aziatisch.
Van alle patiënten hadden 548 patiënten (73 procent) een plaveiselcelcarcinoom, waarvan 286 patiënten (52 procent) met PD-L1-expressie met een CPS van 10 of hoger, en 201 patiënten (27 procent) hadden een adenocarcinoom, waarvan 91 patiënten een gastro-oesofageaal overgangscarcinoom (Siewert type 1). Van alle patiënten hadden 383 patiënten (51 procent) een PD-L1-expressie met een CPS van 10 of hoger. De uitgangskarakteristieken van deze subgroepen waren vergelijkbaar met de uitgangskarakteristieken van de ITT-populatie.
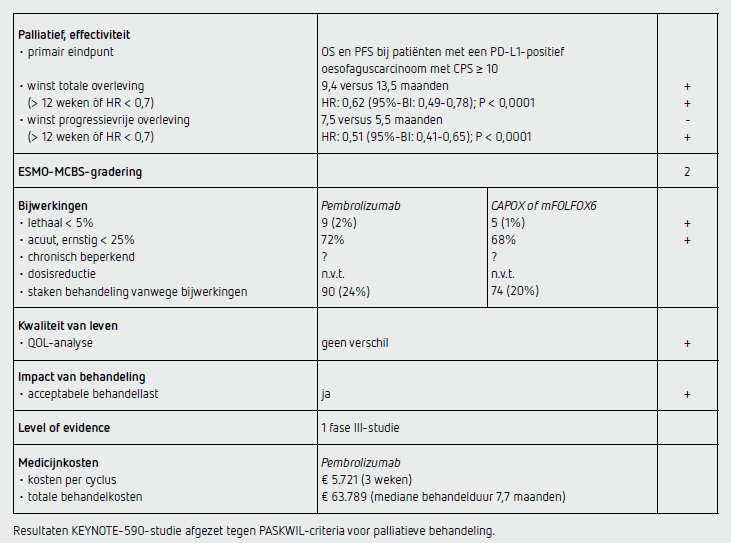
De mediane follow-up voor OS ten tijde van de data-cutoff (2 juli 2020) was 22,6 maanden (IQR: 19,6-27,1). Behandeling werd gestart bij 370 patiënten in beide groepen en de mediane behandelduur was 7,7 maanden in de pembrolizumab-groep en 5,8 maanden in de controlegroep. Het coprimaire eindpunt OS was significant beter in de pembrolizumab-groep dan in de controlegroep bij patiënten met een plaveiselcelcarcinoom van de oesofagus en een PD-L1-expressie met een CPS van 10 of hoger (HR: 0,57 [95%-BI: 0,43-0,75]; P < 0,0001). De mediane OS bedroeg 13,9 maanden (95%-BI: 11,1-17,7) in de pembrolizumabgroep en 8,8 maanden (95%-BI: 7,8-10,5) in de controlegroep.
De 2-jaarsoverleving bedroeg 31 procent in de pembrolizumab-groep en 15 procent in de controlegroep. De mediane overleving was ook beter in de pembrolizumabgroep dan in de controlegroep bij alle patiënten met plaveiselcelcarcinoom van de oesofagus (HR: 0,72 [95%-BI: 0,60-0,88]; P = 0,0006). De mediane OS bedroeg hier 12,6 maanden (95%-BI: 10,2-14,3) in de pembrolizumabgroep en 9,8 maanden (95%-BI: 8,6-11,1) in de controlegroep. De 2-jaarsoverleving bedroeg 29 procent in de pembrolizumab-groep en 17 procent in de controlegroep. De mediane overleving was ook beter in de pembrolizumab-groep dan in de controlegroep bij alle patiënten met een oesofaguscarcinoom en een PD-L1-expressie met een CPS van 10 of hoger (HR: 0,62 [95%-BI: 0,49-0,78]; P < 0,0001) en alle patiënten met een oesofaguscarcinoom ongeacht histologie en CPS (HR: 0,73 [95%-BI: 0,62-0,86]; P < 0,0001). De mediane OS bedroeg respectievelijk 13,5 maanden (95%-BI: 11,1-15,6) en 12,4 maanden (95%-BI: 10,5-14,0) in de pembrolizumab-groep en 9,4 maanden (95%-BI: 8,0-10,7) en 9,8 maanden (95%-BI: 8,8-10,8) in de controlegroep. De 2-jaarsoverleving bedroeg respectievelijk 31 en 28 procent in de pembrolizumab-groep en 15 en 16 procent in de controlegroep.
Het verschil in OS tussen pembrolizumab-groep en controlegroep was grotendeels gelijk in alle vooraf gespecificeerde subgroepen behalve etnische achtergrond en CPS. Een interactie tussen PD-L1-expressie en therapie-effect werd niet aangetoond.
De mediane PFS was ook beter in de pembrolizumab-groep dan in de controlegroep bij alle patiënten met een oesofaguscarcinoom en een PD-L1-expressie met een CPS van 10 of hoger (7,5 versus 5,5 maanden; HR: 0,51 [95%-BI: 0,41-0,65]; P < 0,0001). De ORR was 45 procent (95%-BI: 40-50) in de pembrolizumab-groep en 29 procent (95%-BI: 25-34) in de chemotherapie-groep. De mediane responsduur was 8,3 maanden (95%-BI: 1,2-31,0) in de pembrolizumab-groep en 6,0 maanden (95%-BI: 1,5-25,0) in de controlegroep. Ten tijde van de data-cutoff kregen 27 patiënten in de pembrolizumab-groep en 10 patiënten in de controlegroep nog behandeling.
Een exploratieve analyse naar het effect op basis van etnische achtergrond en PD-L1-status liet zien dat de winst in overleving voor de ITT-populatie vooral optrad in de Aziatische populatie (HR: 0,60 versus 0,84) en patiënten met een PD-L1-expressie met een CPS van 10 of hoger ten opzichte van PD-L1-expressie met een CPS lager dan 10 (HR: 0,62 versus 0,86).
Behandelgerelateerde bijwerkingen van graad 3 of hoger traden op bij 72 procent van de patiënten in de pembrolizumab-groep en bij 68 procent van de patiënten in de controlegroep. Vanwege bijwerkingen zijn in respectievelijk de pembrolizumab-groep en de controlegroep 90 patiënten (24 procent) en 74 patiënten (20 procent) met de behandeling voortijdig gestopt en 28 patiënten (8 procent) en 38 patiënten (10 procent) overleden. De meest frequent gerapporteerde ernstige bijwerkingen (graad 3-5) waren neutropenie (14 versus 16 procent) en anemie (12 versus 15 procent). Gastro-intestinale bijwerkingen waren vergelijkbaar tussen de behandelgroepen. De meest voorkomende immuuntherapiegerelateerde bijwerkingen van alle graderingen in de pembrolizumab-groep en controlegroep waren hypothyroïdie (11 versus 7 procent), pneumonitis (6 versus 1 procent) en hyperthyroïdie (6 versus 1 procent). Respectievelijk 2 en 1 patiënt overleden aan de gevolgen van een pneumonitis.
Na progressie kregen respectievelijk 161 patiënten (43 procent) en 177 (47 procent) systemische behandeling, waarvan immuuntherapie bij 22 (6 procent) en 35 (9 procent) patiënten in respectievelijk de pembrolizumabgroep en controlegroep.
Kwaliteit van levenanalyse toont voor de pembrolizumabgroep, in vergelijking met de controlegroep, geen statistisch significant of klinisch relevante verandering in week 18 ten opzichte van baseline.
Discussie
In de KEYNOTE-590-studie wordt een statistisch significante verlenging van de mediane OS aangetoond wanneer pembrolizumab wordt toegevoegd aan cisplatine- en 5-FU-bevattende eerstelijnschemotherapie bij patiënten met een gemetastaseerd oesofaguscarcinoom, ongeacht histologisch subtype, en een PD-L1-expressie met een CPS van 10 of hoger (HR: 0,62 [95%-BI: 0,49-0,78]; P < 0,0001). De mediane OS nam in deze groep toe van 9,4 naar 13,5 maanden (Δ 4,1) en de 2-jaarsoverleving was twee keer hoger (30 versus 15 procent) in de pembrolizumab plus chemotherapie-groep in vergelijking met de controlegroep.
De studie toont ook aan dat de toevoeging van pembrolizumab resulteert in een statistisch significante verlenging van de mediane PFS bij alle patiënten met oesofaguscarcinoom en een PD-L1-expressie met een CPS van 10 of hoger (HR: 0,51) maar de absolute winst was beperkt (2 maanden). Op basis van vooraf gedefinieerde subgroepanalyses lijkt het effect van pembrolizumab in de gehele studie met name gedreven te worden door patiënten met een PD-L1-expressie met een CPS van 10 of hoger, overeenkomstig de EMA-registratie, en patiënten van Aziatische komaf. Op basis van verschil in HR’s van patiënten met respectievelijk plaveiselcelcarcinoom (HR: 0,57 [95%-BI: 0,43-0,75]) of adenocarcinoom (HR: 0,83 [95%-BI: 0,52-1,34]), en een PD-L1-expressie met een CPS 10 of hoger kan geconcludeerd worden dat de winst vooral bij patiënten met plaveiselcelcarcinoom ligt. Voor de gemiddelde Nederlandse patiënt met een adenocarcinoom zal de winst zeer bescheiden zijn. Een recente analyse na een follow-up van mediaan 34,8 maanden, gepresenteerd op het 2022 ASCO Gastrointestinal Cancers Symposium, laat een beperkt significante winst zien bij patiënten met een adenocarcinoom van de oesofagus (HR: 0,73 [95%-BI: 0,55-0,99]) in de pembrolizumabgroep ten opzichte van de controlegroep.
Immuungerelateerde bijwerkingen kwamen vaker voor in de pembrolizumabgroep maar waren in het algemeen hanteerbaar en niet belastend zoals de kwaliteit van levenanalyse onderschrijft. De resultaten van de KEYNOTE-590-studie voldoen aan de PASKWIL-criteria voor een positief advies voor de toevoeging van pembrolizumab aan de eerstelijns combinatiebehandeling van cisplatine en 5-FU voor patiënten met lokaal gevorderd irresectabel of gemetastaseerd carcinoom van de oesofagus, of HER2-negatief adenocarcinoom van de gastro-oesofageale overgang, bij wie de tumoren PD-L1-expressie vertonen met een CPS van 10 of hoger. In Nederland is een behandeling met CAPOX of mFOLFOX6 gebruikelijker dan cisplatine met 5FU. De EMA-registratie laat een combinatie met elke platinumen fluoropyrimidinebevattende chemotherapie toe.
5. Kosten
De behandeling met pembrolizumab kost bij de dosering van 200 mg 5.721 euro per cyclus van 3 weken (bron: medicijnkosten.nl d.d. 15 november 2021). De kosten van 11 cycli (mediane behandelduur: 7,7 maanden) bedragen daarmee 63.789 euro.
Conclusie
In de hier besproken KEYNOTE-590-studie bij fitte patiënten met een lokaal gevorderd irresectabel of gemetastaseerd carcinoom van de oesofagus, of HER2-negatief adenocarcinoom van de gastro-oesofageale overgang (Siewert 1), en een PD-L1-expressie met een CPS van 10 of hoger geeft behandeling met pembrolizumab plus chemotherapie in vergelijking met placebo plus chemotherapie een statistisch significante verlenging van de mediane overleving (HR: 0,62 [95%-BI: 0,490,78]; P < 0,0001). De mediane overleving nam toe van 9,4 naar 13,5 maanden (Δ 4,1) en de 2-jaarsoverleving verdubbelde. Bijwerkingen kwamen iets vaker voor in de experimentele arm maar waren hanteerbaar en hadden geen negatieve invloed op de kwaliteit van leven van patiënten. De resultaten van de KEYNOTE-590-studie voldoen aan de PASKWIL-criteria voor een positief advies.
Referenties
- Slokdarm- en maagkanker in Nederland. IKNL, DUCG, DUCA, POCOP en SPKS, september 2021.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Nivolumab als tweedelijnsbehandeling bij het plaveiselcelcarcinoom van de oesofagus. Med Oncol 2021;24(1):41-4.
- Kato K, Cho BC, Takahashi M, et al. Nivolumab versus chemotherapy in patients with advanced oesophageal squamous cell carcinoma refractory or intolerant to previous chemotherapy (ATTRACTION-3): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2019;20(11):150617.
- Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet 2021;398(10294):27-40.
- Sun J-M, Shen L, A Shah M, et al; KEYNOTE-590 Investigators. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet 2021;398(10302):759-71.
- Kojima T, A Shah M, Muro K, et al; KEYNOTE181 Investigators. Randomized phase III KEYNOTE-181 study of pembrolizumab versus chemotherapy in advanced esophageal cancer. J Clin Oncol 2020;38(35):4138-48.