
1. Samenvatting eerder advies
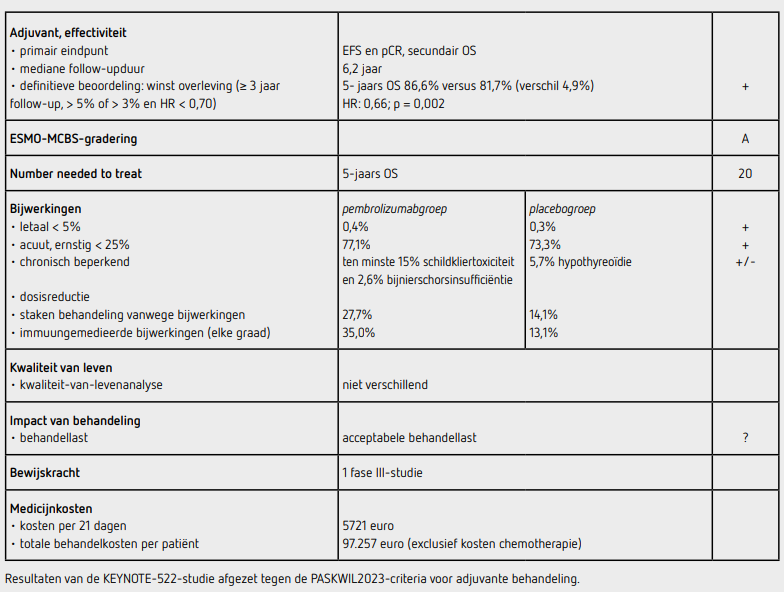
In februari 2023 beoordeelde cieBOM de waarde van neoadjuvante en adjuvante behandeling met pembrolizumab toegevoegd aan neoadjuvante chemotherapie bij patiënten met een tripelnegatief mammacarcinoom.1 In de KEYNOTE-522-studie2 werden patiënten met een cT1cN1-2 of een cT2-4N0-2 tripelnegatief mammacarcinoom 2:1 gerandomiseerd tussen pembrolizumab 200 mg elke 3 weken of placebo toegevoegd aan chemotherapie in de vorm van 12 wekelijkse cycli paclitaxel 80 mg/m2 en carboplatine area under the curve (AUC) 5 elke 3 weken of AUC 1,5 wekelijks, gevolgd door vier 3-wekelijkse cycli doxorubicine 60 mg/m2 of epirubicine 90 mg/m2 en cyclofosfamide 600 mg/m2. Postoperatief werd de behandeling met pembrolizumab of placebo gecontinueerd met nog 9 cycli. Adjuvante behandeling met capecitabine was niet toegestaan. De primaire eindpunten van de studie waren complete pathologische respons (pCR) en ziektevrije overleving (EFS) in de intentiontotreatpopulatie. Totale overleving (OS) was een secundair eindpunt. Tussen maart 2017 en september 2018 werden 1174 patiënten geïncludeerd, 784 in de pembrolizumabgroep en 390 in de placebogroep. Bij de vierde interimanalyse na een mediane followupduur van 39,1 maanden was de geschatte 3jaars EFS 84,5 procent (95%-BI: 81,7-86,9) in de pembrolizumabgroep en 76,8 procent (95%-BI: 72,2-80,7) in de placebogroep. De EFS was statistisch significant langer in de pembrolizumabgroep dan in de placebogroep (HR: 0,63 [95%BI: 0,48-0,82]; p < 0,001). Het percentage patiënten met een pCR was hoger in de pembrolizumabgroep dan in de placebogroep, respectievelijk 64,8 procent en 51,2 procent, met een verschil van 13,6 procent (95%-BI: 5,4-21,8; p < 0,001). Patiënten die een pCR hadden bereikt na neoadjuvante behandeling hadden een beperkt risico op recidief, tweede primaire tumor of overlijden namelijk 5,5 procent in de pembrolizumabgroep en 7,4 procent in de placebogroep (verschil 1,9 procent). Patiënten die geen pCR hadden bereikt hadden een risico op recidief van 33,1 procent in de pembrolizumabgroep en 44,5 procent in de placebogroep (verschil 11,4 procent). Bij 27,7 procent van de patiënten in de pembrolizumabgroep werd de behandeling voortijdig afgebroken vanwege bijwerkingen. In de placebogroep werd de behandeling bij 14,1 procent voortijdig afgebroken vanwege bijwerkingen. Deze resultaten voldeden aan de destijds geldende PASKWIL-criteria voor adjuvante studies voor een voorlopig positief advies.
2. Update van de resultaten
In september 2024 is de OS-analyse van deze studie gepubliceerd.3 De zevende interim-analyse betrof een interimanalyse voor OS en was van tevoren vastgesteld op de datum van eind maart 2024. Voor deze analyse kon met 82 procent power een HR van 0,70 voor overlijden worden aangetoond met een eenzijdige alfa van 0,025. De alfa werd verdeeld volgens de LanDeMets-O’Brien-Fleming-methode nadat eerder de analysen voor pCR en EFS positief waren en voor de huidige analyse werd een grens van 0,00503 aangehouden voor statistische significantie. Omdat de hazards niet proportioneel bleken, werden de curves ook vergeleken middels een restricted mean survival time (RMST) analyse in jaar 0-2 en vanaf jaar 2. Op het moment van analyse was de mediane followupduur 75,1 maanden en waren 200 patiënten overleden, 115 (14,7 procent) in de pembrolizumabgroep en 85 (21,8 procent) in de placebogroep (p = 0,002). De geschatte 5-jaarsoverleving was 86,6 procent (95%-BI: 84,0-88,8) in de pembrolizumabgroep en 81,7 procent (95%-BI: 77,5-85,2) in de placebogroep. De ongestratificeerde piecewise HR was 0,87 (95%-BI: 0,57-1,32) in jaar 0 tot 2 en 0,51 (95%-BI: 0,35-0,75) vanaf jaar 2. De samengestelde gewogen HR bedroeg 0,66. De HR, berekend met het Coxregressiemodel dat rekening houdt met de stratificatiefactoren, was 0,66 (95%-BI: 0,50-0,87). De RMST gedurende de eerste 5 jaar was 55,3 maanden in de pembrolizumabgroep en 54,1 maanden in de placebogroep, duidend op een OS-verschil van 1,2 maanden (95%-BI: -0,50-2,8). Het verschil in OS was consistent in de geprespecificeerde subgroepen. Van de patiënten met een pCR na neoadjuvante therapie waren 27 van de 495 (5,5 procent) in de pembrolizumabgroep en 17 van de 217 patiënten (7,8 procent) in de placebogroep overleden (verschil in 5-jaars OS: 0,7 procent [95%-BI: -2,9-4,3]). Van de patiënten zonder pCR waren in de pembrolizumabgroep 88 van de 289 (30,4 procent) en in de placebogroep 68 van de 173 (39,3 procent) patiënten overleden (verschil in 5jaars OS: 6,1 procent [95%-BI: -2,7 14,9]).
De 5-jaars EFS was 81,2 procent (95%-BI: 78,3-83,8) in de pembrolizumabgroep en 72,2 procent (95%BI: 67,4-76,4) in de placebogroep (HR: 0,65 [95%-BI: 0,51-0,83]). In totaal had 77,1 procent in de pembrolizumabgroep en 73,3 procent in de placebogroep een behandelingsgerelateerde bijwerking van graad 3 of hoger, met name van hematologische aard (anemie of neutropenie). Een immuungemedieerde bijwerking van elke graad kwam voor bij 35,0 procent van de patiënten in de pembrolizumabgroep, waarvan bij 13,0 procent van graad 3 of hoger. Bij 15,1 procent werd hypothyreoïdie vastgesteld, bij 5,2 procent hyperthyreoïdie en bij 2,6 procent bijnierschorsinsufficiëntie. In de pembrolizumabgroep zijn 4 patiënten overleden aan de behandeling (0,4 procent), waarvan 2 aan een immuungemedieerde bijwerking, en 1 patiënt overleed in de placebogroep aan de behandeling (0,3 procent). Er werd geen verschil aangetoond tussen de patiënten behandeld in de pembrolizumabgroep en de placebogroep wat betreft kwaliteit van leven, gemeten met de EORTCQLQC3-0 en de EORTC-QLQBR23, tijdens de neoadjuvante en adjuvante fase.4
3. Bespreking
In de hier besproken herbeoordeling van de KEYNOTE-522-studie werd bij patiënten met een tripelnegatief mammacarcinoom een statistisch significante verbetering gezien van de OS met neoadjuvante en adjuvante behandeling met pembrolizumab en neoadjuvante chemotherapie ten opzichte van placebo en neoadjuvante chemotherapie na een mediane followup van ruim 6 jaar met een absoluut verschil in 5jaars overleving van 4,9 procent (HR: 0,66; p = 0,002). Deze resultaten voldoen aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor adjuvante studies. Uit de overlevingscijfers blijkt dat patiënten die een pCR bereiken een goede prognose hebben, onafhankelijk van behandeling met pembrolizumab. Dit werd ook bij de analyse van EFS gezien.1 Op basis hiervan adviseerde een groep van Nederlandse borstkankerexperts om pembrolizumab bij patiënten met een pCR niet adjuvant toe te dienen.5 Bij de patiënten zonder pCR lijkt de prognose beter in de pembrolizumabgroep dan in de placebogroep. Het is echter onduidelijk of dit voordeel door de behandeling met pembrolizumab in de neoadjuvante of adjuvante fase bereikt wordt. Hiervoor is nader onderzoek nodig. Ook is nog onduidelijk hoe het effect van pembrolizumab zich verhoudt tot het effect van capecitabine bij patiënten zonder pCR, omdat deze behandeling in de KEYNOTE-522-studie niet was toegestaan. In de huidige situatie wordt AC in een 2-wekelijks schema (dose dense) toegediend, hetgeen impact zal hebben op het toedieningsschema van pembrolizumab.
Een recente studie liet zien dat pembrolizumab veilig en effectief kan worden toegediend in een 6-wekelijks schema van 400 mg tijdens behandeling met ddAC.6 Momenteel wordt pembrolizumab toegevoegd aan eerstelijns chemotherapie bij lokaal irresectabel gerecidiveerd of gemetastaseerd tripelnegatief mammacarcinoom met een PDL1 CPS ≥ 10, hetgeen geassocieerd is met een overlevingsvoordeel ten opzichte van chemotherapie alleen.7 Het is onduidelijk hoeveel patiënten uit de placebogroep in de KEYNOTE-522-studie na het ontstaan van gemetastaseerde ziekte pembrolizumab hebben ontvangen. Bij ruim een kwart van de patiënten in de pembrolizumabgroep wordt de behandeling voortijdig gestaakt vanwege bijwerkingen. De gevolgen op lange termijn, ook wat betreft fertiliteit en teratogeniciteit zijn nog grotendeels onbekend. Wel zijn de kwaliteitvanlevenresultaten gepubliceerd die geen significant verschil laten zien tussen de beide behandelgroepen. Immuungemedieerde bijwerkingen komen voor bij 1 op de 3 patiënten en bij 1 op de 8 patiënten zijn deze bijwerkingen van graad 3 of hoger. Een deel van deze bijwerkingen, waaronder hypothyreoïdie en bijnierschorsinsufficiëntie zal irreversibel zijn. Er dienen 20 patiënten behandeld te worden om na 5 jaar 1 leven te redden. De kosten hiervan zijn zeer hoog.
4. Kosten
Pembrolizumab kost 5721 euro per 3-wekelijkse cyclus. 8 giften neoadjuvant kosten 45.769 euro en 9 giften adjuvant kosten 51.489 euro. De totale behandelkosten komen hiermee op 97.257 euro (bron: medicijnkosten.nl d.d. oktober 2024)
5. Conclusie
In de KEYNOTE-522-studie werd een statistisch significante toename van OS aangetoond bij patiënten met een cT1cN1-2 of cT2-4N0-2 tripelnegatief mammacarcinoom na toevoeging van pembrolizumab neoadjuvant en adjuvant aan neoadjuvante chemotherapie met een toename van 4,9 procent in 5-jaarsoverleving (HR: 0,66; p = 0,002). Deze resultaten voldoen bij definitieve beoordeling aan de PASKWIL2023-criteria voor adjuvante studies voor een positief advies.
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab en chemotherapie in neoadjuvante en adjuvante setting bij het tripelnegatief mammacarcinoom. Med Oncol 2023;26(1):32-6.
- Schmid P, Cortes J, Dent R, et al. Event-free survival with pembrolizumab in early triplenegative breast cancer. N Engl J Med 2022;386(6):556-67.
- Schmid P, Cortes J, Dent R, et al. Overall survival with pembrolizumab in early-stage triplenegative breast cancer. N Engl J Med 2024 Sep 15. doi: 10.1056/NEJMoa2409932. Epub ahead of print. PMID: 39282906.
- Dent R, Cortés J, Pusztai L et al. Neoadjuvant pembrolizumab plus chemotherapy/ adjuvant pembrolizumab for early-stage triple-negative breast cancer: quality-of-life results from the randomized KEYNOTE-522 study. J Natl Cancer Instit 2024;116(10):1654-63.
- Afvaardiging Nederlandse Borstkankeroncologen. Plaatsbepaling pembrolizumab voor stadium II/III tripelnegatief mammacarcinoom. Med Oncol 2023;26(1):18-9.
- White O, Dent S, Westbrook K, et al. Assessment of efficacy and safety of dosedense doxorubicin and cyclophosphamide (ddAC) in combination with immunotherapy in early-stage-triple-negative breast cancer. Breast Cancer Res Treat. 2024;207(1):179-85.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab en chemotherapie als eerstelijnsbehandeling bij het lokaal irresectabel gerecidiveerd of gemetastaseerd tripelnegatief mammacarcinoom. Med Oncol 2022;25(6):41-2.