
Inleiding
De incidentie van het cervixcarcinoom in Nederland is de laatste decennia stabiel met 700 tot 800 diagnoses per jaar.1 Naar verwachting zal de incidentie door het HPV-vaccinatieprogramma in de toekomst afnemen. Door radicale chirurgische en radio(chemo)therapeutische behandelmogelijkheden is de prognose in het vroege stadium van de ziekte (< FIGO IIA, tumor beperkt tot de cervix) goed. Zowel bij gerecidiveerde als bij gevorderde of gemetastaseerde ziekte is de prognose somber, met een 5-jaarsoverleving van 10 procent.2 Jaarlijks overlijden ruim 200 patiënten in Nederland aan cervixcarcinoom.
Voor de FIGO-stadia IA-IB1 bestaat de behandeling uit radicale chirurgie, eventueel gevolgd door radio(chemo)therapie op basis van de uitgebreidheid na pathologische beoordeling. Patiënten met FIGO-stadia IB2-IVA worden in opzet curatief behandeld met radiochemotherapie, waarbij de chemotherapie uit 6 wekelijkse kuren cisplatine 40 mg/m2 bestaat indien mogelijk. Pembrolizumab is in combinatie met platinumbevattende chemotherapie, met of zonder bevacizumab, werkzaam bij patiënten met een gerecidiveerd of gemetastaseerd PD-L1-positief cervixcarcinoom.3
In de hier te bespreken KEYNOTE-A18-studie wordt onderzocht of toevoeging van pembrolizumab aan radiochemotherapie gevolgd door 15 cycli pembrolizumab monotherapie bij patiënten met een lokaal gevorderd cervixcarcinoom (FIGO-stadium IB2-IIB met aangedane lymfeklieren of stadium III-IVA onafhankelijk van de lymfeklierstatus) leidt tot een betere progressievrije en totale overleving.4,5
EMA heeft pembrolizumab goedgekeurd in combinatie met chemoradiotherapie (uitwendige radiotherapie gevolgd door brachytherapie) voor de behandeling van volwassenen met stadium III-IVA lokaal uitgebreid cervixcarcinoom.
Kankersoort en lijn van behandeling
Pembrolizumab toegevoegd aan radiochemotherapie werd onderzocht bij patiënten met een lokaal gevorderd cervixcarcinoom (FIGO 2014-stadium IB2-IIB met locoregionale lymfekliermetastasen of stadium III-IVA onafhankelijk van de lymfeklierstatus).
Vergelijking met de referentiebehandeling in Nederland
In de KEYNOTE-A18-studie wordt pembrolizumab toegevoegd aan radiochemotherapie en nadien 15 cycli pembrolizumab monotherapie vergeleken met alleen radiochemotherapie. De radiochemotherapie in de KEYNOTE-A18-studie bestaat uit 5 wekelijkse kuren cisplatine 40 mg/m2 (met optioneel een zesde kuur naar inzicht van de behandelaar) in combinatie met 45-50 Gy uitwendige radiotherapie gedurende 40 dagen (23-28 fracties van 1,8-2,0 Gy per fractie), eventueel met boost, gevolgd door brachytherapie met 25-30 Gy in 4-6 fracties. In Nederland worden patiënten met een lokaal gevorderd cervixcarcinoom behandeld met radiochemotherapie, waarbij de chemotherapie uit maximaal 6 wekelijkse kuren cisplatine 40 mg/m2 (of eventueel carboplatine AUC2) bestaat. De radiotherapeutische behandeling wordt gegeven op basis van 3D-beeldgeleiding en er vindt optimalisatie voor het tumorvolume plaats.
De referentiebehandeling in de studie komt hiermee grotendeels overeen met de Nederlandse praktijk.
Methoden van de studie
De KEYNOTE-A18-studie is een gerandomiseerde, dubbelblinde, placebogecontroleerde fase III-multicenterstudie voor patiënten met een primair gediagnosticeerd lokaal gevorderd histologisch bewezen cervixcarcinoom, FIGO 2014-stadium IB2-IIB met aangedane lymfeklieren of stadium III-IVA onafhankelijk van de lymfeklierstatus. Een aangedane lymfeklier werd gedefinieerd als histologisch bevestigd, PET-positief of met een korte as van ten minste 15 mm op de CT- of MRI-scan. Er mocht sprake zijn van een plaveiselcelcarcinoom, adenocarcinoom of een adenosquameus carcinoom. Patiënten van 18 jaar of ouder die geen eerdere chirurgie, radiotherapie of systemische therapie voor cervixcarcinoom ontvangen hadden, met een ECOG-performancestatus van 0 of 1, een goede nierfunctie (GFR ≥ 50 ml/min) en radiologisch evalueerbare ziekte (volgens RECIST 1.1) konden voor inclusie in aanmerking komen. Patiënten met bilaterale hydronefrose mochten geïncludeerd worden als ten minste eenzijdig een goed functionerende stent of nefrostomiekatheter was geplaatst. Patiënten met een actieve auto-immuunziekte waarvoor de 2 jaar voorafgaand aan inclusie systeemtherapie nodig was, werden geëxcludeerd. PD-L1-expressie werd bepaald bij screening maar patiënten mochten onafhankelijk van PD-L1- expressie geïncludeerd worden.
Patiënten werden 1:1 gerandomiseerd tussen behandeling met 5 cycli pembrolizumab 200 mg of placebo intraveneus elke 3 weken toegevoegd aan radiochemotherapie gevolgd door 15 6-wekelijkse cycli pembrolizumab 400 mg of placebo na de radiochemotherapie. De radiochemotherapie bestond uit 5 wekelijkse kuren cisplatine 40 mg/m2 (met optioneel een zesde kuur naar inzicht van de behandelaar) in combinatie met 45-50 Gy uitwendige radiotherapie gedurende 40 dagen (23-28 fracties van 1,8-2,0 Gy per fractie), eventueel met boost, gevolgd door brachytherapie met 25-30 Gy in 4-6 fracties. De kwaliteit van de radiotherapie werd centraal beoordeeld.
Er werd gestratificeerd naar soort radiotherapie (intensity modulated radiation therapy [IMRT] of volumetric modulated arc therapy [VMAT] versus non-IMRT of non-VMAT), FIGOstadium (stadium IB2-IIB en klierpositief versus stadium IIIIVA), en geplande totale dosis radiotherapie (uitwendige radiotherapie plus brachytherapie < 70 Gy versus ≥ 70 Gy).
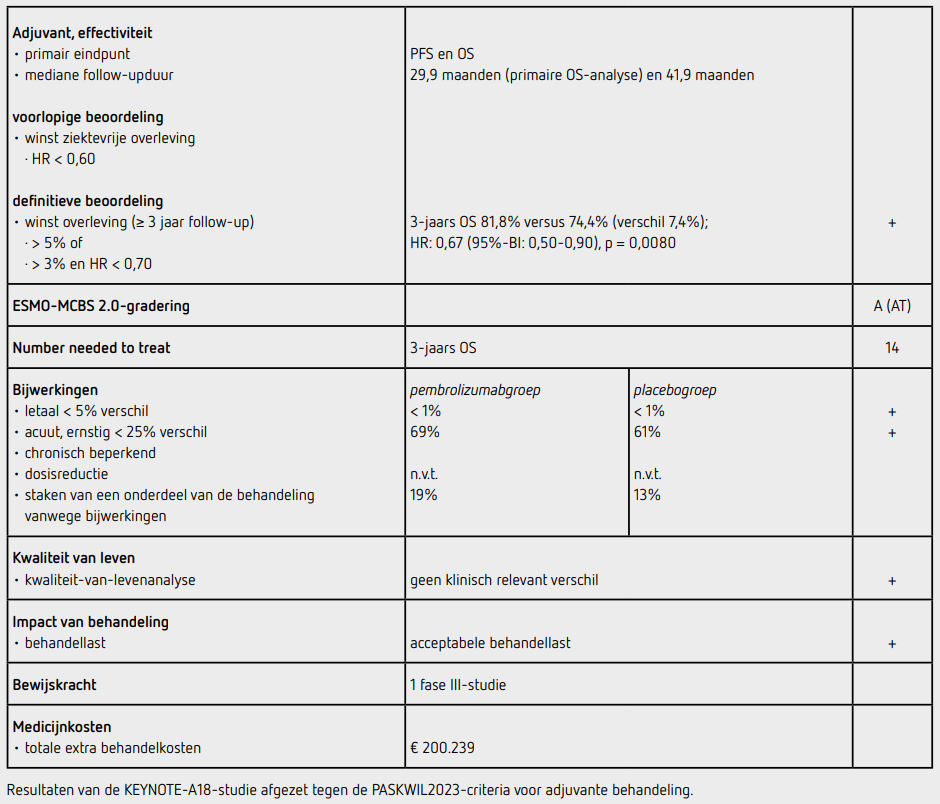
Behandelonderbreking van pembrolizumab, chemotherapie en radiotherapie was toegestaan. Radiologische evaluatie, middels MRI-abdomen en pelvis en CT-thorax vond plaats bij baseline, 12 weken na het afronden van de radiochemotherapie, daarna elke 12 weken gedurende de eerste 2 jaar, elke 24 weken in het derde jaar en jaarlijks vanaf het vierde jaar. Bij baseline en 12 weken na afronden van radiochemotherapie werd een FDG-PET-scan verricht. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0. Kwaliteit van leven werd gemeten met de vragenlijsten EORTC QLQ-C30, QLQ-CX24, PGI-S, PGI-C en EQ-5D-5L. Data over vervolgbehandelingen zijn verzameld. De twee primaire eindpunten van de studie waren progressievrije overleving (PFS) en overleving (OS). PFS werd door de lokale onderzoeker radiologisch vastgesteld volgens RECIST 1.1 of middels een histologisch biopt van een groeiende laesie. Secundaire eindpunten waren onder meer PFS en OS naar PD-L1-expressie, het percentage objectieve respons, tijd van randomisatie tot tweede ziekteprogressie of overlijden (PFS-2), 3-jaars OS en veiligheid.
Volgens het ontwerp van de studie waren 980 patiënten en 304 PFS-events nodig voor 95 procent power bij een eenzijdige alfa van 0,025 om een verbetering in 2-jaars PFS te detecteren van 57 procent in de placebogroep naar 69 procent in de pembrolizumabgroep (hazard ratio [HR] 0,660). Volgens de hiërarchische testprocedure kon OS worden getest zodra PFS significant was. 240 OS-events waren nodig om met 86 procent power bij een eenzijdige alfa van 0,025 een verbetering in 3-jaars OS van 64,3 naar 74,5 procent (HR: 0,671) aan te tonen. In juni 2022 werd het aantal inclusies verhoogd met ongeveer 10 procent vanwege verwachte uitval van patiënten door de COVID-19- pandemie en de oorlog in Oekraïne. Er was voorzien in twee interim-analyses. De eerste interim-analyse was voor PFS en vond plaats na 237 PFS-events.4 De grens voor statistische significantie van deze PFS-interim-analyse was 0,0172 (eenzijdig). De tweede interim-analyse was voor OS en was gepland ongeveer 34 maanden na randomisatie van de eerste patiënt en nadat 182 patiënten overleden waren. De grens voor statistische significantie van deze OS-interim-analyse was 0,01026 (eenzijdig).
Effectiviteit van de behandeling afgezet tegen de bijwerkingen van de behandeling
Tussen juni 2020 en december 2022 werden 1562 patiënten gescreend voor deelname aan de KEYNOTE-A18-studie. 502 patiënten voldeden niet aan de inclusiecriteria waarna 1060 patiënten werden gerandomiseerd tussen pembrolizumab (529 patiënten) en placebo (531 patiënten). De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: 74 procent van de patiënten had een ECOG-performancestatus van 0, 57 procent van de patiënten had een FIGO 2014-stadium III-IVA, 17 procent had geen lymfekliermetastasen, 61 procent had lymfekliermetastasen beperkt tot het kleine bekken, 83 procent had een squameuze histologie van het cervixcarcinoom en 94 procent had een positieve PD-L1-status (combined positive score [CPS] ≥ 1).
Bij de eerste interim-analyse voor PFS was de mediane followupduur 17,9 maanden. 269 patiënten hadden een PFS-event; 115 in de pembrolizumabgroep en 154 in de placebogroep. De PFS was statistisch significant beter in de pembrolizumabgroep dan in de placebogroep (HR: 0,70 [95%-BI: 0,55-0,89]; eenzijdige p = 0,0020).
De mediane follow-up ten tijde van de tweede interim-analyse bedroeg 29,9 maanden. Ten tijde van deze analyse waren 184 patiënten overleden, 75 patiënten (14 procent) in de pembrolizumabgroep en 109 patiënten (21 procent) in de placebogroep.
De OS was statistisch significant beter in de pembrolizumabgroep dan in de placebogroep (HR: 0,67 [95%-BI: 0,50-0,90]; eenzijdige p = 0,0040). In beide groepen was de mediane OS nog niet bereikt. De geschatte 3-jaars OS was 82,6 procent (95%-BI: 78,4-86,1) in de pembrolizumabgroep en 74,8 procent (95%-BI: 70,1-78,8) in de placebogroep. In de groep patiënten met FIGO-stadium IB2-IIB leek de meerwaarde van pembrolizumab beperkt (HR:0,89 [95%-BI: 0,55-1,44]). Ook patiënten van 65 jaar of ouder of met PD-L1-negatieve tumoren leken iets minder baat bij pembrolizumab te hebben, maar deze groepen zijn klein. Bij patiënten met een FIGO-stadium III-IV was de HR voor OS 0,57 (95%-BI: 0,39-0,83). Tijdens het ASCO 2025- congrescongres werden de finale OS-resultaten gepresenteerd bij een mediane follow-upduur van 41,9 maanden.6 In de pembrolizumabgroep waren 107 patiënten (20,2 procent) overleden en in de placebogroep waren 140 patiënten (26,4 procent) overleden. De 3-jaarsoverleving was 81,8 procent in de pembrolizumabgroep en 74,4 procent in de placebogroep (HR: 0,73 [95%-BI: 0,57-0,94]).
Op 2 patiënten na (één in elke groep) startten alle patiënten met behandeling. Er was geen verschil tussen de beide groepen wat betreft aantal kuren cisplatine of dosis radiotherapie. Behandelingsgerelateerde bijwerkingen van graad 3 of hoger traden op bij 365 patiënten (69 procent) in de pembrolizumabgroep en bij 325 patiënten (61 procent) in de placebogroep. Meest voorkomende bijwerkingen van graad 3 of hoger waren anemie (19 versus 16 procent) en neutropenie (15 procent in beide groepen). Immuungerelateerde bijwerkingen van graad 3 of hoger kwamen voor bij 25 patiënten (5 procent) in de pembrolizumabgroep, en bij 7 patiënten (1 procent) in de placebogroep. Staken van een onderdeel van de behandeling vanwege bijwerkingen (voornamelijk hematologisch) kwam voor bij 99 patiënten (19 procent) in de pembrolizumabgroep en bij 69 patiënten (13 procent) in de placebogroep. In beide groepen waren 2 behandelingsgerelateerde overlijdens (immuungemedieerde gastritis en darmperforatie in de pembrolizumabgroep, beenmergfalen en neutropene colitis in de placebogroep). Kwaliteit van leven was vergelijkbaar in beide behandelgroepen.
Na progressie of recidief kregen 154 patiënten in de pembrolizumabgroep een vorm van systemische therapie, waarvan 18 patiënten (11,7 procent) immuuntherapie. In de placebogroep kregen 204 patiënten systemische therapie na progressie, waarvan 68 patiënten (33,3 procent) immuuntherapie.
Kwaliteit van de studie en interpretatie van de uitkomsten
De KEYNOTE-A18-studie betreft een placebogecontroleerde studie met een referentiebehandeling die overeenkomt met de Nederlandse praktijk De duur van de adjuvante behandeling met pembrolizumab is met 2 jaar bijzonder lang. Een biologische rationale voor deze behandelduur ontbreekt.
Inmiddels is immuuntherapie onderdeel van de standaardbehandeling bij PD-L1-positief gemetastaseerd cervixcarcinoom. In de placebogroep kreeg slechts een derde van de patiënten immuuntherapie als onderdeel van de systemische therapie bij progressie of recidief. Hierbij moet wel worden aangemerkt dat ongeveer 10 procent PD-L1-negatief zal zijn en hiermee geen indicatie voor immuuntherapie in gemetastaseerde setting heeft. Suboptimale behandeling bij progressie kan leiden tot een overschatting van het overlevingsvoordeel in de curatieve setting. Het primaire eindpunt PFS werd tussentijds gewijzigd van centraal bepaald naar door de onderzoeker vastgesteld. Ook werd middels amendement vastgelegd dat de eindpunten hiërarchisch getest zouden worden. Aanvankelijk zouden PFS en OS gelijktijdig getest worden, maar dit is op basis van hoger ingeschatte OS in de placebogroep gewijzigd naar het hiërarchisch testen van eerst PFS en later OS om de alfa te kunnen hergebruiken bij een positieve PFS-analyse. Ook is tijdens de looptijd van de studie het aantal te includeren patiënten met 10 procent verhoogd.
Discussie
In de KEYNOTE-A18-studie wordt na een follow-upduur van 29,9 maanden een statistisch significant voordeel aangetoond voor het primaire eindpunt OS door het toevoegen van pembrolizumab aan radiochemotherapie bij patiënten met een lokaal gevorderd cervixcarcinoom (HR: 0,67 [95%-BI: 0,50-0,90]; p = 0,0040) met een verschil in geschatte 3-jaars OS van 7,8 procent. Dit overlevingsvoordeel persisteert bij een langere follow-upduur van 41,9 maanden met een verschil in 3-jaars OS van 7,4 procent. De resultaten van dit eindpunt voldoen aan de PASKWIL2023-criteria voor adjuvante behandeling voor een positief advies. Hoewel cieBOM geen specifieke PASKWILcriteria heeft voor de primaire setting, is OS de algemeen geaccepteerde gouden standaard voor effectiviteit van in opzet curatieve behandelingen. De OS in de KEYNOTE-A18-studie kan dus volgens de hiertoe geldende PASKWIL-criteria beoordeeld worden.
In de groep patiënten met FIGO-stadium IB2 tot IIB was de toegevoegde waarde van pembrolizumab kleiner dan in de groep patiënten met FIGO-stadium III-IVA. Door EMA is de toevoeging van pembrolizumab dan ook alleen goedgekeurd voor patiënten met een FIGO-stadium III-IVA. Van de geïncludeerde patiënten had 95 procent een PD-L1-positieve tumor. Er valt op basis van de huidige gegevens geen subgroep te definiëren die meer of minder baat heeft van de toevoeging van pembrolizumab. Er wordt geen informatie gegeven over de effectiviteit in de verschillende histologische subtypen. De optimale timing en behandelduur van pembrolizumab zijn nog onvoldoende duidelijk. De lange behandelduur met pembrolizumab drijft de kosten van deze behandeling fors op.
Het in deze studie beschreven bijwerkingenprofiel van pembrolizumab komt overeen met wat bekend is van andere studies. De behandeling wordt over het algemeen goed verdragen en de bijwerkingen zijn hanteerbaar.
Het is onduidelijk hoe de toevoeging van pembrolizumab zich verhoudt tot het toevoegen van chemotherapie aan chemoradiatie volgens de INTERLACE-studie.7 Dit onderwerp wordt separaat geadresseerd in een plaatsbepaling.
Kosten
De kosten voor pembrolizumab bedragen 2.861 euro per 100 mg; daarmee komen de kosten voor 5 cycli van 200 mg en 15 cycli van 400 mg op 200.239 euro per patiënt (bron: medicijnkosten.nl, d.d. augustus 2025).
Conclusie
In de hier besproken KEYNOTE-A18-studie wordt bij patiënten met een lokaal gevorderd cervixcarcinoom na een mediane follow-up van 29,9 maanden een langere OS (HR: 0,67 [95%-BI: 0,50-0,90]; p = 0,0040) gezien met pembrolizumab en radiochemotherapie vergeleken met placebo en radiochemotherapie. Bij een langere follow-up van 41,9 maanden bedraagt het verschil in 3-jaars OS 7,4 procent. Deze resultaten voldoen aan de PASKWIL2023-criteria voor adjuvante behandeling voor een positief advies. EMA heeft deze behandeling goedgekeurd voor patiënten met FIGO-stadium III-IVA.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Wenzel HH, Bekkers RL, Lemmens VE et al. No improvement in survival of older women with cervical cancer: a nationwide study. Eur J Cancer 2021;151:159-67.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab bij patiënten met een progressief gerecidiveerd of gemetastaseerd cervixcarcinoom. Med Oncol 2022;25(7):40-5.
- Lorusso D, Xiang Y, Hasegawa K et al. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. Lancet 2024;403(10434):1341-50.
- Lorusso D, Xiang Y, Hasegawa K et al. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2024;404(10460):1321-32.
- Duska LR, Xiang Y, Hasegawa K et al. Pembrolizumab with chemoradiotherapy in patients with high-risk locally advanced cervical cancer: Final analysis results of the phase 3, randomized, double-blind ENGOT-cx11/GOG-3047/KEYNOTE-A18 study. J Clin Oncol 2025;43(17 suppl):LBA 5504. McCormack M, Eminowicz G, Gallardo D et al. Induction chemotherapy followed by standard chemoradiotherapy versus standard chemoradiotherapy alone in patients with locally advanced cervical cancer (GCIG INTERLACE): an international, multicentre, randomised phase 3 trial. Lancet 2024;404(10462):1525-35.