
Inleiding
Met ruim 2200 nieuwe gevallen in 2022 is het endometriumcarcinoom in Nederland de meest voorkomende gynaecologische maligniteit.1 Het endometroïde subtype komt met 85 procent het meest frequent voor. Vijf jaar na diagnose is 80 procent van de patiënten nog in leven en bij diagnose heeft ongeveer 20 procent van de patiënten FIGO-stadium III of IV ziekte. De gebruikelijke eerstelijns systemische behandeling van het primair gemetastaseerde of gerecidiveerde endometriumcarcinoom bestaat uit driewekelijkse toedieningen van carboplatine en paclitaxel. Een hoge microsatellietinstabiliteit (MSI-H) of een mismatch repair-deficiëntie (dMMR), somatisch verworven of in het kader van het lynchsyndroom, komt voor in 28 procent van de endometriumcarcinomen.2 Mede in verband hiermee is veel onderzoek verricht naar het effect van behandeling met programmed death-1 (PD-1)-remmers.
In de RUBY ENGOT-EN6-studie gaf toevoeging van dostarlimab aan eerstelijns carboplatine en paclitaxel bij het gerecidiveerd of gevorderd (stadium III en IV) endometriumcarcinoom een verbetering in PFS en OS ten opzichte van placebo, waarbij met name patiënten met een dMMR-tumor baat leken te hebben bij deze toevoeging.3 Deze verbetering leidde tot een positief cieBOM-advies.4 De aanvankelijke EMA-goedkeuring van dostarlimab in combinatie met eerstelijns chemotherapie voor patiënten met een dMMR endometriumcarcinoom is in latere instantie omgezet naar goedkeuring voor alle patiënten met een endometriumcarcinoom, onafhankelijk van de MMR-status. In de DUO-E-studie is het effect van durvalumab met of zonder olaparib toegevoegd aan chemotherapie onderzocht, waarbij bij patiënten met een dMMR-tumor een toename van PFS wordt gezien met durvalumab en bij patiënten met een pMMR-tumor een PFS winst werd gezien met de combinatie van durvalumab en olaparib en niet met durvalumab alleen.5 In de hier te bespreken KEYNOTE-868/NRG-GY018-studie werd behandeling met de PD-1-remmer pembrolizumab toegevoegd aan carboplatine en paclitaxel geëvalueerd bij patiënten met een FIGO-stadium III/IVA/IVB endometriumcarcinoom of recidief endometriumcarcinoom.6
EMA heeft pembrolizumab toegevoegd aan carboplatine en paclitaxel geregistreerd voor de eerstelijnsbehandeling van het primair gemetastaseerd of gerecidiveerd endometriumcarcinoom.
1. Kankersoort en lijn van behandeling
Eerstelijnsbehandeling met pembrolizumab toegevoegd aan behandeling met carboplatine en paclitaxel werd onderzocht bij patiënten met een FIGO-stadium III of IV endometriumcarcinoom of ziekterecidief.
2. Vergelijking met de referentiebehandeling in Nederland
In de Nederlandse praktijk bestaat de eerstelijnsbehandeling van het gevorderd of gerecidiveerd endometriumcarcinoom uit driewekelijkse toedieningen van carboplatine en paclitaxel. Hiermee komt de standaardbehandeling in de studie overeen met de standaardbehandeling in Nederland.
Dostarlimab toegevoegd aan eerstelijns chemotherapie wordt sinds eind april 2025 vergoed voor patiënten met een dMMR-endometriumcarcinoom en werd nog niet toegepast ten tijde van de uitvoering van deze studie.
3. Methode en kwaliteit van de studie
De KEYNOTE-868/NRG-GY018-studie is een dubbelblind, placebogecontroleerde, gerandomiseerde fase III-multicenterstudie voor patiënten met een FIGO-stadium III/IVA/IVB endometriumcarcinoom of recidief.
Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0, 1 of 2 te hebben. Na inclusie en voorafgaand aan randomisatie werd de MMR-status centraal bepaald (NeoGenomics Laboratories, Inc.) door middel van immunohistochemisch onderzoek. Na allocatie in het dMMR- of pMMR-cohort vond randomisatie plaats. Alle histologische subtypes waren geschikt voor inclusie met uitzondering van het carcinosarcoom. Eerdere chemotherapie was niet toegestaan, tenzij deze als adjuvante behandeling was gegeven en ten minste 12 maanden tevoren was beëindigd. Eerdere radiotherapie (mits ten minste 4 weken voor inclusie beëindigd) of endocriene therapie (mits ten minste 3 weken voor inclusie beëindigd) was toegestaan.
Patiënten met primair stadium III of IVA moesten meetbare ziekte hebben volgens RECIST 1.1. Voor patiënten met stadium IVB of recidiefziekte was dit niet noodzakelijk. In het dMMR- en het pMMR-cohort werden patiënten 1:1 gerandomiseerd tussen de pembrolizumabgroep en de placebogroep. De behandeling bestond uit 6 3-wekelijkse intraveneuze cycli carboplatine (AUC 5) en paclitaxel (175 mg/m2) met pembrolizumab (200 mg) of placebo, gevolgd door 6-wekelijkse toedieningen pembrolizumab (400 mg) of placebo tot het moment van ziekteprogressie of voor een maximale behandelduur van 14 cycli. De behandeling werd gestratificeerd naar ECOG-performancestatus (0 of 1 versus 2) en eerdere adjuvante chemotherapie (ja versus nee). Dosisaanpassing van carboplatine en paclitaxel was toegestaan, maar van pembrolizumab of placebo niet. De toediening van alle middelen mocht worden uitgesteld of onderbroken. De behandeling kon vroegtijdig worden afgebroken op verzoek van de patiënt, bij klinische verslechtering van de conditie van de patiënt, om veiligheidsredenen of wegens het starten van een andere oncologische behandeling.
Primair eindpunt van de studie was progressievrije overleving (PFS), vastgesteld door de lokale onderzoeker voor het dMMR- en pMMR-cohort afzonderlijk. Secundaire eindpunten waren onder andere overleving (OS) voor het dMMR- en pMMR-cohort, objectieve responskans, veiligheid en kwaliteit van leven (alleen gemeten in het pMMR-cohort).
Een CT-scan voor responsevaluatie werd in de eerste 12 maanden elke 9 weken verricht en daarna elke 12 weken. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0. Data over vervolgbehandelingen zijn niet gerapporteerd.
In het ontwerp van de studie werd uitgegaan van twee aparte cohorten (dMMR- en pMMR-cohort) met elk een eigen powerberekening. De verwachte inclusieduur was 44 en 29,5 maanden voor respectievelijk het dMMR- en het pMMR-cohort. In beide cohorten werd een eenzijdige alfa van 0,0125 gehanteerd, die bij significantie in het ene cohort kon worden doorgezet naar het andere cohort. Voor het dMMR-cohort was berekend dat als de hazard ratio (HR) voor PFS 0,60 was, 85 procent power behaald werd bij 168 PFS-events, waar een inclusie van 220 patiënten voor nodig was. Voor het pMMR-cohort werd berekend dat als de HR voor PFS 0,70 was 394 events nodig waren voor 90 procent power, hetgeen behaald kon worden met 590 te includeren patiënten. Bij 50 procent van het aantal events was een interim-analyse voor futiliteit gepland. Een interim-analyse voor effectiviteit was per cohort gepland zodra alle patiënten in het betreffende cohort geïncludeerd waren en minimaal de helft van de PFS events had plaatsgevonden. De alfa kon volgens de Lan-DeMets-alfa-verdelings-methode worden bepaald aan de hand van het aantal PFS-events. Bij 70 procent van de PFS-events zou de alfa 0,003 zijn voor beide cohorten. In beide cohorten wordt informatie verzameld tot het totaal aantal geplande events heeft plaatsgevonden en de finale analyse kan worden verricht.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen juli 2019 en december 2022 werden door 395 centra in 4 landen (Verenigde Staten, Canada, Japan en Zuid-Korea) 816 patiënten geïncludeerd, 225 patiënten in het dMMR-cohort (112 in de pembrolizumabgroep en 113 in de placebogroep) en 591 patiënten in het pMMR-cohort (295 in de pembrolizumabgroep en 296 in de placebogroep ). De uitgangskarakteristieken in het dMMR-cohort en het pMMR-cohort verschilden niet significant per behandelgroep. De mediane leeftijd lag rond de 66 jaar, circa twee derde had een performancestatus van 0, ongeveer 60 procent van de patiënten had een ziekterecidief, 40 procent had eerder radiotherapie ondergaan en 90 procent had eerder chirurgie ondergaan. In het pMMR-cohort had 25 procent van de patiënten adjuvante chemotherapie gehad; in het dMMR-cohort was dat 6 procent.
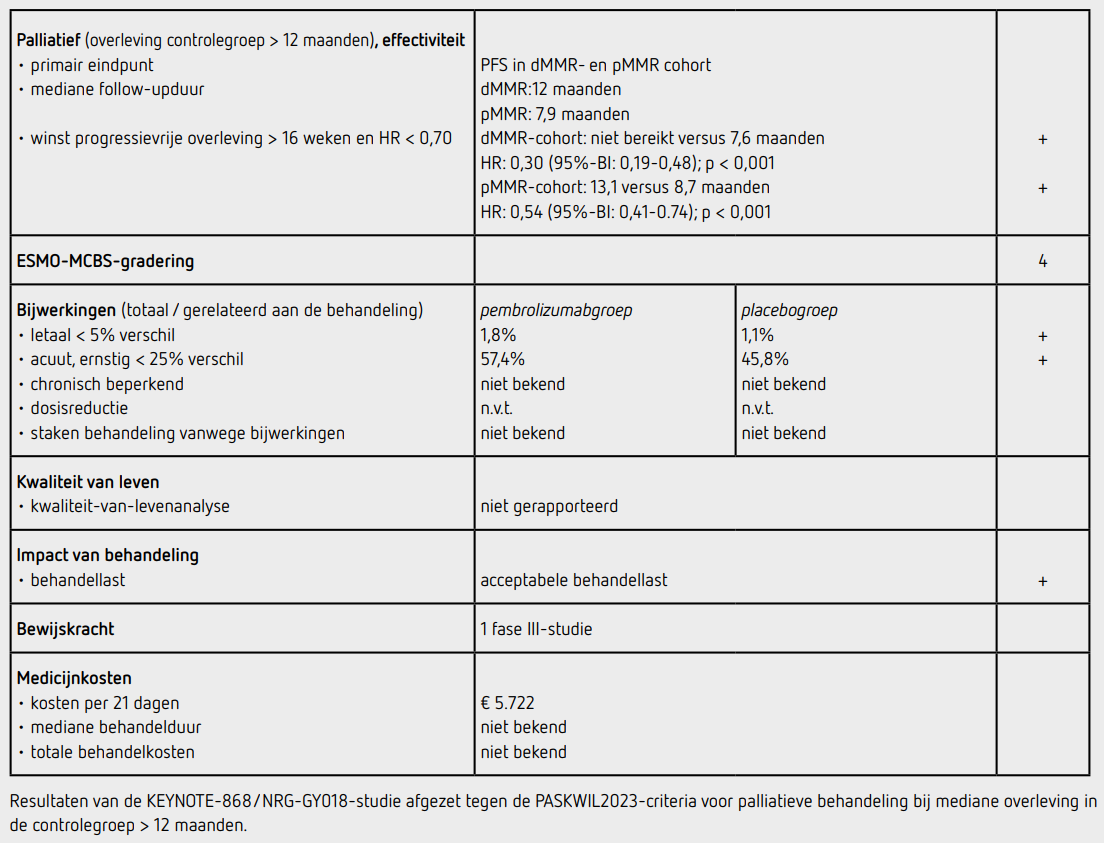
Ten tijde van de interim-analyse van het primaire eindpunt PFS bedroeg de mediane follow-upduur 12 maanden in het dMMR-cohort. 85 patiënten in het dMMR-cohort hadden ziekteprogressie of waren overleden (50,6 procent van het gepland aantal PFS-events). Het primaire eindpunt PFS in het dMMR-cohort was statistisch significant beter in de groep van patiënten die behandeld werden met pembrolizumab (HR: 0,30 [95%-BI: 0,19-0,48]; p < 0,001). De mediane PFS in de pembrolizumabgroep was nog niet bereikt (95%-BI: 30,6 maandenniet bereikt) en in de placebogroep bedroeg deze 7,6 maanden (95%-BI: 6,4-9,9). De mediane followupduur was 7,9 maanden in het pMMR-cohort en in dit cohort hadden 222 patiënten ziekteprogressie of waren overleden (56,5 procent van het gepland aantal PFS-events). Het primaire eindpunt PFS was ook in het pMMR-cohort statistisch significant beter in de pembrolizumabgroep dan in de placebogroep (HR: 0,54 [95%-BI: 0,41-0,71]; p < 0,001). De mediane PFS in de pembrolizumabgroep was 13,1 maanden (95%-BI: 10,5-18,8) en in de placebogroep 8,7 maanden (95%BI: 8,4-10,7). Er was geen duidelijk verschil tussen de vooraf gespecificeerde subgroepen bij beide cohorten.
De mediane behandelduur of het aantal toegediende cycli wordt niet vermeld in de publicatie.
Er waren in totaal 385 patiënten (95 procent) in de pembrolizumabgroep en 380 patiënten (93 procent) in de placebogroep die ten minste één dosis medicatie ontvingen. Er wordt niet gemeld hoeveel patiënten de behandeling voortijdig staakten vanwege bijwerkingen.
In totaal hadden 221 patiënten (57,4 procent) in de pembrolizumabgroep, en 174 patiënten (45,8 procent) in de placebogroep ten minste één bijwerking van graad 3 of hoger. De meest voorkomende bijwerkingen van graad 3 of 4 in de pembrolizumabgroep en in de placebogroep waren neutropenie (16,6 versus 13,4 procent) en anemie (15,3 versus 9,5 procent. Immuungerelateerde bijwerkingen van graad 3 of hoger werden bij 19 patiënten (4,9 procent) in de pembrolizumabgroep gezien en bij 13 patiënten (3,4 procent) in de placebogroep. In de pembrolizumabgroep waren in totaal 7 patiënten (1,8 procent) overleden als gevolg van de behandeling; in de placebogroep waren dat 4 patiënten (1,1 procent).
De resultaten van analyses van kwaliteit van leven zijn niet gerapporteerd. Ook wordt er geen informatie gegeven over eventuele vervolgbehandelingen.
Kwaliteit van de studie en interpretatie van de uitkomsten
In dit rapport worden de resultaten van de interim-analyse voor PFS besproken van het dMMR- en het pMMR-cohort. De follow-upduur is op het moment van analyse nog kort, namelijk mediaan minder dan 8 maanden in het pMMR-cohort. Ook ontbreken nog veel data, bijvoorbeeld de analyse van de kwaliteit van leven, de behandelduur, het aantal patiënten dat stopte met de behandeling vanwege bijwerkingen en informatie over vervolgbehandelingen. De OS-analyse is nog niet matuur. Met name in het pMMR-cohort is het aantal gecensorde patiënten in de eerste 6 maanden erg hoog (de reden hiervan is niet duidelijk en dus kan niet worden bepaald of de censoring al dan niet informative is, oftewel gecorreleerd is aan het te onderzoeken effect) en waarschijnlijk mede hierdoor overlappen de betrouwbaarheidsintervallen van de Kaplan-Meier-curves gedurende ten minste de eerste 10 maanden. Dit alles verkleint de betrouwbaarheid van het gevonden effect, met name voor het pMMR-cohort. De curves van het dMMR-cohort lopen meer en vroeger uiteen, getuige de lagere HR, en het percentage gecensorde patiënten lijkt lager. Zowel in het pMMR-cohort als in het dMMR-cohort lijken de hazards niet proportioneel. Er wordt geen melding gemaakt van een analyse om het verschil tussen de behandelgroepen te schatten die hier rekening mee houdt, bijvoorbeeld door het bepalen van de restricted mean survival time. Met betrekking tot de interpretatie van de studieresultaten dient te worden opgemerkt dat de KEYNOTE-868-studie voor het dMMR-patiëntencohort de vraag niet gaat beantwoorden of de combinatie van eerstelijns standaard chemotherapie en pembrolizumab superieur is aan een sequentiële benadering (eerstelijns standaard chemotherapie, gevolgd door tweedelijns monotherapie met pembrolizumab).
Discussie
De NRG-GY018-studie is een dubbelblinde placebogecontroleerde gerandomiseerde fase III-multicenterstudie voor patiënten met een FIGO-stadium III/IVA/IVB endometriumcarcinoom of endometriumcarcinoomrecidief, waarin de toevoeging van de PD-1-remmer pembrolizumab aan eerstelijns chemotherapie met carboplatine en paclitaxel werd onderzocht.
In het pMMR-cohort was toevoeging van pembrolizumab aan standaardchemotherapie geassocieerd met een statistisch significante toename van 19 weken van het primaire eindpunt PFS (HR: 0,54 [95%-BI: 0,41-0,71]; p < 0,001). Deze uitkomsten voldoen aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep > 12 maanden.
Hoewel in het dMMR-cohort de mediane PFS in de pembrolizumabgroep nog niet bereikt is, zal het PFS verschil met de controlegroep zeker groter zijn dan 16 weken na inspectie van de KaplanMeiercurves (HR: 0,30 [95%BI: 0,19-0,48]; p < 0,001). Op basis hiervan voldoen de resultaten van het dMMRc-ohort ook aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep > 12 maanden.
Voor patiënten met een dMMR-endometriumcarcinoom lijkt de toevoeging van dostarlimab, durvalumab en pembrolizumab aan chemotherapie een duidelijke meerwaarde te hebben met verbetering van PFS bij alle drie de middelen en OS voor dostarlimab. Ook bij patiënten met een pMMR-tumor is er toename van PFS met dostarlimab en pembrolizumab en voor durvalumab alleen wanneer ook olaparib wordt toegevoegd. Het effect van pembrolizumab bij pMMR-tumoren is beperkter en de mate van onzekerheid is groter dan bij dMMR-tumoren. Voor de plaats van deze behandelingen bij patiënten met endometriumcarcinoom en een pMMR-tumor is nadere duiding door de richtlijncommissie derhalve wenselijk.
5. Kosten
De marktprijs van pembrolizumab bedraagt 2861 euro per 4 ml ampul van 100 mg (bron: medicijnkosten.nl d.d. april 2025). Dit komt neer op 5722 euro voor een driewekelijkse toediening en 11.444 euro voor een zeswekelijkse toediening. Omdat de mediane behandelduur niet in de publicatie werd vermeld, kan de kostprijs van de gehele behandeling, gespecificeerd naar MMR-status, niet worden berekend.
Conclusie
Toevoeging van pembrolizumab aan eerstelijns chemotherapie voor patiënten met een FIGO-stadium III/IVA/IVB endometriumcarcinoom of recidief endometriumcarcinoom leidt zowel bij patiënten met een pMMR- als een dMMR-tumor tot een winst in PFS, die voldoet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep van meer dan 12 maanden. Het effect is het meest overtuigend bij patiënten met een dMMR-tumor. De follow-upduur ten tijde van deze interim-analyse is nog kort.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl).
- Levine DA. The Cancer Genome Atlas Research Network Integrated genomic characterization of endometrial cancer. Nature 2013; 497: 67-73.
- Mirza MR, Chase DM, Slomovitz BM et al. Dostarlimab for primary advanced or recurrent endometrial cancer. N Engl J Med 2023;388(23):2145-58.
- NVMO-commissie ter beoordeling van Oncologische Middelen (BOM): Dostarlimab toegevoegd aan chemotherapie bij het gevorderd of gerecidiveerd endometriumcarcinoom. Med Oncol 2024; 27(4):36-40.
- Westin SN, Moore K, Chon HS. Durvalumab plus carboplatin/paclitaxel followed by maintenance durvalumab with or without olaparib as first-line treatment for advanced endometrial cancer: The phase III DUO-E trial. J Clin Oncol 2023;42;283-99.
- Eskander RN, Sill MW, Beffa L, et al. Pembrolizumab plus chemotherapy in advanced endometrial cancer. N Engl J Med 2023;388:2159-70.