
Inleiding
Carcinomen uitgaande van de galblaas, galwegen en de ampulla van Vater (verder te noemen cholangiocarcinomen) zijn met een incidentie van 992 nieuwe gevallen in 2021 in Nederland relatief zeldzaam.1 De behandelmogelijkheden zijn in de afgelopen jaren niet wezenlijk veranderd. Slechts 35 procent van de patiënten komt in aanmerking voor chirurgische resectie, de enige behandeling die een kans op curatie geeft. De 5-jaars overleving na in opzet curatieve resectie varieert tussen de 25 en 50 procent. Cholangiocarcinomen presenteren zich vaak met obstructie-icterus en zijn op dat moment meestal irresectabel of al gemetastaseerd.
Fibroblastgroeifactorreceptor (FGFR) 2-genveranderingen zijn betrokken bij de pathogenese van cholangiocarcinoom en worden bijna exclusief gevonden bij patiënten met een intrahepatisch cholangiocarcinoom, waar zij bij 10-16 procent van de patiënten voorkomen. Pemigatinib is een selectieve, krachtige, orale remmer van FGFR1, 2 en 3. In de hier te bespreken FIGHT-202-studie wordt de veiligheid en antitumoractiviteit van pemigatinibbehandeling geëvalueerd bij patiënten met een eerder behandeld, lokaal gevorderd of gemetastaseerd cholangiocarcinoom met en zonder FGFR2-fusies of herschikkingen.2
1. Kankersoort en lijn van behandeling
Pemigatinib is door de EMA voorwaardelijk geregistreerd voor de behandeling van volwassenen met een lokaal gevorderd of gemetastaseerd cholangiocarcinoom met een FGFR2-fusie of herschikking na ten minste één eerdere lijn van systemische behandeling.
Systemische eerstelijnsbehandeling met gemcitabine en cisplatine wordt geadviseerd indien de conditie van de patiënt dit toestaat. Als tweedelijnsbehandeling kan mFOLFOX6 worden overwogen.3 De meerderheid van de patiënten komt vanwege snelle verslechtering van conditie hier niet aan toe. Daarmee is deze studie uitgevoerd conform de behandeling in Nederland.
2. Onderbouwing voor een niet-gerandomiseerde studie
Er is een biologische rationale voor het toepassen van FGF/ FGFR-remmers bij FGFR2-gemuteerde cholangiocarcinomen. Deze subgroep is te weinig voorkomend – bij een al relatief zeldzame kankersoort – voor een vergelijkende studie, wat een niet-gerandomiseerde studie rechtvaardigt.
3. Methode en kwaliteit van de studie
De FIGHT-202-studie is een open label, single arm fase II-multicenterstudie voor volwassen patiënten met een eerder behandeld lokaal gevorderd of gemetastaseerd cholangiocarcinoom met of zonder FGF/FGFR-mutaties.
Inclusiecriteria waren onder andere radiologisch meetbare ziekte volgens RECIST 1.1, een ECOG-performancestatus van 2 of minder, een levensverwachting van ten minste 12 weken, adequate lever en nierfunctie en een serumfosfaat en serumcalcium binnen het institutionele normale bereik. Patiënten met CZS-metastasen konden deelnemen als er sprake was van een stabiele situatie zonder gebruik van corticosteroïden gedurende ten minste 4 weken. Exclusiecriteria waren een hiv-infectie, een actieve hepatitis B- of C-virusinfectie, een abnormaal echocardiogram of ongecontroleerde hartziekte, een voorgeschiedenis of actueel bewijs van ectopische mineralisatie of verkalking, en klinisch significante cornea- of netvliesaandoeningen bevestigd door oogheelkundig onderzoek. Voorafgaand aan inclusie in de studie vond centraal screening plaats op FGF/FGFR-status door middel van DNA-sequencing (FoundationOne, Foundation Medicine, Cambridge, MA, USA). Bij patiënten met een reeds bekende FGF/FGFR-status na lokale analyse werd na inclusie een retrospectieve, centrale FoundationOne-analyse verricht. Op basis van de centrale analyse werden patiënten geïncludeerd in een van de drie cohorten: patiënten met een FGF/ FGFR2-fusie of herschikking, patiënten met een andere FGF/FGFR-mutatie, of patiënten zonder FGF/FGFR-mutatie. Alle patiënten kregen pemigatinib oraal in een startdosis van 13,5 mg eenmaal daags in een 21-daagse cyclus; 2 weken therapie gevolgd door een rustweek. De behandeling werd gecontinueerd tot radiologische progressie van ziekte, onaanvaardbare bijwerkingen, intrekking van de toestemming of keuze van de arts. De dosering van pemigatinib kon tot 14 dagen worden onderbroken als gevolg van bijwerkingen. Hyperfosfatemie, een verwachte bijwerking van FGFR-remming, werd behandeld met behulp van dieetaanpassingen, fosfaatverlagende therapie of dosisaanpassingen. Het primaire eindpunt van de studie was het aandeel patiënten met een FGFR2-fusie of herschikking die volgens onafhankelijke centrale beoordeling een objectieve respons bereikten (ORR).
Secundaire eindpunten waren het aandeel patiënten met een objectieve respons bij patiënten met andere FGF/FGFR-mutaties, bij alle patiënten met FGF/FGFR-mutaties, en bij patiënten zonder FGF/FGFR-mutatie, de duur van respons, het percentage patiënten met ziektecontrole, progressievrije overleving, algehele overleving, veiligheid in alle cohorten en populatie farmacokinetiek.
De tumorrespons werd bepaald met CT of MRI-scans en beoordeeld door onafhankelijke beoordeling volgens RECIST 1.1, gedurende de eerste 12 weken elke 6 weken en daarna elke 9 weken, tot ziekteprogressie of beëindiging om een andere reden dan ziekteprogressie.
De veiligheid werd beoordeeld op basis van de CTCAE 4.03. Vitale functies, 12-afleidingen elektrocardiogrammen en klinische laboratoriumtests inclusief gemiddelde niveaus van 1,25 dihydroxyvitamine D3 (1,25[OH]2D3) en parathyroïdhormoon werden bepaald. De veiligheid werd beoordeeld bij screening, tijdens behandeling (dag 1, 8 en 15 van cyclus 1 en dag 1 van volgende cycli), aan het einde van de behandeling en 30 dagen na stopzetting van de behandeling. De populatie voor analyse van de werkzaamheid omvatte alle patiënten met een centraal bevestigde FGF/FGFR-status die ten minste één dosis pemigatinib kregen. De veiligheidspopulatie omvatte alle patiënten die ten minste één dosis pemigatinib kregen. Een futiliteitsanalyse was gepland nadat ongeveer 25 patiënten met een FGFR2-fusie of herschikking ten minste één tumorbeoordeling na baseline hadden ondergaan of de behandeling definitief hadden stopgezet. Inclusie in dit cohort kon worden stopgezet voor futiliteit als twee of minder van de 25 geïncludeerde patiënten een respons hadden bereikt. Hoewel de studie aanvankelijk was ontworpen om 60 patiënten met FGFR2-fusies of herschikkingen te includeren, werd later een protocolwijziging goedgekeurd (3 oktober 2017) waardoor inclusie in dit cohort kon worden verhoogd tot ongeveer 100 patiënten. Met een veronderstelde ORR van 33 procent, kon met 100 patiënten een 95%-BI met een ondergrens van 15 procent vastgesteld worden. Het 95%-BI voor effectgrootte werd geschat met behulp van de Clopper-Pearson-methode. Voor het primaire eindpunt werden patiënten met onvoldoende data voor responsevaluatie beschouwd als non-responders.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen 17 januari 2017 en 22 maart 2019 werden 1206 patiënten gescreend in 146 centra. Een FGF/FGFR-mutatie werd vastgesteld bij 86 patiënten, de overige 1120 patiënten hadden geen mutatie of zagen af van deelname. Daarnaast konden 85 patiënten aan de studie deelnemen omdat bij hen al eerder een FGF/FGFR-mutatie was aangetoond. 25 patiënten met een FGF/FGFR-mutatie voldeden niet aan de overige inclusiecrite-ria. In totaal werden 146 patiënten met een FGF/FGFR-mutatie geïncludeerd: 107 met een FGFR2-fusie of herschikking, 20 met een andere FGF/ FGFR-mutatie, 18 zonder FGF/FGFR-mutatie en één met een onbepaalde FGF/FGFR-mutatie.
Het cohort patiënten met een FGFR2-fusie of herschikking bestond voor 61 procent uit vrouwen, de mediane leeftijd was 56 jaar, 95 procent had een ECOG-performancestatus van 0 of 1, 82 procent had gemetastaseerde ziekte, 61 procent had één eerdere lijn systemische therapie gehad en 12 procent 3 of meer.
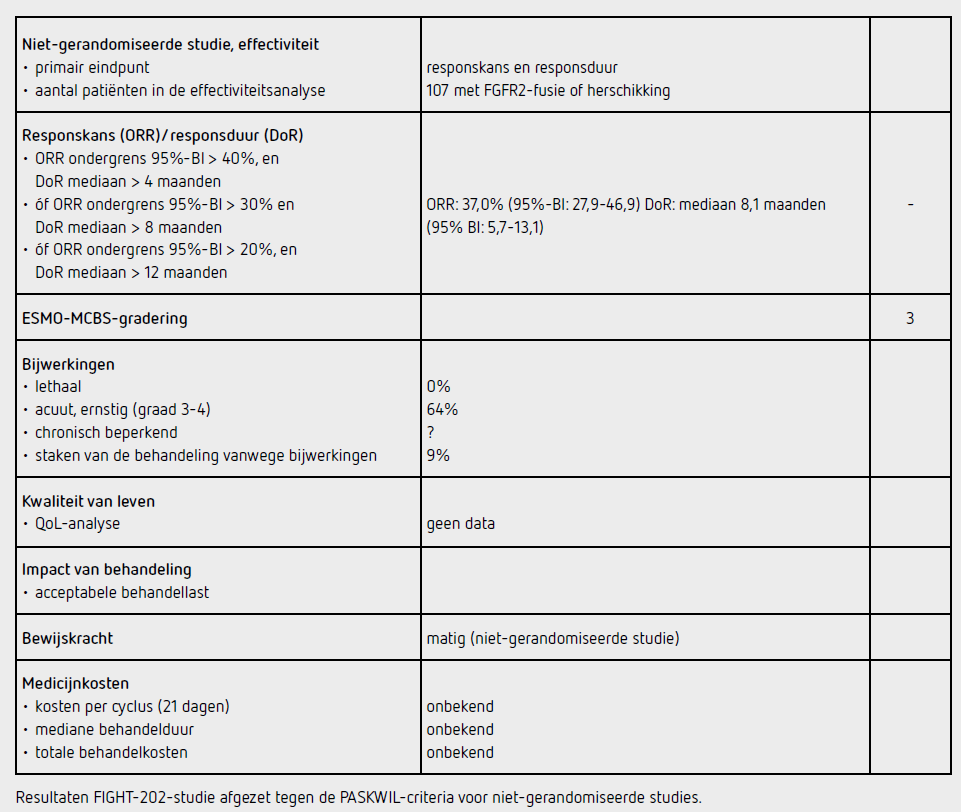
De mediane follow-up was 17,8 maanden (IQR 11,6-21,3). De mediane followup in het cohort patiënten met een FGFR2-fusie of herschikking (populatie voor het primaire eindpunt) was 15,4 maanden (IQR 9,3-19,0). In dit cohort was de ORR 35,5 procent (95%BI: 26,5-45,4) met drie complete responsen en 35 partiële responsen. De mediane responsduur was 7,5 maanden (5,7-14,5).
Hyperfosfatemie, haaruitval en dysgeusie waren veel voorkomende graad 1 en 2 bijwerkingen (respectievelijk bij 55 procent, 46 procent en 38 procent van de patiënten). Een bijwerking van graad 3 of hoger trad op bij 64 procent van de patiënten. Het meest voorkomend waren hypofosfatemie (7 procent), stomatitis (5 procent), artralgie (4 procent) en handvoetsyndroom (4 procent).
5 patiënten hadden een dosisreductie en 6 patiënten een onderbreking van de behandeling in verband met nageltoxiciteit. Bij 6 patiënten traden bijwerkingen aan de ogen op (graad 3 bij 1 patiënt). 13 patiënten stopten de behandeling vanwege bijwerkingen.
Een serious adverse event trad op bij 45 procent van de patiënten; de meest voorkomende waren buikpijn (5 procent), koorts (5 procent), cholangitis (3 procent) en pleurale effusie (3 procent). In totaal stierven 71 patiënten (49 procent) tijdens het onderzoek, waarvan 61 (86 procent van de overledenen) ten gevolge van ziekteprogressie. De overlijdens werden niet gerelateerd aan de behandeling. Tijdens ASCO 2021 werd een update van de FIGHT-202 gerapporteerd.4 De mediane follow-up voor de totale geïncludeerde populatie van 146 patiënten was 30,4 maanden (IQR 4,9-38,7). De mediane behandelduur was 5,9 maanden (0,2-36,5). In het cohort met FGFR2-fusies of herschikkingen werd 9,3 procent van de patiënten nog behandeld met pemigatinib ten tijde van de analyse. In het cohort patiënten met een FGFR2-fusie of herschikking was de onafhankelijke, centraal beoordeelde ORR 37,0 procent (95%BI: 27,9-46,9) met een mediane responsduur van 8,1 maanden (95% BI: 5,7-13,1).
Discussie
In de Fight-202-studie resulteert behandeling met pemigatinib bij patiënten met een eerder systemisch behandeld cholangiocarcinoom en een FGFR2-fusie of herschikking in een ORR van 37,0 procent (95%BI: 27,9 46,9) met een mediane responsduur van 8,1 maanden. Deze uitkomsten voldoen niet aan de PASKWIL-criteria voor NRS voor een positief advies.
De bijwerkingen zijn grotendeels specifiek aan het mechanisme van de FGFR-remming en zijn in het algemeen goed te hanteren. De ernstige en specifieke oogen nagel bijwerkingen door FGFR-remmers werden in deze studie bij ongeveer 5 procent van de patiënten gerapporteerd.
Momenteel loopt er een internationale, gerandomiseerde, fase III-studie waarin pemigatinib wordt vergeleken met gemcitabine en cisplatine als eerstelijnstherapie voor irresectabel of gemetastaseerd cholangiocarcinoom met een FGFR2-herschikking (FIGHT-302; NCT03656536).
5. Kosten
De kosten van behandeling met pemigatinib zijn nog niet bekend (bron: medicijnkosten.nl d.d. 24 oktober 2022).
Conclusie
Behandeling met pemigatinib van patiënten met een intrahepatisch cholangiocarcinoom met een FGFR2-fusie of herschikking, progressief na eerder systemische behandeling, resulteert in een ORR van 37,0 procent met een 95%-BI ondergrens van 27,9 procent. De mediane responsduur op behandeling is 8,1 maanden.
Deze resultaten voldoen niet aan de PASKWIL-criteria voor niet-gerandomiseerde studies voor een positief advies.
Referenties
- Nederlandse kankerregistratie (www.cijfersoverkanker.nl).
- Abou-Alfa GK, Sahai V, Hollebecque A, et al. Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study. Lancet Oncol. 2020 May;21(5):671-84.
- NVMO-commissie BOM. mFOLFOX6 als tweedelijnsbehandeling voor het lokaal gevorderd of gemetastaseerd cholangiocarcinoom of galblaascarcinoom. Med Oncol 2021;24(7):35-8.
- Abou-Alfa GK, Sahai V, Hollebecque A, et al. Pemigatinib for previously treated locally advanced/metastatic cholangiocarcinoma (CCA): Update of FIGHT-202. Journal of Clinical Oncology 2021 39:15_suppl, 4086.