
Huidige beschikbaarheid immuuncheckpointremmers
De komst van immuuncheckpointremmers (ICI’s) heeft een nieuw tijdperk in het behandellandschap van gevorderd endometriumcarcinoom (EC) gemarkeerd.1 Dit is vooral het geval in de ongeveer 30 procent van alle EC’s waar microsatellietinstabiliteit (MSI-H)/ mismatch repairdeficiëntie (dMMR) aanwezig is.2
In Nederland is momenteel dostarlimab beschikbaar als eerstelijns behandeling voor patiënten met een primair gevorderd of gerecidiveerd EC, in combinatie met carboplatine en paclitaxel voor patiënten met een dMMR=endometriumcarcinoom. Ook pembrolizumab in combinatie met chemotherapie en durvalumab in combinatie met chemotherapie met of zonder olaparib zijn door EMA goedgekeurd en zijn nu door commissie BOM positief beoordeeld. Tevens is in de tweede lijn pembrolizumab plus lenvatinib beschikbaar voor patiënten met een gevorderd of gerecidiveerd endometriumcarcinoom na eerdere platinumbevattende chemotherapie.3 Voor patiënten met een gevorderde maligniteit zonder standaard behandelopties is nivolumab beschikbaar indien er sprake is van een dMMR/MSI-Htumor.4,5
Uitkomsten van studies in eerste lijn
Vier belangrijke studies met verschillende ICI’s – RUBY ENGOT-EN6 (dostarlimab)6,7 KEYNOTE-868/NRG-GY018 (pembrolizumab)8,9 AtTEnd (atezolizumab)10 en DUO-E (durvalumab)11 – hebben aangetoond dat het toevoegen van een ICI aan chemotherapie de oncologische uitkomsten verbetert (zie tabel). Een meta-analyse van de initiële publicaties van deze onderzoeken toonde een significante verbetering in de progressievrije overleving (PFS) voor alle patiënten (HR: 0,70; 95%-BI: 0,62-0,79).12 Er is momenteel EMA-goedkeuring voor dostarlimab, pembrolizumab en durvalumab (bij pMMR alleen in combinatie met olaparib) in deze setting.
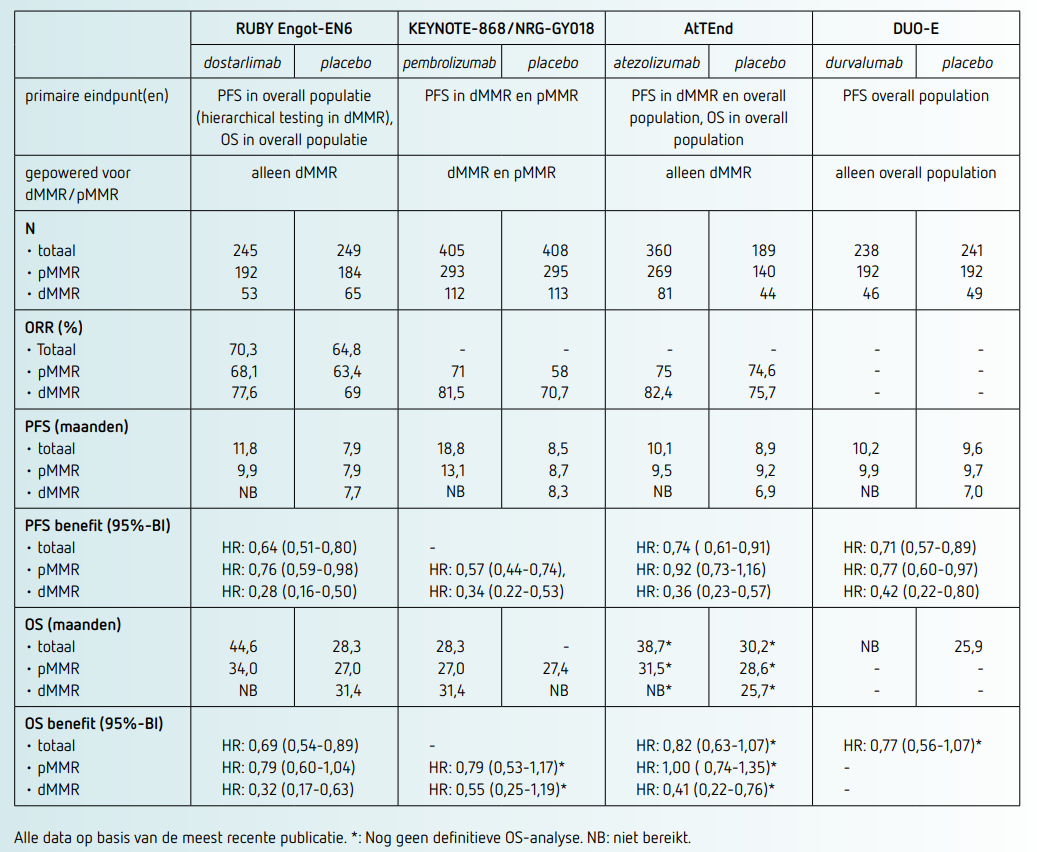
Belang van MMR-status
De meta-analyse van de vier eerstelijns studies waarin toevoegen van een immuuncheckpointremmer aan chemotherapie werd onderzocht, laten zien dat de verbetering vooral uitgesproken was in MMRd/MSI-H-tumoren (HR: 0,33; 95%-BI: 0,23-0,43) en veel minder robuust in de MMRp/MSS-cohort (HR: 0,74; 95%-BI: 0,60-0,91).12 Ook in de meest recente update van de RUBY-studie is het duidelijk uit een vooraf geplande subgroepanalyse dat het voordeel het grootst is bij patiënten met MMRd/MSI-H-tumoren, met een vermindering van 68 procent in het sterfterisico (HR: 0,32; 95%-BI: 0,17-0,63). In deze groep is het ook de vraag of chemotherapie nodig is, studies met alleen immuuntherapie zonder chemotherapie lopen nog (KEYNOTE-C93 en DOMENICA). In de MMRp/MSS-populatie is het voordeel duidelijk kleiner, met een vermindering van 21 procent in het sterfterisico (HR: 0,79; 95%-BI: 0,60 1,04).12
De meeste patiënten met een MMRp-tumor hebben geen tot weinig baat van toevoegen van immuuntherapie aan de behandeling. Wel lijkt er mogelijk verschil te zijn binnen de MMR-ppopulatie.13 In de RUBY (deel 1) studie werd ook de invloed van de vier moleculaire subklassen POLE gemuteerd, TP53 mutant, MMRd/MSI-H en niet-gespecificeerd mutatieprofiel (NSMP) op de antitumoractiviteit van chemotherapie en dostarlimab onderzocht. Naast de bekende winst in de MMRd/MSI-H groep werd ook voordeel aangetoond bij patiënten met TP53-mutatie (24-maanden progressievrije overleving: 32,4 procent versus 17,8 procent; HR: 0,55, 95%-BI: 0,30-0,99). Dit werd echter niet bevestigd in de subgroepanalyses van de DUOE-studie. In een recente meta-analyse over de meerwaarde van ICI per moleculaire subgroep, vooral gebaseerd op de data uit de RUBY en DUOE-studies, werd uit de gecombineerde data alleen een klein potentieel voordeel voor toevoegen ICI in de NSMP-subgroep beschreven, waarbij opgemerkt moet worden dat de data gedeeltelijk alleen nog als abstract is gepubliceerd en de moleculaire data van de NRG-GY018-studie nog zullen volgen.13 POLEmut-endometriumkanker, hoewel zeldzaam bij recidiverende of gemetastaseerde gevallen, werd geassocieerd met een gunstige prognose, ongeacht de het wel of niet toevoegen van ICI aan chemotherapie. De resultaten van post hoc moleculair onderzoek zijn vooralsnog hypothesegenererend en kunnen aanleiding zijn voor toekomstig prospectief onderzoek naar de rol van ICI bij bepaalde moleculaire subtypen pMMR EC.
Rol van PARP-remmers
Toevoeging van een poly (ADP-ribose) polymerase (PARP) remmer (PARPi) bovenop ICI plus chemotherapie is potentieel van toegevoegde waarde in de MMRp/MSS-subgroep. DUO-E11 onderzocht olaparib toegevoegd aan durvalumabonderhoud na chemotherapie met durvalumab en RUBY Deel 214 onderzocht niraparib tijdens dostarlimabonderhoud na chemotherapie plus dostarlimab. In de DUO-Estudie wordt bij patiënten met een gevorderd of gerecidiveerd endometriumcarcinoom een statistisch significant langere PFS gezien na behandeling met durvalumab en olaparib met chemotherapie dan na chemotherapie alleen (HR: 0,55 [95%-BI: 0,43-0,69; p < 0,0001). EMA heeft toevoegen van durvalumab aan chemotherapie goedgekeurd voor patiënten met een dMMR-tumor en toevoegen van durvalumab plus olaparib aan chemotherapie voor patiënten met een pMMR-tumor. Beide behandelingen voldoen voor deze subgroepen aan de PASKWIL2023-criteria. In de RUBY deel 2-studie werden patiënten gerandomiseerd tussen chemotherapie met dostarlimab gevolgd door onderhoudsbehandeling dostarlimab en niraparib of chemotherapie met placebo en placebo-onderhoud. Het is onduidelijk welke aandeel in de gerapporteerde PFS-winst (maar geen OS-winst) de individuele middelen spelen en tevens wat de rol van HRD-status is alsmede de invloed op OS van latere therapielijnen. Bij het gebrek van een goed opgezette studie (met een arm met chemotherapie en PARP-remmer) om de winst van PARP-remmer bovenop checkpoint-remming en chemotherapie aan te tonen, blijft het onduidelijk wat de rol van PARP-remmers is bij patiënten met gemetastaseerd endometriumcarcinoom en welke bijdrage olaparib heeft in de PFS-winst bij de pMMR-patiënten in de DUO-E-studie.
Zeldzame histologische subtypes endometriumcarcinoom
De meest voorkomende histologische subtypes endometriumcarcinoom zijn endometrioid, sereus, clear cell en carcinosarcoom, en tumoren kunnen hoog- of laaggradig zijn. Hoewel de moleculaire subtypes belangrijker zijn geworden dan de histologische, blijft er discussie over toepassing van ICI bij zeldzame subtypes zoals clear cell of carcinosarcoom. In de hierboven besproken eerstelijns studies had de grote meerderheid van de geïncludeerde patiënten het endometroïde subtype. Patiënten met clear cell en carcinosarcoomsubtypes werden in de RUBY, AtTEnd en DUO-E-studies wel geïncludeerd en data suggereren wel voordeel voor ICI; deze subgroepen zijn echter uiteraard te klein voor formele evaluatie.
Tekst: dr. Hilde Jalving (UMCG), dr. Tonneke Beijers (MUMC+), dr. Judith Kroep (LUMC), dr. Martin Rijlaarsdam (AVL), dr. Nelleke Ottevanger (Radboudumc) en dr. Ingrid Boere (Erasmus MC) namens de internist-oncologen van de Dutch Gynaecological Oncology Group (DGOG)
Conclusies
- Voor patiënten met gevorderd dMMR-endometriumcarcinoom is er duidelijke rationale en data om toevoegen van een immuuncheckpointremmer aan chemotherapie in de 1e lijn te ondersteunen. Er is in deze groep geen reden voor toevoegen PARP-remmers. Er kan geen voorkeur worden aangegeven tussen dostarlimab, pembrolizumab en durvalumab. Wel is verschil in de geplande duur van ICI behandeling tussen de studies (dostarlimab 3 jaar, pembrolizumab 2 jaar en durvalumab tot progressie) en dit kan worden meegewogen in de keuze.
- Voor patiënten met gevorderd dMMR-endometriumcarcinoom die in de eerste lijn geen immuuncheckpointremmer hebben gehad is behandeling in de tweede lijn met een immuuncheckpointremmer aangewezen.
- Hoewel ook bij patiënten met een pMMR-endometriumcarcinoom toevoegen van een immuuncheckpointremmer enig voordeel lijkt te bieden, is de bijdrage bij deze groep duidelijk beperkter dan in de dMMR-groep en wordt geadviseerd hier terughoudend mee om te gaan in afwachting van herziening van de richtlijn endometriumcarcinoom.
- Patiënten met een POLE-gemuteerd gemetastaseerde endometriumcarcinoom hebben een goede prognose na chemotherapie met of zonder ICI.
- Patiënten met zeldzamere histologische subtypes van endometriumcarcinoom, zoals clear cell en carcinosarcoom, werden in de meerderheid van de studies geïncludeerd en kunnen wel in aanmerking komen voor behandeling met ICI. Bepalen van het moleculaire profiel kan ook in deze groepen richting geven aan de therapiekeuze.
Referenties
- Colombo N, Caruso G, Jalving M. Immune checkpoint inhibitors in endometrial cancer: A Cinderella story. Ann Oncol 2024:35:686-8.
- The Cancer Genome Atlas Research Network, Levine DA. Integrated genomic characterization of endometrial carcinoma. Nature. 2013;497:67-73.
- Makker V, Colombo N, Casado Herráez A, et al. Lenvatinib plus pembrolizumab for advanced endometrial cancer. N Engl J Med. 2022;386:437-48.
- Zeverijn LJ, Geurts BS, Battaglia TW et al. The innate immune landscape of dMMR/MSI cancers predicts the outcome of nivolumab treatment: Results from the Drug Rediscovery Protocol. Clin Cancer Res 2024;30(19):4339-51.
- Standpunt nivolumab (Opdivo®) voor de behandeling van bepaalde patiënten met dMMR- of MSI-tumoren | Advies | Zorginstituut Nederland (geraadpleegd 27-03 2025)
- Mirza MR, Chase DM, Slomovitz BM, et al. Dostarlimab for primary advanced or recurrent endometrial cancer. N Engl J Med. 2023;388:2145-58.
- Powell MA, Bjørge L, Willmott L, et al. Overall survival in patients with endometrial cancer treated with dostarlimab plus carboplatinpaclitaxel in the randomized ENGOTEN6/ GOG-3031/RUBY trial. Ann Oncol. 2024;35:728-38.
- Eskander RN, Sill MW, Beffa L, et al. Pembrolizumab plus chemotherapy in advanced endometrial cancer. N Engl J Med. 2023;388: 2159-70.
- Eskander RN, Sill MW, Beffa L et al. Pembrolizumab plus chemotherapy in advance or recurrent endometroial cancer: overall survival and exploratory analyses of the NRGGYO018 phase 3 randomised trial. Nat Med. 2025 Mar 5. doi: 10.1038/s41591-025-03566-1. Epub ahead of print. PMID: 40044930.
- Colombo N, Paolo N, Harano K, et al. Atezolizumab and chemotherapy for advanced or recurrent endometrial cancer (AtTEnd): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2024;25(9): 1135-46.
- Westin SN, Moore K, Chon HS, et al. Durvalumab plus carboplatin/paclitaxel followed by maintenance durvalumab with or without olaparib as first-line treatment for advanced endometrial cancer: the phase III DUO-E trial. J Clin Oncol. 2024;42:283-99.
- Bogani G, Monk BJ, Powell MA, et al. Adding immunotherapy to first line treatment of advanced and metastatic endometrial cancer. Ann Oncol. 2024;35:414-28.
- Kaya M, Schaddelee MCA, Creutzberg CL et al. Efficacy of PD(L)1 inhibition in the treatment of endometrial cancer across molecular classes: a systematic review and metaanalysis. Int J Gynecol Cancer. 2025 Mar 1:101759. doi: 10.1016/ j. ijgc.2025.101759. Epub ahead of print. PMID: 40199646.
- Mirza MR, Coleman RL, Hanker L et al. ENGOTEN6/GOG3031/NSGOCTURUBY part 2: A phase III, randomized, doubleblind, study of dostarlimab + carboplatinpaclitaxel followed by dostarlimab + niraparib versus placebo (PBO) + carboplatinpaclitaxel followed by PBO in recurrent of advanced endometrial cancer (EC). Ann Oncol 2021:32; S770-1.