
In 2018 werden de data van de FLAURA-studie gepresenteerd. Sindsdien is osimertinib over het algemeen de eerstelijnsbehandeling voor voorkeur geworden voor patiënten met een EGFR-gemuteerd niet-kleincellig longcarcinoom (NSCLC). Het betreft hier de ‘klassieke’ EGFR-exon 19-deletie en L858R-puntmutatie die bij 85 procent van de patiënten met een EGFRmutatie voorkomen. Osimertinib was de eerste EGFR-TKI die een verbetering van de overleving gaf ten opzichte van de eerste generatie EGFR-TKI’s. De mediane overleving van osimertinib bedroeg 38,6 maanden vergeleken met 31,8 maanden in de controlearm.1 Daarnaast gaat osimertinib gepaard met minder toxiciteit en betere intracerebrale werking dan de eerdere generatie EGFR-TKI’s.
Uiteindelijk treedt echter resistentie op waarbij na eerste- en tweedegeneratie-EGFR-TKI’s in ongeveer de helft van de gevallen de secundaire resistentiemutatie T790M verantwoordelijk is voor de ziekteprogressie. Bij osimertinib treedt deze resistentiemutatie niet op en zijn er globaal drie vormen van resistentie mogelijk: histologische transformatie, on target resistentiemechanismen binnen EGFR zoals C797S-mutaties of bypass track-resistentiemutaties waarvan cMET-amplificatie een veelvoorkomende vorm is. Deze resistentiemechanismen zijn lastiger te behandelen waardoor er momenteel veel energie gestoken wordt in het verhogen van de effectiviteit van de eerstelijnsbehandeling. Twee combinatiestrategieën zijn onderzocht die wij willen bespreken in dit artikel. Eén daarvan is het toevoegen van chemotherapie aan osimertinib (FLAURA2); de andere is het combineren van amivantamab met een vergelijkbare derdegeneratie EGFR-TKI lazertinib (MARIPOSA).
FLAURA2
De FLAURA2-studie onderzocht de waarde van het toevoegen van chemotherapie aan osimertinib met progressievrije overleving (PFS) als primair eindpunt.2 De chemotherapie bestond uit vier kuren platinumpemetrexed waarna pemetrexed maintenance werd gegeven (in combinatie met osimertinib). De mediane PFS was significant beter ten opzichte van monotherapie osimertinib (25,5 maanden versus 16,7 maanden, HR: 0,62). De response rate nam ook iets toe met de toevoeging van chemotherapie. Dit gaat wel ten koste van duidelijk meer toxiciteit met 64 procent graad ≥ 3 toxiciteit versus 27 procent in de osimertinib monotherapiearm. De toxiciteit was vooral gerelateerd aan de chemotherapie zoals myelosuppressie en gastro-intestinale bijwerkingen en werd vooral in de eerste drie maanden gezien. 11 procent stopte met de behandeling vanwege toxiciteit in de combinatiearm.
Het toevoegen van chemotherapie aan osimertinib als eerstelijnsbehandeling van gemetastaseerd EGFR-gemuteerd nietkleincellig longcarcinoom voldoet aan de PASKWIL-criteria van de NVMO-commissie BOM3 en komt daarmee waarschijnlijk in aanmerking voor vergoede zorg. De verbetering van de progressievrije overleving na toevoeging van chemotherapie aan osimertinib gaat gepaard met verhoogde toxiciteit, meer belasting voor de patiënt en het ziekenhuis gezien de driewekelijkse intraveneuze toedieningen en hogere kosten. Dit onderstreept het belang van zorgvuldige patiëntenselectie. Het is allereerst belangrijk om met de patiënt de voor- en nadelen af te wegen ten aanzien van kwaliteit van leven en de wens voor driewekelijkse infuusbehandelingen. In de FLAURA2-studie werden gemiddeld 12 cycli pemetrexed toegediend met een range van 1 tot 48 cycli. De meerwaarde van maintenance pemetrexed is vooralsnog onbekend, maar geeft wel vaak langdurige (laaggradige) toxiciteit naast de logistieke belasting voor de patiënt en gezondheidszorg.
Daarnaast is het belangrijk om te beseffen dat EGFR-gemuteerd NSCLC een heterogene ziekte betreft, waarbij patiënten gebaat zijn bij een gepersonaliseerde aanpak. Een deel van de patiënten heeft een relatief indolent verloop van de ziekte en bereikt langdurige overleving met osimertinib als monotherapie. Het is echter ook bekend dat patiënten met bijvoorbeeld een EGFR L858R-mutatie juist minder baat hebben van osimertinib monotherapie vergeleken met EGFR-exon 19-deleties.1 In de FLAURA2-studie bleek de effectiviteit van de combinatie vergelijkbaar in deze beide groepen waarbij er dus iets meer voordeel is voor patiënten met een L858R-mutatie met een mediane PFS van 24,7 maanden versus 13,9 maanden met osimertinib monotherapie. Bij patiënten met een exon 19-deletie bedraagt de mediane PFS 27,9 maanden versus 19,4 maanden in de osimertinibgroep. Patiënten met slechte prognostische markers zoals hersenmetastasen en hoge tumorload lijken uit de subgroepanalyse meer baat te hebben van de toevoeging van chemotherapie. Hoge tumorload werd in de subgroepanalyse gedefinieerd als drie of meer metastatische anatomische lokalisaties op baseline.4 De fitte patiënten met een WHO-performancestatus van 0 en zonder hersenmetastasen lijken een minder groot voordeel te hebben van de combinatiebehandeling.
Resistentiemechanismen na behandeling met osimertinib met of zonder chemotherapie waren vergelijkbaar met als meest voorkomende resistentiemechanisme 11-12 procent MET-amplificatie gevolgd door C797x-mutaties.
Het voordeel van osimertinib + chemotherapie versus osimertinib monotherapie lijkt ook onafhankelijk van de TP53-status hoewel dit kleine groepen betreft.5
MARIPOSA
In de MARIPOSA-studie werden patiënten 2:2:1 gerandomiseerd tussen lazertinib met amivantamab, osimertinib monotherapie en lazertinib monotherapie.6 Het primaire eindpunt was PFS van amivantamab-lazertinib ten opzichte van osimertinib. Patiënten met symptomatische hersenmetastasen moesten daarvoor behandeld zijn voordat ze mochten deelnemen aan de studie. Daardoor is niet onderzocht wat het effect van deze behandeling zou kunnen zijn op dergelijke hersenmetastasen. De mediane PFS van amivantamab-lazertinib was significant verbeterd ten opzichte van monotherapie osimertinib (23,7 maanden versus 16,6 maanden, HR: 0,70). De response rate was vergelijkbaar (86 procent tegenover 85 procent). Aangezien er in de staart van de curve een verschil is van 12 procent op 39 maanden, waarbij 26 procent van de patiënten in de lazertinib-amivantamabgroep nog in leven is, voldoet deze studie aan de PASKWIL-criteria voor positief advies en komt daarmee waarschijnlijk in aanmerking voor vergoede zorg.7
Het toevoegen van amivantamab aan de behandeling met lazertinib geeft wel een duidelijke toename van toxiciteit. Dit uit zich met name in infusiereacties, die veelal voorkomen kunnen worden door een beter dexamethasonschema (en waarschijnlijk op niet al te lange termijn door het gebruik van subcutane injectie). Daarnaast treedt meer huidtoxiciteit op ten opzichte van lazertinib of osimertinib. Ten slotte zorgt het toedienen van amivantamab voor frequente infusiebehandeling in het ziekenhuis (1e 4 weken wekelijks, vervolgens om de week).
EGFR-gemuteerd NSCLC is een heterogene ziekte, waarbij patiënten gebaat zijn bij een gepersonaliseerde aanpak
In de subgroepanalyse werd met name voordeel gezien voor de jongere patiënt (< 65 jaar), patiënten met een WHO-performancescore van 1 en de aanwezigheid van een EGFR-exon 19-deletie. Er is zowel bij een verleden met als zonder hersenmetastasen een voordeel gezien voor amivantamab-lazertinib ten opzichte van osimertinib, waarbij de aanwezigheid van hersenmetastasen prognostisch slechter bleek. In een post-hoc-analyse werd aangetoond dat met name patiënten met levermetastasen, een TP53-mutatie en aanwezigheid van ctDNA/hoge tumorload voordeel hadden van amivantamab-lazertinib.8
In afwachting van de overlevingsdata en meer kennis over resistentiemechanismen na de combinatiebehandelingen is het belangrijk de juiste balans te vinden voor deze patiëntencategorie ten aanzien van effectiviteit van de behandeling versus bijwerkingen en belasting voor de patiënt.
Voorstel plaatsbepaling
Hoewel er niet voldoende power is voor de supgroepanalyses, denken we dat het wel relevant is deze uitkomsten mee te nemen in de plaatsbepaling, zodat hiermee rekening gehouden kan worden. Aangezien er onvoldoende power is voor deze subgroepanalyses, kan dit onzes inziens niet leiden tot een beperktere vergoeding dan het label van EMA-goedkeuring.
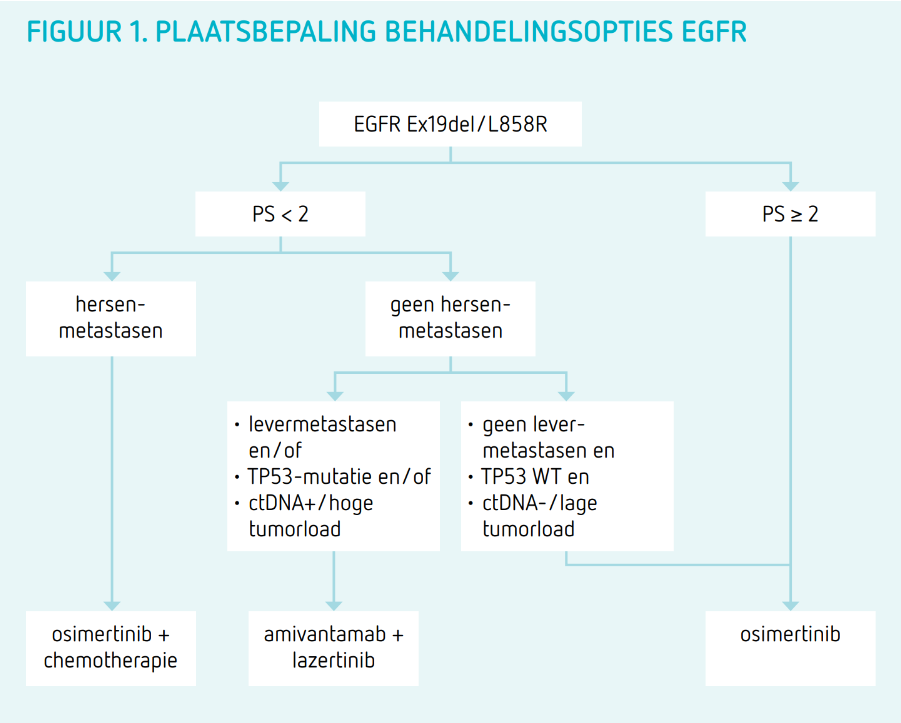
Ons voorstel zou zijn om de combinatie osimertinib en chemotherapie met name in te zetten bij patiënten met een PS < 2, hersenmetastasen en hoge tumorload (figuur 1). Na start van behandeling is het belangrijk aandacht te houden voor (langdurige) toxiciteit en het behoud van nierfunctie, met name in het kader van de pemetrexed maintenance behandeling. Hoe zinvol dit laatste is, is vooralsnog onduidelijk. Hopelijk krijgen we daar in de (nabije) toekomst meer zicht op.
Amivantamab-lazertinib lijkt met name goed ingezet te kunnen worden bij jongere (< 65 jaar) patiënten die geen hersenmetastasen hebben en met een PS < 2 (figuur 1). Hierin moeten patiëntvoorkeuren uiteraard meegewogen worden.
Patiënten zonder risicofactoren (geen hersenmetastasen, geen levermetastasen, TP53 WT en undetectable ctDNA (of lage tumorload) kunnen beter af zijn met osimertinib monotherapie (figuur 1).
Referenties
- Ramalingam SS, Vansteenkiste J, Planchard D, et al. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med. 2020;382(1):41- 50. doi: 10.1056/NEJMoa1913662. Epub 2019 Nov 21.
- Planchard D, Jänne PA, Cheng Y, et al. Osimertinib with or without chemotherapy in EGFR-mutated advanced NSCLC. N Engl J Med. 2023;389(21):1935-48. doi: 10.1056/NEJMoa2306434. Epub 2023 Nov 8.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Osimertinib met of zonder chemotherapie als eerstelijns behandeling in EGFR gemuteerd gevorderd NSCLC. Med Oncol 2025;28(7):37-41.
- Valdiviezo N, Gray JE, Jänne PA, et al. FLAURA2: Impact of tumor burden on outcomes of 1L osimertinib ± chemotherapy in patients with EGFR-mutated advanced NSCLC. [abstract and presentation]. Presented at World Conference on Lung Cancer (WCLC); September 7-10, 2024; San Diego, CA, USA.
- Yang JC, Robichaux J, Plachard D, et al. FLAURA2: Resistance, and impact of baseline TP53 alterations in patients treated with first-line osimertinib with or without platinum-pemetrexed. [abstract and presentation]. Presented at World Conference on Lung Cancer (WCLC); September 7-10, 2024; San Diego, CA.
- Cho BC, Lu S, Felip E, et al. Amivantamab plus lazertinib in previously untreated EGFR-mutated advanced NSCLC. N Engl J Med 2024;391(16):1486-98. doi: 10.1056/NEJMoa2403614.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Amivantamab en lazertinib als eerstelijns behandeling bij EGFR-gemuteerd niet-kleincellig longcarcinoom. Med Oncol 2025;28(7):30-5.
- Felip E, Cho BC, Gutiérrez V, et al. Amivantamab plus lazertinib versus osimertinib in first-line EGFR-mutant advanced non-small-cell lung cancer with biomarkers of high-risk disease: a secondary analysis from MARIPOSA. Ann Oncol. 2024;35(9):805-16.