
Inleiding
In het afgelopen decennium zijn de behandelopties van het irresectabel en gemetastaseerd melanoom fors uitgebreid. Kort na introductie van ipilimumab in 2011 kwamen de BRAF-remmers vemurafenib (2012) en dabrafenib (2014) ter beschikking.1,2 In 2015 en 2016 werden de PD-1-remmers nivolumab en pembrolizumab geïntroduceerd.3,4 Combinatiebehandelingen met verschillende BRAF en MEK-remmers en met ipilimumab en nivolumab zijn sinds 2016 mogelijk. Sinds 2017 is talimogeen laherparepvec (TVEC) ook geregistreerd voor de behandeling van het gevorderd of gemetastaseerd melanoom.5 In de hier te bespreken RELATIVITY-047-studie werd de toegevoegde waarde van relatlimab aan eerstelijnsbehandeling met nivolumab onderzocht bij patiënten met een irresectabel of gemetastaseerd melanoom.6
Lymfocyt-activerend gen 3 (LAG-3) is een molecuul op het celoppervlak van immuuncellen dat de T-celproliferatie en de effector-T-celfunctie beïnvloedt. LAG-3 is verhoogd aanwezig bij onder andere het melanoom. LAG-3 en PD-1 zijn verschillende aangrijpingspunten van het immuunsysteem, die vaak beide tegelijk op tumorinfiltrerende lymfocyten aanwezig zijn. In preklinisch onderzoek was er een synergistische werking indien LAG-3 en PD-1 beide geremd werden. Relatlimab is een humaan IgG4 LAG-3-remmend antilichaam dat bindt aan LAG-3 en hierdoor de effectorfunctie van uitgeputte T-cellen herstelt. In fase I- en II-studies toonde de combinatie van relatlimab en nivolimab effect, ook na eerdere progressie op PD-1-remming. De EMA heeft relatlimab in combinatie met nivolumab geregistreerd voor de behandeling van volwassenen en adolescenten vanaf 12 jaar met een irresectabel of gemetastaseerd melanoom met een PDL1-expressie kleiner dan 1 procent.
1. Kankersoort en lijn van behandeling
In de RELATIVITY-047-studie wordt behandeling met relatlimab toegevoegd aan nivolumab vergeleken met behandeling met alleen nivolumab bij patiënten met een irresectabel of gemetastaseerd melanoom die nog geen eerdere behandeling in deze setting hadden gehad.
2. Vergelijking met de referentiebehandeling in Nederland
De referentiebehandeling in de RELATIVITY-047-studie bestaat uit nivolumab. Afhankelijk van tumorkarakteristieken (BRAF-mutatie, beloop van de ziekte) en patiëntkarakteristieken (LDH-waarde, levensverwachting) kan gekozen worden uit BRAF-/MEK-remming, nivolumab, pembrolizumab en ipilimumab als mono- of combinatietherapie. Eerstelijnsbehandeling met nivolumab is in Nederland een standaardbehandeling voor het irresectabel of gemetastaseerd melanoom.
3. Methode en kwaliteit van de studie
De RELATIVITY-047-studie is een gerandomiseerde fase II-III-, dubbelblinde, multicenterstudie voor patiënten met een irresectabel of gemetastaseerd melanoom. Patiënten mochten in (neo)adjuvante setting behandeling met een PD-1, CTLA-4, BRAF- of MEK-remmer (of combinatie BRAF-/ MEK-remmer) gehad hebben indien deze behandeling ten minste 6 maanden voor het optreden van een recidief gestopt was. Behandeling met interferon moest ten minste 6 weken voor randomisatie voor het laatst gegeven zijn. Om voor inclusie in aanmerking te komen dienden patiënten 12 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1 te hebben. Er moest verder sprake zijn van meetbare ziekte volgend RECIST 1.1 en er moest tumormateriaal beschikbaar zijn om de LAG-3 en PDL1-expressie te bepalen. Patiënten met een uveaal melanoom werden geëxcludeerd. Patiënten met behandelde hersenmetastasen mochten deelnemen als op MRI na ten minste 4 weken geen sprake was van progressie. Patiënten mochten corticosteroïden gebruiken met een maximale dosering van 10 mg per dag prednison-equivalent gedurende ten minste de laatste 2 weken voor start van de studiebehandeling.
Patiënten werden 1:1 gerandomiseerd tussen behandeling met nivolumab 480 mg met relatlimab 160 mg of placebo. Nivolumab en relatlimab werden elke 4 weken gecombineerd toegediend door middel van een 60 minuten durend infuus. De randomisatie werd gestratificeerd naar LAG-3-expressie (≥ 1 procent versus < 1 procent), PDL1-expressie (≥ 1 procent versus < 1 procent), BRAF V600-mutatiestatus (aanwezig versus afwezig) en aanwezigheid van metastasen (M0 versus M1 met normaal lactaatdehydrogenase (LDH) versus M1 met verhoogd LDH).
De behandeling werd gecontinueerd tot aan progressie, onacceptabele bijwerkingen of gestaakt op verzoek van de patiënt. Behandeling na progressie, beoordeeld op basis van RECIST 1.1, was toegestaan als de patiënt klinisch voordeel had zonder onacceptabele bijwerkingen.
Tumorrespons werd na 12 weken, vervolgens elke 8 weken in het eerste jaar en daarna elke 12 weken tot aan progressie of stoppen van de behandeling vastgesteld. PDL1-expressie van tumorcellen werd bepaald met behulp van een immunohistochemische assay (PD-L1 IHC 28-8 pharmDx, Agilent). LAG-3-expressie werd eveneens bepaald met behulp van een immunohistochemische assay, die samen met LabCorp werd ontwikkeld. De LAG-3-expressie werd bepaald als percentage immuuncellen met een positieve kleuring dat morfologisch leek op lymfocyten binnen het tumorgebied gerelateerd aan alle kernhoudende cellen in een tumormonster met ten minste 100 vitale tumorcellen.
Het primaire eindpunt van de studie was progressievrije overleving (PFS), centraal en geblindeerd vastgesteld. Secundaire eindpunten waren overleving (OS) en objectieve responskans (ORR). Exploratieve eindpunten waren onder andere veiligheid en kwaliteit van leven, gemeten met de Functional Assessment of Cancer Therapy–Melanoma (FACTM) vragenlijst en de drie-levelversie van de EuroQol Group–5 Dimensions (EQ-5D-3L) vragenlijst. Bijwerkingen werden geëvalueerd door middel van CTC-AE v5.0.
De eerste 200 van de geplande 400 patiënten in de fase II-studie werden meegenomen in een interim-analyse, waarbij vastgesteld werd of de vooraf gestelde drempel van de hazard ratio (HR) voor PFS 0,8 of lager was. Bij het bereiken van deze drempel volgde het fase III-gedeelte. Volgens het ontwerp van de studie waren in totaal 700 patiënten en 365 events nodig om met 85 procent power en een tweezijdige alfa van 5 procent een HR van 0,73 voor progressie of overlijden vast te kunnen stellen. De geschatte PFS was 6,9 maanden in de controlegroep en 11,8 maanden in de relatlimabgroep. In verband met de interim-analyse werd voor de finale analyse een alfa van 4,9 procent gebruikt. Ten tijde van de finale analyse voor PFS werd ook een geplande interim-analyse voor OS verricht. De precieze uitkomsten van deze OS-analyse (die nog geen statistische significantie bereikte) blijven vooralsnog geblindeerd. ORR zal worden getest als alle patiënten ten minste 28 weken follow-up hebben gehad en alleen indien het verschil in OS statistisch significant is.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen mei 2018 en december 2020 werden 714 patiënten geïncludeerd door 111 centra in Noord-, Midden- en Zuid-Amerika, Europa, Australië en Nieuw-Zeeland: 355 patiënten in de relatlimabgroep en 359 patiënten in de controlegroep. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 63 jaar, 8 procent had eerdere behandeling in (neo)adjuvante setting gekregen, 8 procent had M0-ziekte, de performancestatus was 0 bij 67 procent, het LDH was verhoogd bij 36 procent (waarbij 9 procent een LDH-waarde hoger dan tweemaal de bovengrens van normaal had), 34 procent had M1-ziekte met een verhoogd LDH, 75 procent had een LAG-3-expressie ≥ 1 procent, 41 procent een PDL1-expressie ≥ 1 procent en 38 procent had een BRAF-mutatie.
De mediane follow-up bedroeg 13,2 maanden ten tijde van de data cutoff (9 maart 2021). Er waren op dat moment 470 (65,8 procent) patiënten gestopt met de behandeling, 237 in de relatlimabgroep en 233 in de controlegroep. Respectievelijk 129 (36,3 procent) en 165 (46,0 procent) patiënten waren gestopt met de behandeling vanwege progressie). Vervolgbehandeling was vergelijkbaar in beide groepen: ongeveer 12 procent kreeg BRAF-/MEK-remming, 10 procent een PD-1 of CTLA-4-remmer.
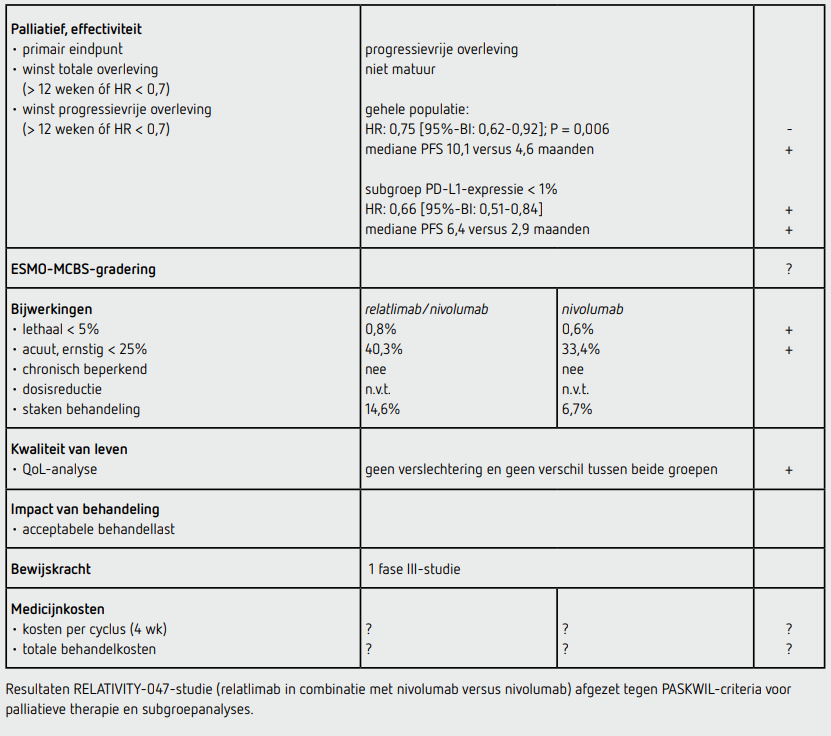
Het primaire eindpunt PFS was statistisch significant beter in de relatlimabgroep dan in de controlegroep (HR: 0,75 [95%-BI: 0,62-0,92]; P = 0,006). De mediane PFS was 10,1 maanden (95%-BI: 6,4-15,7) in de relatlimabgroep en 4,6 maanden (95%-BI: 3,4-5,6) in de controlegroep. De 1-jaars PFS was 47,7 procent in de relatlimabgroep en 36,0 procent in de controlegroep.
Bij patiënten met een PDL1-expressie < 1 procent was de HR voor PFS 0,66 (95%-BI: 0,51-0,84) voor de relatlimabgroep in vergelijking tot de controlegroep. De mediane PFS van deze subgroep was 6,4 maanden (95%-BI: 4,6-11,8) in de relatlimabgroep en 2,9 maanden (95%-BI: 2,8-4,5) in de controlegroep. Bij patiënten met een PDL1-expressie ≥ 1 procent was de HR 0,95 (95%-BI: 0,68-1,33) voor de relatlimabgroep in vergelijking tot de controlegroep. Het voordeel van behandeling met relatlimab was onafhankelijk van de BRAF-mutatiestatus en de LAG-3-expressie. De overlevingscijfers en de ORR zijn nog niet matuur.
De mediane behandelduur was 5,6 maanden in de relatlimabgroep en 4,9 maanden in de controlegroep. Van de 355 patiënten in de relatlimabgroep staakten 52 patiënten (14,6 procent) de behandeling voortijdig vanwege bijwerkingen. In de controlegroep (n=359) staakten 24 patiënten (6,7 procent) de behandeling vanwege bijwerkingen.
In totaal hadden 143 (40,3 procent) van de patiënten in de relatlimabgroep ten minste één bijwerking van graad 3 of hoger ten opzichte van 120 patiënten (33,4 procent) in de controlegroep. In de studie zijn drie patiënten (0,8 procent) in de relatlimabgroep overleden aan bijwerkingen van de behandeling (hemofagocytaire lymfohistiocytose, longembolie en pneumonitis) en twee patiënten in de controlegroep zijn overleden aan de gevolgen van de behandeling. De meest voorkomende bijwerking van graad 3 of 4 in de relatlimabgroep was hepatitis (3,9 procent). De meest voorkomende bijwerkingen (alle graderingen) waren in de relatlimabgroep jeuk (23,4 procent) vermoeidheid (23,1 procent), huiduitslag (15,5 procent) artralgie (14,4 procent), hypothyreoïdie (14,4 procent), diarree (13,5 procent) en vitiligo (10,4 procent). Immuungerelateerde bijwerkingen van elke graad traden vaker op in de relatlimabgroep dan in de controlegroep: hypothyreoïdie of thyreoïditis (18,0 versus 13,9 procent), diarree of colitis (6,8 versus 3,1 procent), hepatitis (5,6 versus 2,5 procent), bijnierinsufficiëntie (4,2 versus 0,8 procent) en pneumonitis (3,7 versus 1,7 procent). In de relatlimabgroep trad myocarditis bij 1,7 procent van de patiënten op (0,6 procent in de controlegroep), hetgeen bij allen compleet herstelde.
Kwaliteit-van-levenvragenlijsten werden door ten minste 86 procent van de patiënten ingevuld. Zowel de FACT-M als de EQ-5D-3L bleven stabiel in de tijd in beide groepen. Er werd geen verschil tussen beide groepen gevonden.
Discussie
Bij patiënten met een irresectabel of gemetastaseerd melanoom leidt eerstelijnsbehandeling met relatlimab toegevoegd aan nivolumab tot een significante verbetering van de PFS in vergelijking met nivolumab (HR: 0,75 [95%-BI: 0,62-0,92]; P = 0,006). De mediane PFS was 10,1 maanden (95%-BI: 6,3-15,7) in de relatlimabgroep en 4,6 maanden (95%-BI: 3,3-5,6) in de controlegroep.
De EMA heeft relatlimab in combinatie met nivolumab geregistreerd voor de subgroep van patiënten met een PDL1-expressie < 1 procent. Bij deze groep patiënten was de mediane PFS beter in de relatlimabgroep in vergelijking tot de controlegroep (HR 0,66 [95%-BI: 0,51-0,84]). De mediane PFS van deze subgroep was 6,4 maanden (95%-BI: 4,6-11,8) in de relatlimabgroep en 2,9 maanden (95%-BI: 2,8-4,5) in de controlegroep. Alle reeds geregistreerde behandelingen voor het irresectabel of gemetastaseerd melanoom kunnen gegeven worden ongeacht de PDL1-expressie. Om voor behandeling met relatlimab in aanmerking te komen moet dus bij alle patiënten voorafgaand aan de start van de behandeling de PDL1-expressie bepaald worden. De verbeterde PFS gaat gepaard met meer bijwerkingen, met name immuungerelateerd, en het frequenter staken van de behandeling vanwege bijwerkingen.
5. Kosten
De kosten van behandeling met relatlimab in combinatie met nivolumab (is een combinatiepreparaat) zijn nog niet bekend (bron: medicijnkosten.nl d.d. 30 januari 2023).
Conclusie
De EMA heeft relatlimab in combinatie met nivolumab geregistreerd voor de subgroep van patiënten met een PDL1-expressie < 1 procent. Bij deze groep patiënten was de mediane PFS beter voor de relatlimabgroep in vergelijking tot de controlegroep (HR 0,66 [95%-BI: 0,51-0,84]). De mediane PFS van deze subgroep was 6,4 maanden (95%-BI: 4,6-11,8) in de relatlimabgroep en 2,9 maanden (95%-BI: 2,8-4,5) in de controlegroep. Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL-criteria voor palliatieve behandeling en subgroepanalyses.
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Vemurafenib als eerstelijns behandeling van het gemetastaseerd melanoom met een BRAFV600E-mutatie. MedOncol 2012;15(2):23-7.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Dabrafenib als monotherapie voor de behandeling van het niet-resectabel of gemetastaseerd melanoom met een BRAFV600-mutatie. MedOncol 2014;17(2):45-7.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Nivolumab als monotherapie bij niet-resectabel of gemetastaseerd melanoom. MedOncol 2015;18(6):43-6.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab als monotherapie bij niet-resectabel of gemetastaseerd melanoom. MedOncol 2016;19(1):49-53.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Talimogeen laherparepvec (TVEC) bij lokaal irresectabel en gemetastaseerd melanoom. MedOncol 2017;20(2):43-6.
- Tawbi HA, Schadendorf D, Lipson EJ, Ascierto PA, Matamala L, Castillo-Gutiérrez E, Rutkowski P, Gogas HJ, Lao CD, De Menezes JJ, Dalle S, Arance A, Grob JJ, Srivastava S, Abaskharoun M, Hamilton M, Keidel S, Simonsen KL, Sobiesk AM, Li B, Hodi FS, Long GV; RELATIVITY-047 Investigators. Relatlimab and Nivolumab versus Nivolumab in Untreated Advanced Melanoma. N Engl J Med. 2022 Jan 6;386(1):24-34