Inleiding
Een gastro-intestinale stromale tumor (GIST) is een zeldzame vorm van wekedelensarcoom. Het komt ongeveer 350 keer per jaar in Nederland voor. De primaire GIST ontstaat ergens in het maag-darmtraject tussen oesofagus en rectum, voornamelijk in de maag. Wanneer een GIST metastaseert, dan is dat met name naar de lever en het peritoneum.
Het overgrote deel van de GIST’en heeft een mutatie in het KIT-gen, dat het belangrijkste aangrijpingspunt is voor de behandeling. De huidige behandeling bestaat uit opeenvolgend imatinib, sunitinib en regorafenib. In vierde lijn zijn er op dit moment geen standaardbehandelingen voorhanden. Ripretinib is een KIT- en PDGFRA-tyrosinekinaseremmer die kan binden bij afwezigheid en aanwezigheid van zowel primaire als secundaire resistentieveroorzakende mutaties die kunnen ontstaan bij GIST’en.
1. Kankersoort en lijn van behandeling
In de hier te bespreken INVICTUS-studie wordt behandeling met ripretinib vergeleken met placebo bij patiënten met een gemetastaseerd GIST na eerdere behandeling met imatinib, sunitinib en regorafenib.1 De EMA heeft ripretinib geregistreerd voor de behandeling van volwassen patiënten met gevorderde GIST die eerder zijn behandeld met 3 of meer kinaseremmers, waaronder imatinib.
2. Vergelijking met de referentiebehandeling in Nederland
In de INVICTUS-studie wordt palliatieve behandeling met ripretinib vergeleken met placebo. In Nederland worden patiënten met een gemetastaseerd GIST opeenvolgend met imatinib, sunitinib en regorafenib behandeld. In de vierde lijn zijn er op dit moment geen standaardbehandelingen voorhanden. Een vergelijking met placebo is dus overeenkomstig met de huidige situatie.
3. Methode en kwaliteit van de studie
INVICTUS is een gerandomiseerde fase III-multicenterstudie voor patiënten met een vergevorderde GIST. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 tot 2 te hebben. Patiënten dienden progressie of intolerantie op eerdere behandeling met ten minste imatinib, sunitinib en regorafenib te hebben gehad.
Patiënten werden 2:1 gerandomiseerd tussen behandeling met ripretinib (1 d.d. 150 mg per os) en placebo in cycli van 28 dagen. De behandeling werd gestratificeerd naar aantal lijnen voorgaande therapie (3 versus meer) en ECOG-performancestatus (0 versus 1 of 2).
Dosisaanpassingen naar 100 mg of indien nodig naar 50 mg en behandelonderbrekingen waren toegestaan. De behandeling werd gestaakt bij progressie. De behandeling kon ook vroegtijdig worden afgebroken op verzoek van de patiënt, bij klinische verslechtering van de conditie van de patiënt of om veiligheidsredenen. Bij progressie op placebo konden patiënten ripretinib-behandeling krijgen. Bij progressie op ripretinib 150 mg eenmaal per dag mocht de dosis worden opgehoogd naar 150 mg tweemaal per dag.
Het primaire eindpunt van de studie was progressievrije overleving (PFS) vastgesteld door geblindeerde, onafhankelijke centrale beoordeling. Secundaire eindpunten waren responskans (ORR), overleving (OS), tijd tot progressie, tijd tot beste respons, kwaliteit van leven (QOL) en veiligheid. Conform het statistisch ontwerp van de studie was er een volgorde in de hiërarchisch toetsing van de eindpunten: eerst PFS, vervolgens ORR, daarna OS en tot slot QOL. Alle overige uitkomsten werden beschrijvend weergeven. Een CT-scan voor evaluatie werd elke 4 weken gedurende de eerste 4 cycli en daarna elke 8 weken gemaakt en beoordeeld volgens mRECIST 1.1. Tijdens de studie werd bij elk follow-upbezoek ook kwaliteit van leven gemeten met de vragenlijsten QLQ-C30, EQ-5D-5L en EQ-VAS. Bijwerkingen van de behandeling werden geëvalueerd volgens CTCAE 4.03. Data over vervolgbehandelingen zijn verzameld in deze studie.
Volgens het ontwerp van de studie waren er 120 patiënten en 90 events nodig om met 90 procent power en een tweezijdige alfa van 5 procent een significant verschil in PFS vast te kunnen stellen. Dit komt overeen met de verwachte mediane PFS van 4,5 maanden voor ripretinib en 1 maand voor placebo. In een interim-analyse werd niet voorzien. Analyses werden gebaseerd op de behandeling in de dubbelblinde periode van de studie vooraf aan eerste progressie en eventuele cross-over. De analyses betreffende overleving en vervolgbehandelingen werden wel uitgevoerd over de geblindeerde en de gedeblindeerde periode. Er we rekening gehouden met uitval van 15 procent van de patiënten.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen februari en november 2018 werden 129 patiënten geïncludeerd door 29 centra in 12 landen: 85 patiënten in de ripretinibgroep en 44 patiënten in de placebogroep. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: 33 versus 50 procent was 65 jaar of ouder, iets meer mannen (55 versus 59 procent), voornamelijk primair GIST in de maag (41 versus 47 procent), WHO-performancestatus van 0 (39 versus 44 procent) en 3 eerder lijnen therapie (61 versus 64 procent).
De mediane follow-up in de dubbelblinde periode bedroeg 6,3 maanden voor de ripretinib-groep en 1,6 maanden voor de placebogroep. Er waren 51 patiënten (60 procent) met progressie van ziekte in de ripretinib-groep en 37 patiënten (84 procent) met progressie van ziekte in de placebogroep.
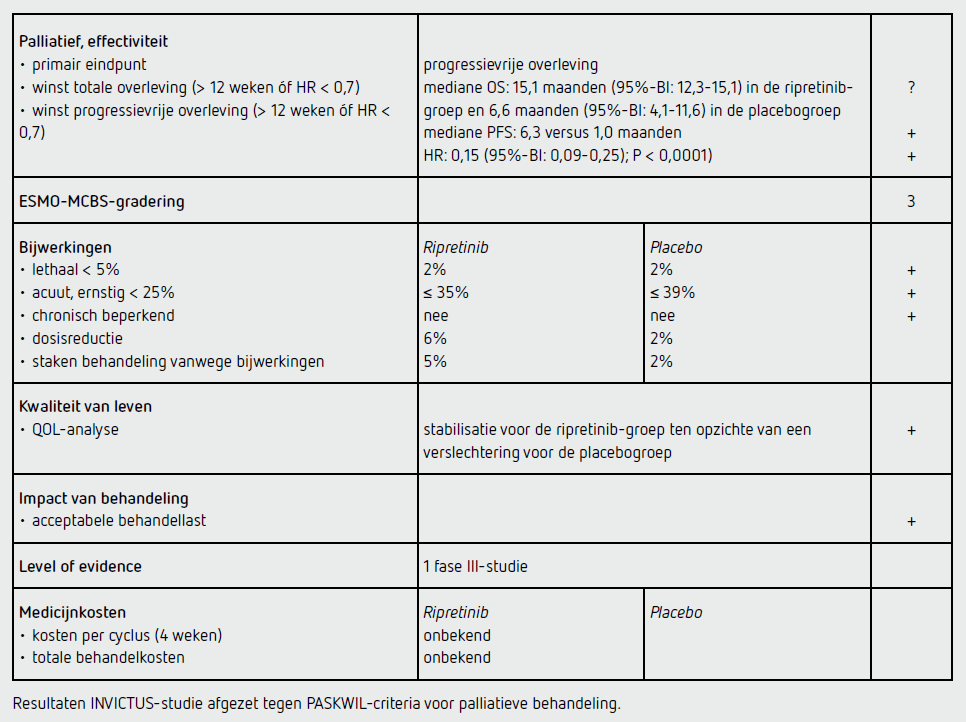
Het primaire eindpunt PFS in de intention to treat-populatie was statistisch significant beter in de ripretinib-groep dan in de placebogroep (HR: 0,15 [95%-BI: 0,09-0,25]; P < 0,0001). De mediane PFS bedroeg 6,3 maanden (95%-BI: 4,6-6,9) in de ripretinib-groep en 1,0 maanden (95%-BI: 0,9-1,7) in de placebogroep. De PFS op 6 maanden was 51 procent in de ripretinib-groep en 3,2 procent in de placebogroep.
Naast de primaire analyse voor PFS werd ook een analyse voor de secundaire eindpunten ORR en OS verricht. De analyse toonde dat de ORR niet significant verschillend was tussen beide groepen. De responskans was 9,4 procent (95%-BI: 4,2-17,7) in de ripretinib-groep en 0 procent in de placebogroep. De OS was langer was in de ripretinib-groep dan in de placebogroep (HR: 0,36 [95%-BI: 0,21-0,62]). De mediane OS bedroeg 15,1 maanden (95%-BI: 12,3-15,1) in de ripretinib-groep en 6,6 maanden (95%-BI: 4,1-11,6) in de placebogroep. Vanwege de statistische opbouw van de studie kon geen formele P-waarde getest worden voor OS aangezien het eindpunt ORR geen statistisch significant verschil liet zien. In totaal 15 van de 44 patiënten in de placebogroep (34 procent) hebben, voornamelijk vanwege verslechtering van de conditie of overlijden, na progressie niet met ripretinib kunnen starten. De mediane OS bedroeg 11,6 maanden (95%-BI: 6,3-niet evalueerbaar)) bij de 29 patiënten met cross-over naar ripretinib en 1,8 maanden (95%-BI: 0,9-4,9) bij de 15 patiënten die geen cross-over naar ripretinib hadden.
Er waren vrijwel geen patiënten die een dosisreductie (5 patiënten, 6 procent in de ripretinib-groep) of het voortijdig staken van de behandeling vanwege bijwerkingen (4 patiënten, 5 procent) nodig hadden. De mediane relatieve dosisintensiteit tijdens de dubbelblinde behandelperiode was 100 procent (IQR: 98,1-100) in de ripretinibgroep en 97 procent (86,5-100) in de placebogroep.
Bijwerkingen van graad 3 tot 5 kwamen in de ripretinib-groep 30 keer en in de placebogroep 11 keer voor. In de publicatie wordt niet beschreven hoeveel individuele patiënten dit betreft. Als er wordt uitgegaan van het slechtste scenario waarbij elke bijwerking van graad 3 of 4 bij een andere patiënt voorkwam, dan zou het gaan om maximaal 35 procent (30 van 85) van de met ripretinib behandelde patiënten en maximaal 39 procent (11 van 43) van de met placebo behandelde patiënten.
Er werd gerapporteerd dat 2 patiënten overleden ten gevolge van bijwerkingen van de behandeling: 1 patiënt in de ripretinib-groep aan een onbekende oorzaak waarbij de patiënt in de slaap was overleden en 1 patiënt in de placebogroep aan een septische shock en longoedeem.
De meest voorkomende bijwerkingen van graad 3 of 4 in de ripretinibgroep waren lipasestijging (4 patiënten, 5 procent), hypertensie (3 patiënten, 4 procent), moeheid (1 patiënt, 2 procent) en hypofosfatemie (1 patiënt, 2 procent). Haaruitval (graad 1 en 2, geen graad 3 en hoger) trad bij 42 patiënten (49 procent) in de ripretinib-groep op.
Analyses van kwaliteit van leven tonen een stabiliteit voor de ripretinib-groep ten opzichte van een verslechtering voor de placebogroep. Vanwege het statistisch ontwerp in de studie waarbij er hiërarchisch werd getoetst, kon geen formele Pwaarde getest worden voor QOL. Gesteld wordt dat deze verschillen waarschijnlijk wel klinisch relevant zijn.
Discussie
De patiëntengroep geïncludeerd in de INVICTUS-studie is een goede afspiegeling van de dagelijkse praktijk wat betreft leeftijd, geslacht en voorbehandelingen. De behandeling met ripretinib is goed te verdragen. Het is opvallend dat bij deze tyrosinekinaseremmer bij bijna de helft van de patiënten enige vorm van haaruitval wordt gezien (graad 1 en 2). Dit kan voor een palliatieve behandeling in de verdere lijnen van therapie impact hebben en is voor patiënten van belang om te benoemen.
Belangrijk is dat beoordeling van de CT-scans werd uitgevoerd door onafhankelijke centrale reviewers. Dit maakt de studieuitkomsten meer betrouwbaar aangezien het beoordelen van respons en progressie bij GIST-patiënten notoir ingewikkeld is en erg afhankelijk is van de expertise van de radioloog. In de studie werden de CT-scans (erg) vaak gemaakt; initieel elke 4 weken. Dit resulteerde erin dat patiënten bij progressie snel van placebo naar ripretinib konden switchen. Ondanks de gemaakte CT-scans kon crossover bij een derde van de patiënten niet meer plaatsvinden; deze patiënten hadden een aanzienlijk slechtere overleving dan de patiënten die wel ripretinib hebben kregen.
5. Kosten
De kosten van behandeling met ripretinib zijn nog onbekend.
Conclusie
In de hier besproken INVICTUS-studie wordt bij patiënten met een gemetastaseerde GIST in de vierde lijn (of verder) na een follow-up van mediaan 6,3 maanden een statistisch significant langere PFS gezien na palliatieve behandeling met ripretinib dan na placebo (HR: 0,15 [95%-BI: 0,09-0,25]; P < 0,0001). De mediane PFS bedroeg 6,3 maanden (95%-BI: 4,6-6,9) in de ripretinib-groep en 1,0 maanden (95%-BI: 0,9-1,7) in de placebogroep. Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL-criteria voor palliatieve behandeling.
Referenties
- Blay JY, Serrano C, Heinrich MC, et al. Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2020;21(7):92334.