
1. Inleiding
De diagnose epitheliaal ovariumcarcinoom (EOC) wordt jaarlijks in Nederland bij 1100 vrouwen gesteld. Omdat het EOC doorgaans laat klachten geeft, heeft bijna 70 procent van de patiënten bij het stellen van de diagnose al gevorderde ziekte (stadium IIb of hoger). De primaire behandeling van EOC bestaat uit chirurgische resectie en combinatiechemotherapie, waarbij de volgorde afhankelijk is van een aantal patiëntgebonden factoren. De standaardchemotherapie is carboplatine en paclitaxel. Bij een meerderheid van de EOC-patiënten treedt er op enig moment een recidief op. Bij ongeveer 15 procent van de EOC-patiënten is er sprake van een kiembaanmutatie in BRCA. Daarnaast kan er in de tumor sprake zijn van een somatische BRCA-mutatie. Meestal, maar niet uitsluitend, betreft het patiënten met een hooggradig sereus ovariumcarcinoom. Bij ongeveer de helft van de patiënten met een hooggradig sereus ovariumcarcinoom is er een defect in de homologerecombinatieroute ten gevolge van een kiembaanmutatie of somatische mutatie in BRCA1 of BRCA2 of ten gevolge van epigenetische inactivatie van BRCA1 of BRCA2.
Rucaparib, een PARP1-, PARP2- en PARP3-remmer, kreeg in 2019 een positief advies van de commissie BOM voor onderhoudsbehandeling bij patiënten met een gerecidiveerd hooggradig sereus of endometrioïd EOC, tubacarcinoom of primair peritoneaal carcinoom, onafhankelijk van een BRCA-mutatie of homologe-recombinatiedeficiëntie (HRD), en een respons op de voorgaande chemotherapie, vanwege een significante verlenging van de progressievrije overleving (PFS).1 Later bleek er geen overlevingswinst te zijn van deze behandeling, noch in de patiënten met BRCA-mutatie of HRD, noch in de totale populatie.2
De commissie BOM heeft een voorlopig positief advies gegeven op basis van winst in ziektevrije overleving voor onderhoudsbehandeling met olaparib gedurende 2 jaar bij patiënten met primair stadium III of IV hooggradig ovariumcarcinoom, tubacarcinoom of peritoneaal carcinoom en een kiembaan- of somatische BRCA-mutatie, nadat een respons op de standaardbehandeling is opgetreden.3 Het voorlopige positieve advies op basis van ziektevrije overleving voor adjuvante behandeling met niraparib gedurende 3 jaar voor patiënten met een BRCA-mutatie en/of HRD wordt omgezet naar een negatief advies nadat recent gebleken is dat er geen overlevingswinst is met deze behandeling.4
In de hier te bespreken ATHENA-MONO-studie wordt rucaparib als adjuvante therapie na afronding van de primaire behandeling bij stadium III of IV hooggradig ovariumcarcinoom geëvalueerd.5 EMA heeft rucaparib geregistreerd als onderhoudstherapie bij patiënten met een gevorderd (FIGO-stadium III en IV), hooggradig ovariumcarcinoom, tubacarcinoom of peritoneaal carcinoom, met een (complete of partiële) respons op eerstelijnsbehandeling met platinumbevattende chemotherapie
2. Kankersoort en lijn van behandeling
Onderhoudsbehandeling met rucaparib werd onderzocht bij patiënten met een stadium III of IV hooggradig ovariumcarcinoom, peritoneaal carcinoom of tubacarcinoom, nadat een respons optrad na standaardbehandeling met platinumbevattende chemotherapie en resectie.
3. Vergelijking met de referentiebehandeling in Nederland
In Nederland is chirurgische resectie in combinatie met platinumbevattende chemotherapie de standaardbehandeling bij het primair gediagnosticeerd gevorderd ovariumcarcinoom, tubacarcinoom of primair peritoneaal carcinoom. Bij patiënten met een FIGO-stadium III ovariumcarcinoom, behandeld met neoadjuvante chemotherapie, wordt bij intervaldebulking HIPEC toegevoegd aan de behandeling.6 Voor patiënten met een primair gediagnosticeerd stadium III of IV BRCA-gemuteerd ovariumcarcinoom, tubacarcinoom of primair peritoneaal carcinoom, met respons na standaardbehandeling bestaande uit chirurgie en platinumbevattende chemotherapie, kan olaparib gedurende 2 jaar als onderhoudsbehandeling gegeven worden.3 Bij patiënten stadium III of IV met een HRD-tumor kan gedurende 3 jaar niraparib worden gegeven als onderhoudsbehandeling na chirurgie en platinumbevattende chemotherapie.7
4. Methode en kwaliteit van de studie
De ATHENA-studie is een dubbelblind placebogecontroleerde gerandomiseerde fase III-multicenterstudie voor patiënten met een primair gediagnosticeerd FIGO-stadium III of IV hooggradig ovariumcarcinoom, tubacarcinoom of primair peritoneaal carcinoom met respons op de standaardbehandeling. Deze studie bestaat uit 4 behandelarmen: rucaparib monotherapie, nivolumab monotherapie, rucaparib gecombineerd met nivolumab, en placebo. De ATHENA-studie is opgesplitst in de 2 separate vergelijkingen (MONO en COMBO) die onafhankelijk van elkaar gepowered zijn. De resultaten van de ATHENA-COMBO-studie waarbij rucaparib gecombineerd met nivolumab wordt vergeleken met rucaparib zijn gepresenteerd op het ESMO-congres van september 2024, waarbij geen verschil in PFS tussen beide behandelingen werd gezien.8 In de hier beschreven ATHENA-MONO-studie wordt onderhoudsbehandeling met rucaparib vergeleken met placebo.
Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1 te hebben. Zij hadden cytoreductieve chirurgie ondergaan voorafgaand aan adjuvante chemotherapie of na neoadjuvante chemotherapie. Zij moesten 4 tot 8 cycli platinumbevattende chemotherapie gehad hebben, waarvan minimaal 4 cycli in combinatie met een taxaan, waarna een respons was opgetreden volgens het oordeel van de onderzoeker. Het was toegestaan om bevacizumab aan de chemotherapie toe te voegen.
Respons was gedefinieerd als geen ziekteprogressie (radiologisch of door stijging van het CA 125-gehalte) op enig moment gedurende de eerstelijnsbehandeling, met daarnaast ofwel geen meetbare ziekte volgens RECIST1.1 na complete primaire of intervalchirurgie, ofwel een complete of partiële remissie in geval van meetbare ziekte na chirurgie en voor chemotherapie, ofwel een CA 125-respons (volgens de criteria van Gynecological Cancer Intergroup) indien er sprake was van niet-meetbare ziekte na chirurgie en voor chemotherapie. Voor inclusie moest de BRCA-mutatiestatus bekend zijn en er moest voldoende tumormateriaal aanwezig zijn voor verdere analyse op HRD. Er werd een centrale test verricht op HRD (FoundationOne CDx next-generation sequencing assay, Foundation Medicine Inc). HRD werd gedefinieerd als de aanwezigheid van een BRCA-mutatie of genomisch verlies van heterozygositeit (LOH) ≥ 16 procent.
Patiënten werden 4:1 gerandomiseerd tussen behandeling met oraal rucaparib 600 mg tweemaal daags of placebo gedurende 24 maanden. Daarnaast kregen alle patiënten elke 28 dagen intraveneus placebo als onderdeel van de ATHENA-studie. De onderhoudsbehandeling startte binnen 8 weken na de laatste chemotherapie. De behandeling werd vroegtijdig gestaakt in geval van ziekteprogressie, overlijden of onacceptabele toxiciteit.
Dosisaanpassing en behandelonderbreking waren toegestaan. De randomisatie werd gestratificeerd naar HR-status (BRCA-mutatie versus geen BRCA-mutatie en LOH ≥ 16 procent versus geen BRCA-mutatie en LOH < 16 procent, versus geen BRCA-mutatie en LOH onbepaald), residuale ziekte na chemotherapie (geen residuale ziekte versus residuale ziekte), en timing van de chirurgie (primaire chirurgie versus intervalchirurgie).
Het primaire eindpunt van de studie was progressievrije overleving (PFS) beoordeeld door de lokale onderzoeker in de HRD-populatie en in de totale populatie. Secundaire eindpunten waren overleving (OS), objectieve responskans (ORR), en onafhankelijk en geblindeerd centraal vastgestelde (BICR) PFS. Kwaliteit van leven, gemeten met de vragenlijst Functional Assessment of Cancer Therapy – Ovarian (FACT-O), was een exploratief eindpunt.
Een CT- of MRI-scan voor evaluatie werd in de eerste 3 jaar elke 12 weken, en vervolgens elke 24 weken gemaakt tot aan ziekteprogressie. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0. Data over vervolgbehandelingen zijn verzameld in deze studie.
Volgens het ontwerp van de studie waren 500 patiënten en 300 events nodig om met 90 procent power en een tweezijdige alfa van 2,5 procent (vanwege het delen van de alfa met de ATHENA-COMBO-studie) een hazard ratio (HR) van 0,45 voor progressie vast te kunnen stellen in de HRD-populatie en een HR van 0,60 voor progressie in de totale populatie. Dit komt overeen met een geschatte toename in mediane PFS in de placebogroep van 12,0 maanden naar 26,7 maanden in de rucaparibgroep in de HRD-populatie, en een toename in mediane PFS van 12,0 maanden naar 20,0 maanden in de totale populatie. Er werd aangenomen dat 40 procent van de patiënten HRD hadden.
Het primaire eindpunt PFS werd hiërarchisch getest, eerst in de HRD-populatie, en indien deze significant was in de totale populatie. Indien het primaire eindpunt PFS significant was in zowel de HRD- als de totale populatie dan zouden de secundaire eindpunten OS en ORR hiërarchisch getest worden. OS werd als matuur beschouwd als 70 procent van de patiënten overleden was. Onafhankelijk en geblindeerd centraal vastgesteld PFS werd als losstaand secundair eindpunt geanalyseerd. In een interim-analyse werd niet voorzien.
5. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen oktober 2018 en oktober 2020 werden 538 patiënten geïncludeerd door 200 centra in 24 landen in Noord-Amerika, Europa, Azië en Australië/Nieuw-Zeeland: 427 patiënten in de rucaparibgroep en 111 patiënten in de placebogroep. De mediane follow-up bedroeg 26,1 maanden in rucaparibgroep en 26,2 maanden in de placebogroep. De uitgangskarakteristieken in de beide behandelarmen waren vergelijkbaar: de mediane leeftijd was 61 jaar, een kwart had stadium IV-ziekte, ongeveer 90 procent had geen meetbare ziekte bij start van de behandeling en een normale waarde van het CA 125, ruim 75 procent had een ovariumcarcinoom, ongeveer de helft kreeg neoadjuvante chemotherapie en 18 procent was behandeld met bevacizumab.
Van de 538 patiënten hadden 234 patiënten (43 procent) een HRD-tumor, 185 in de rucaparibgroep (43 procent) en 49 in de placebogroep (44 procent). Bij 115 van deze patiënten (21 procent) werd een BRCA-mutatie vastgesteld, 91 in de rucaparibgroep en 24 in de placebogroep.
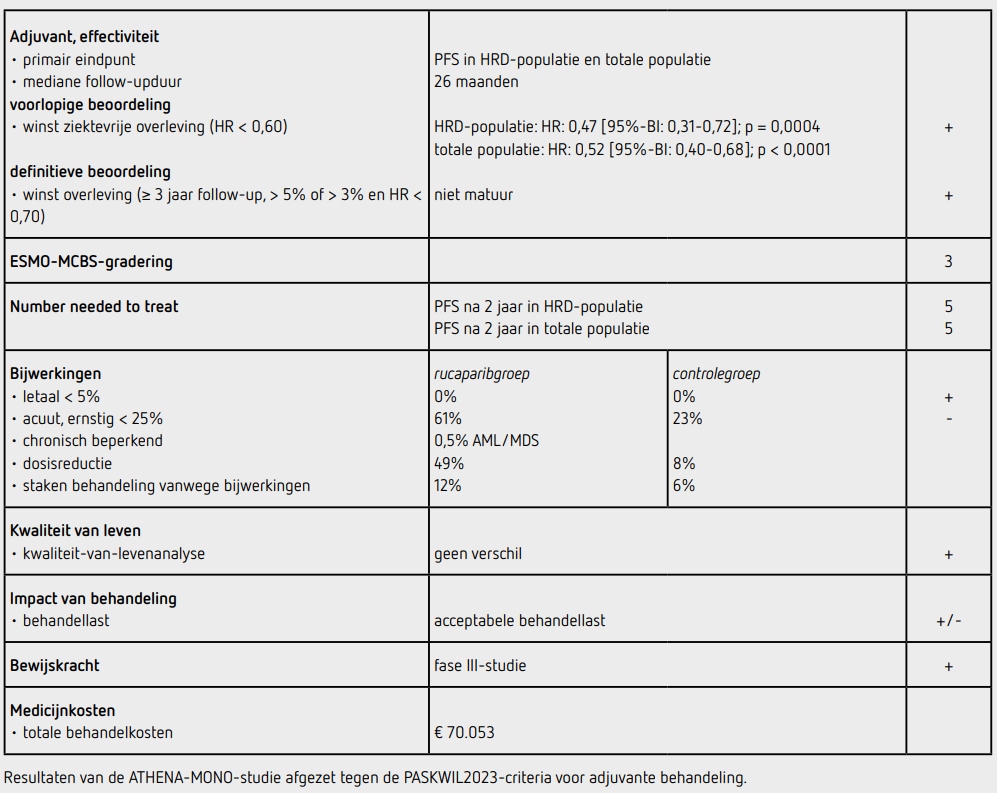
Het primaire eindpunt PFS in de HRD-populatie was statistisch significant langer in de rucaparibgroep dan in de placebogroep (HR: 0,47 [95%-BI: 0,31-0,72]; p = 0,0004). De mediane PFS in de HRD-populatie bedroeg 28,7 maanden (95%-BI: 23,0-niet bereikt) in de rucaparibgroep en 11,3 maanden (95%-BI: 9,1 22,1) in de placebogroep. Na 24 maanden was in de HRD-groep 56 procent van de patiënten in de rucaparibgroep en 35 procent van de patiënten in de placebogroep recidiefvrij en in leven. In de HRD-groep was zowel bij patiënten met een BRCA-mutatie (HR: 0,40 [95%-BI: 0,21-0,75]) als zonder BRCA-mutatie (HR: 0,58 [95%-BI: 0,33-1,01] de PFS beter in de rucaparibgroep dan in de placebogroep. De mediane PFS in de totale populatie bedroeg 20,2 maanden (95%-BI: 15,2-24,7) in de rucaparibgroep en 9,2 maanden (95%-BI: 8,3-12,2) in de placebogroep (HR: 0,52 [95%-BI: 0,40-0,68]; p < 0,0001). In de totale populatie was na 24 maanden 45 procent van de patiënten in de rucaparibgroep en 25 procent in de placebogroep recidiefvrij en in leven. Geblindeerde centrale beoordeling liet een vergelijkbare verbetering in mediane PFS zien in beide populaties. In de subgroep van patiënten zonder HRD was de mediane PFS 12,1 maanden in de rucaparibgroep en 9,1 maanden in de placebogroep (HR: 0,65 [95%-BI: 0,45-0,95]).
Ten tijde van de data-cutoff (23 maart 2022) was bij analyse van het secundaire eindpunt OS 24,7 procent van de patiënten overleden en daarmee was dit secundaire eindpunt niet matuur. Van de 425 patiënten (99,5 procent) in de rucaparibgroep die ten minste 1 dosis ontvingen, kregen 210 patiënten (49 procent) een dosisreductie, en werd de behandeling voortijdig gestaakt vanwege bijwerkingen door 50 patiënten (12 procent). Van de 110 patiënten (99,0 procent) in de placebogroep die ten minste 1 dosis ontvingen, kregen 9 patiënten (8 procent) een dosisreductie, en 6 patiënten (6 procent) staakten de behandeling met placebo voortijdig vanwege bijwerkingen. De mediane behandelduur was 14,7 maanden in de rucaparibgroep en 9,9 maanden in de placebogroep. De mediane dosisintensiteit was 88 procent bij rucaparib en 100 procent bij placebo.
In totaal hadden 257 patiënten (61 procent) behandeld in de rucaparibgroep ten minste 1 bijwerking van graad 3 of hoger ten opzichte van 25 patiënten (23 procent) in de placebogroep. De meest voorkomende bijwerkingen van graad 3 of 4 in de rucaparibgroep waren anemie (29 procent), neutropenie (15 procent), en verhoogd ASAT/ALAT (11 procent). In de rucaparibgroep was er 1 patiënt die MDS kreeg, en 1 patiënt kreeg AML. Er zijn geen patiënten overleden als gevolg van de behandeling. Analyses van kwaliteit van leven toonden geen verschil tussen beide groepen.
6. Discussie
Onderhoudsbehandeling gedurende 2 jaar met rucaparib bij patiënten met primair stadium III of IV hooggradig ovarium-, tuba- of primair peritoneaal carcinoom na respons op platinumbevattende chemotherapie resulteert in deze studie in een verlengde PFS, zowel in de HRD-populatie als in de totale populatie. In de HRD-populatie is er een toename van de mediane PFS van 11,3 naar 28,7 maanden (HR: 0,47 [95%-BI: 0,31-0,72]; p = 0,0004). In de totale populatie (waarin de HRD-populatie ook werd meegenomen) is er een toename van PFS van 9,2 naar 20,2 maanden (HR: 0,52 [95%-BI: 0,40-0,68]; p < 0,0001). Deze resultaten, zowel in de HRD-populatie als in de totale populatie, voldoen aan de PASKWIL2023-criteria voor adjuvante studies voor een voorlopig positief advies. De OS-data zijn nog niet matuur.
De PFS-winst bij patiënten met een BRCA-mutatie of HRD is wel groter dan de winst bij patiënten die HR-proficiënt zijn. De PFS-winst in de subgroep zonder HRD is 3 maanden. Het aantal bijwerkingen van rucaparib is hoog en voornamelijk van hematologische aard, inclusief 2 patiënten die een MDS of AML ontwikkelden tijdens deze nog beperkte follow-upduur. In deze studie wordt een HRD-positieve tumor gedefinieerd als de aanwezigheid van een BRCA-mutatie of genomische LOH boven een bepaalde grens. In de PRIMA/ENGOT-OV26/GOG-3012-studie met niraparib werd HRD gemeten door middel van een andere genomische instabiliteitstest. Er is nog geen consensus over het uniform vaststellen van HRD bij tumoren waar geen BRCA-mutatie is vastgesteld. Dit maakt dat verschillende studies onderling lastig te vergelijken zijn.
Voor de behandeling van patiënten met een BRCA-mutatie is voor onderhoudsbehandeling in de eerste lijn reeds olaparib gedurende 2 jaar beschikbaar. Onlangs bleek dat bij onderhoudsbehandeling met niraparib gedurende 3 jaar geen overlevingswinst wordt bereikt, waardoor deze indicatie vermoedelijk zal komen te vervallen, nadat aanvankelijk er een voorlopig positief advies was voor eerst de totale populatie, en later alleen voor toepassing bij patiënten met HRD.4 De PFS-winst in de totale populatie die in deze studie behandeld is met rucaparib gedurende 2 jaar voldoet aan de PASKWIL2023 criteria voor een voorlopig positief advies. Zodra de OS-data matuur zijn zal er een herbeoordeling plaatsvinden. Voor de uiteindelijke keuze voor onderhoudsbehandeling met een van de nu beschikbare PARP-remmers zullen tevens bijwerkingen en kosten meegewogen moeten worden.
7. Kosten
De behandeling met rucaparib 2 d.d. 600 mg kost 4.389 euro per behandelcyclus van 28 dagen (bron: medicijnkosten.nl d.d. december 2024). De totale medicatiekosten bij een mediane behandelduur van 14,7 maanden komen daarmee op 70.053 euro.
8. Conclusie
Rucaparib als onderhoudsbehandeling gedurende 2 jaar bij patiënten met een hooggradig, hoogstadium (FIGO III of IV) ovarium-, tuba- of peritoneaal carcinoom met een complete of partiële respons na eerstelijns platinumbevattende chemotherapie, voldoet aan de PASKWIL2023-criteria voor adjuvante studies voor een voorlopig positief advies in afwachting van de overlevingscijfers. Dit advies geldt voor de totale populatie, hoewel de meeste winst te verwachten is voor de subgroep met een BRCA-mutatie dan wel HRD.
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Rucaparib als onderhoudsbehandeling bij het gerecidiveerd platinumsensitief ovariumcarcinoom. Med Oncol 2019;22(7):31-5.
- Coleman RL, Oza AM, Lorusso D, et al. Overall survival results ARIEL3: a phase 3 randomised, double-blind study of rucaparib vs placebo following response to platinum-based chemotherapy for recurrent ovarian carcinoma. Int J Gynecol Cancer 2022;32(Suppl 2):A226.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Olaparib als onderhoudsbehandeling na primaire behandeling van het gevorderd epitheliaal ovariumcarcinoom. Med Oncol 2019;22(6):39-42.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Niraparib als onderhoudsbehandeling na primaire behandeling van het gevorderd epitheliaal ovariumcarcinoom. Med Oncol 2025;28(1):
- Monk BJ, Christine Parkinson C, Lim MC, et al. A randomized, phase III trial to evaluate rucaparib monotherapy as maintenance treatment in patients with newly diagnosed ovarian cancer (ATHENA-MONO/GOG-3020/ENGOT-ov45). J Clin Oncol 2022;40(34):3952-64.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). HIPEC bij de primaire behandeling van het epitheliaal ovariumcarcinoom. Med Oncol 2018;21(9):59-62.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Niraparib als onderhoudsbehandeling na primaire behandeling van het gevorderd epitheliaal ovariumcarcinoom. Med Oncol 2023;26(8):30-2.
- Monk BJ, Oaknin A, O’Malley DM, et al. ATHENACOMBO, a phase III, randomized trial comparing rucaparib (RUCA) + nivolumab (NIVO) combination therapy vs RUCA monotherapy as maintenance treatment in patients (pts) with newly diagnosed ovarian cancer (OC). Ann Oncol 2024;35(Suppl 2):S1223-4.