Inleiding
Ongeveer 10 tot 15 procent van de patiënten met een mammacarcinoom heeft een tripelnegatieve tumor. De mediane overleving van gemetastaseerd tripelnegatief mammacarcinoom (TNBC) bedraagt ongeveer 12 tot 15 maanden (bron: cijfersoverkanker.nl). Tot voor kort was chemotherapie de enige systemische behandeloptie voor deze groep patiënten. Inmiddels is gebleken dat ook immuuntherapie effectief is in de eerste lijn bij patiënten met een PD-L1-positief – dat wil zeggen: een combined positive score (CPS) van 10 of hoger – gemetastaseerd TNBC.1
Sacituzumab govitecan is een antilichaamgeneesmiddelconjugaat (ADC) dat bestaat uit een Trop-2-antilichaam, een linker en het cytotoxische SN-38. Het Trop-2-antilichaam is een gehumaniseerd IgG1-antilichaam gericht tegen het Trop-2-eiwit, dat tot expressie komt op het oppervlak van diverse solide tumoren, waaronder bij de grote meerderheid (tot 96 procent) van de TNBC’s.2 Het werkzame bestanddeel is SN-38; de potente metaboliet van irinotecan. De ratio SN38 per antilichaam bedraagt 7,6. Dat wil zeggen dat er 7,6 moleculen SN-38 aan één Trop-2-antilichaam zijn gekoppeld.
Het ADC wordt in zijn geheel geïnternaliseerd en gedegradeerd door de lysosomen, waarna SN-38 vrijkomt. SN-38 werkt direct in de cel waar het geïnternaliseerd is, maar kan ook door de celwand diffunderen en zo effect hebben op de omliggende cellen. Ook kan de hydrolyseerbare linker op de buitenzijde van de cel afgebroken worden zonder dat het ADC geïnternaliseerd hoeft te worden, waardoor ook een direct effect op de omliggende cellen uitgeoefend wordt. Een niet-gerandomiseerde fase II-studie liet effectiviteit zien bij 108 TNBC-patiënten na eerdere behandeling.3 De objectieve responskans in die studie bedroeg 33 procent en de mediane responsduur was 7,7 maanden. Deze resultaten leidden tot het ontwerp van de fase III-studie ASCENT4, waarvan de resultaten in dit advies besproken worden.
1. Kankersoort en lijn van behandeling
In de ASCENT-studie wordt behandeling met sacituzumab govitecan vergeleken met chemotherapie in de vorm van eribuline, capecitabine, vinorelbine of gemcitabine (naar keuze van de behandelaar) bij patiënten met een irresectabel of gemetastaseerd TNBC die eerder waren behandeld met ten minste 2 lijnen systemische therapie voor lokaal uitgebreide of gemetastaseerde ziekte. Patiënten moesten zijn behandeld met ten minste 1 lijn taxaanbevattende therapie; dit mocht ook in de adjuvante setting gegeven zijn. Sacituzumab govitecan is door de EMA geregistreerd voor toepassing bij patiënten met een irresectabel of gemetastaseerd TNBC die ten minste 2 eerdere lijnen systemische therapie hebben ontvangen, waarvan ten minste 1 lijn voor irresectabele of gemetastaseerde ziekte.
2. Vergelijking met de referentiebehandeling in Nederland
De referentiebehandeling in de ASCENT-studie bestaat uit chemotherapie in de vorm van eribuline, capecitabine, vinorelbine of gemcitabine (naar keuze van de behandelaar). Dit komt overeen met de behandeling zoals die ook in Nederland gegeven wordt bij patiënten die al 2 lijnen chemotherapie voor gemetastaseerd TNBC ontvangen hebben.
3. Methode en kwaliteit van de studie
ASCENT is een gerandomiseerde fase III-multicenterstudie voor patiënten met een irresectabel of gemetastaseerd TNBC die eerder behandeling met ten minste 2 lijnen systemische therapie met ten minste 1 lijn taxaanbevattende therapie hebben gekregen. Neoadjuvante of adjuvante chemotherapie die minder dan 12 maanden voor het vaststellen van metastasen was afgerond en PARP-remmers telden mee als 1 lijn chemotherapie.
Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn, een ECOG-performancestatus van 0 of 1 te hebben en een levensverwachting van ten minste 3 maanden. Patiënten zonder meetbare ziekte werden geëxcludeerd. Patiënten met hersenmetastasen die ten minste 4 weken stabiel waren (bevestigd door MRI-scan) mochten in de studie geïncludeerd worden, met een maximum van 15 procent van de totale groep. Deze groep werd echter uitgesloten voor de analyse van het primaire eindpunt. Bij asymptomatische patiënten werd geen screening verricht naar de aanwezigheid van hersenmetastasen.
Patiënten werden 1:1 gerandomiseerd tussen behandeling met sacituzumab govitecan 10 mg/kg op dag 1 en 8 intraveneus elke 3 weken of chemotherapie naar keuze van de behandelaar. De chemotherapie bestond uit eribuline 1,4 mg/m2 op dag 1 en 8 intraveneus elke 3 weken of vinorelbine 25 mg/m2 intraveneus wekelijks of capecitabine 1.000 tot 1.250 mg/m2 per os gedurende 14 dagen elke 3 weken of gemcitabine 800 tot 1.200 mg/m2 op dag 1, 8 en 15 intraveneus elke 4 weken. De behandeling werd gestratificeerd naar het aantal eerdere lijnen chemotherapie (2 of 3 versus meer dan 3), de aan- of afwezigheid van hersenmetastasen en geografische ligging (Noord-Amerika versus de rest van de wereld).
Dosisaanpassing was voor alle behandelingen toegestaan. In de sacituzumab govitecan-groep werd bij febriele neutropenie van graad 3, neutropenie van graad 4 gedurende ten minste 7 dagen of neutropenie van graad 3 ondanks 2 tot 3 weken uitstel een dosisreductie en het toevoegen van G-CSF aanbevolen. Als (hematologische) toxiciteit van graad 3 of 4 na 3 weken niet hersteld was tot maximaal graad 1, werd de behandeling met sacituzumab govitecan gestaakt. Premedicatie ter preventie van infuusreacties was aanbevolen.
Uit eerdere studies was bekend dat UGT1A1-polymorfismen geassocieerd zijn met een verhoogd risico op hematologische toxiciteit van sacituzumab govitecan. Om deze reden moesten inhibitoren en inductoren van UGT1A1 voorzichtig gebruikt worden.
De behandeling werd gecontinueerd tot progressie, terugtrekken van de patiënt uit de studie, onacceptabele toxiciteit of overlijden. Het was voor patiënten uit de chemotherapiegroep niet toegestaan om na progressie behandeld te worden met sacituzumab govitecan.
Het primaire eindpunt van de studie was progressievrije overleving (PFS), centraal en geblindeerd vastgesteld, bij patiënten zonder bekende hersenmetastasen op het moment van inclusie in de studie. Secundaire eindpunten waren overleving (OS), PFS vastgesteld door de lokale onderzoeker, objectieve responskans (ORR) – alle bij patiënten zonder hersenmetastasen – en veiligheid.
Een CT-scan of MRI-scan voor evaluatie werd gedurende de eerste 36 weken elke 6 weken gemaakt en daarna elke 9 weken. Voor het vaststellen van respons werd RECIST 1.1 gebruikt. Elke respons diende na 4 tot 6 weken te worden bevestigd met een nieuwe scan.
Bijwerkingen van de behandeling werden geëvalueerd volgens de Medical Dictionary for Regulatory Activities (MedDRA). De ernst van de bijwerkingen werd vastgelegd aan de hand van de CTCAE 4.03. Data over vervolgbehandelingen en kwaliteit van leven zijn in deze studie niet verzameld.
Volgens het ontwerp van de studie waren er 315 events nodig om met 95 procent power en een tweezijdige alfa van 5 procent een hazard ratio (HR) van 0,667 voor progressie of overlijden vast te kunnen stellen. In totaal werd verwacht dat daarvoor 488 patiënten moesten worden geïncludeerd, inclusief maximaal 15 procent patiënten met hersenmetastasen. Dit komt overeen met een verwachte toename van de PFS van 3 maanden met chemotherapie naar 4,5 maanden met sacituzumab govitecan. De overleving zou alleen volgens een tweezijdige alfa van 0,05 getoetst worden indien de PFS statistisch significant was.
In het studieprotocol was aanvankelijk een interim-analyse voor futiliteit voorzien na 50 procent van het aantal events, maar door snelle inclusie in de studie werd besloten om geen interimanalyse te verrichten.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen november 2017 en september 2019 werden 529 patiënten, waarvan 61 patiënten met hersenmetastasen, geïncludeerd in 88 centra in 7 landen. Van de 468 patiënten zonder hersenmetastasen, de groep waarin de primaire analyse plaatsvond, werden 235 patiënten gerandomiseerd in de sacituzumab govitecan-groep en 233 patiënten in de chemotherapie-groep. Van de patiënten in de chemotherapiegroep kreeg 54 procent eribuline, 20 procent vinorelbine, 13 procent capecitabine en 12 procent gemcitabine. De mediane follow-upduur was 17,7 maanden.
In de chemotherapie-groep zonder hersenmetastasen kregen 32 patiënten geen studiebehandeling en in de sacituzumab govitecan-groep waren dit 7 patiënten. Deze patiënten zijn wel meegenomen in de effectiviteitsanalyse, maar niet in de veiligheidsanalyse.
Er waren 316 patiënten met progressie of overlijden: 166 in de sacituzumab govitecangroep en 150 in de chemotherapie-groep. De uitgangskarakteristieken in beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 54 jaar, 82 procent had eerdere behandeling met antracyclines gekregen, 66 procent met carboplatine en 27 procent had eerder een PD-(L)-1-remmer gekregen. In totaal 30 procent van de patiënten had geen tripelnegatief carcinoom bij initiële diagnose van het mammacarcinoom.
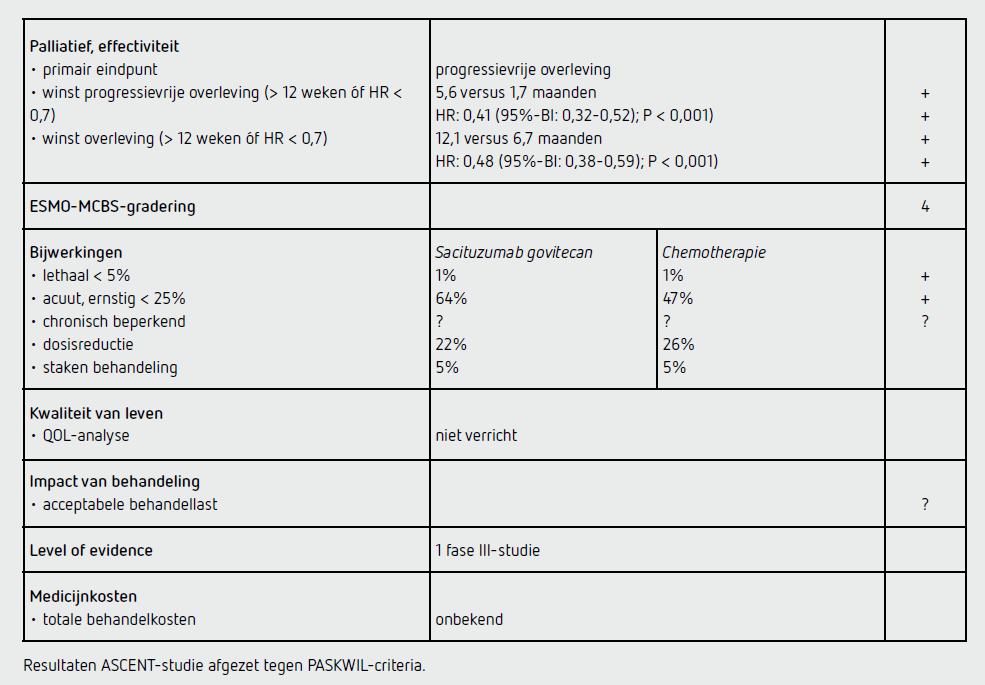
Het primaire eindpunt PFS bij de patiënten zonder hersenmetastasen was statistisch significant beter in de sacituzumab govitecan-groep dan in de chemotherapie-groep (HR: 0,41 [95%-BI: 0,32-0,52]; P < 0,001). De mediane PFS bedroeg 5,6 maanden (95%-BI: 4,3-6,3) in de sacituzumab govitecan-groep en 1,7 maanden (95%-BI: 1,5-2,6) in de chemotherapie-groep. De overleving bij deze groep zonder hersenmetastasen was ook beter in de sacituzumab govitecan-groep dan in de chemotherapie-groep: mediaan 12,1 maanden (95%-BI: 10,7-14,0) versus 6,7 maanden (95%-BI: 5,8-7,7) (HR: 0,48 [95%-BI: 0,38-0,59]; P <0,001).
De winst in PFS en OS was consistent in alle vooraf gedefinieerde subgroepen, namelijk: patiënten ouder dan 65 jaar, behandeld met meer dan 3 eerdere lijnen systemische therapie, behandeld met PD-(L)-1-remmers, zonder tripelnegatief carcinoom bij primaire diagnose en met levermetastasen. De objectieve responskans was 35 procent in de sacituzumab govitecangroep en 5 procent in de chemotherapiegroep met een mediane responsduur van 6,3 versus 3,6 maanden (HR: 0,39 [95%-BI: 0,14-1,07]).
In de totale populatie, waarbij ook de patiënten met hersenmetastasen zijn meegenomen, was de mediane PFS 4,8 maanden in de sacituzumab govitecan-groep en 1,7 maanden in de chemotherapie-groep (HR: 0,43 [95%-BI: 0,35-0,54]). De mediane overleving in de totale populatie was 11,8 maanden in de sacituzumab govitecan-groep versus 6,9 maanden in de chemotherapiegroep (HR: 0,51 [95%-BI: 0,41-0,62]).
Van de 267 patiënten in de sacituzumab govitecan-groep ontvingen 258 patiënten ten minste één gift sacituzumab govitecan: het mediaan aantal cycli was 7 met een mediane behandelduur van 4,4 maanden. Van de patiënten in de sacituzumab govitecan-groep ontving 22 procent ten minste één dosisreductie, hetgeen bij 26 procent van de patiënten in de chemotherapie-groep plaatsvond. In beide behandelgroepen werd bij 12 patiënten (5 procent) de behandeling vanwege bijwerkingen gestaakt. In totaal hadden 117 patiënten (45 procent) in de sacituzumab govitecan-groep en 71 patiënten (32 procent) in de chemotherapie-groep ten minste één bijwerking van graad 3. Ten minste één bijwerking van graad 4 hadden 48 patiënten (19 procent) in de sacituzumab govitecan-groep en 33 patiënten (15 procent) in de chemotherapie-groep. In de sacituzumab govitecan-groep overleden 3 patiënten: 2 ten gevolge van respiratoire insufficiëntie en 1 door een postobstructiepneumonie (niet-behandelingsgerelateerd). In de chemotherapiegroep overleden eveneens 3 patiënten (neutropene sepsis, sepsis en algehele achteruitgang geduid als progressieve ziekte).
De meest voorkomende bijwerkingen van graad 3 of hoger in de sacituzumab govitecan-groep waren neutropenie (51 procent), leukopenie (10 procent), febriele neutropenie (6 procent) en diarree (10 procent). In de sacituzumab govitecan-groep kreeg 49 procent van de patiënten G-CSF na eerdere neutropenie. In de sacituzumab govitecan-groep ontwikkelde 1 patiënt een interstitiële pneumonitis van graad 3. De meest voorkomende bijwerking van graad 3 of hoger in de chemotherapie-groep was neutropenie (33 procent).
Discussie
In de ASCENT-studie wordt een statistisch significante verbetering van de PFS gevonden bij palliatieve behandeling met sacituzumab govitecan ten opzichte van chemotherapie bij patiënten met een irresectabel of gemetastaseerd TNBC na behandeling met ten minste 2 eerdere lijnen chemotherapie (HR: 0,41 [95%-BI: 0,32-0,52]; P < 0,001).
De resultaten van dit eindpunt voldoen aan de PASKWIL-criteria voor een positief advies. De superieure PFS was consistent in alle vooraf gedefinieerde subgroepen, inclusief patiënten die eerder met immuuntherapie behandeld waren. Ook de overleving en de objectieve responskans waren beter in de sacituzumab govitecan-groep dan in de chemotherapie-groep. De absolute toename in mediane PFS van 3,9 maanden en mediane overleving van 5,4 maanden is klinisch relevant bij deze groep patiënten met een sombere prognose en beperkte behandelmogelijkheden. Wel zal in de praktijk een aanzienlijk deel van de patiënten niet aan deze laterelijnsbehandeling toekomen vanwege het vaak agressieve karakter van dit tumortype. Neutropenie komt bij sacituzumab govitecan geregeld voor. Hoewel dit meestal niet tot febriele neutropenie leidt en de patiënt hier vaak weinig hinder van ondervindt, leidt dit wel tot dosisreductie.
De in het studieprotocol voorgestelde en geregeld ingezette behandeling met G-CSF bij neutropenie komt niet overeen met de Nederlandse praktijk waar beperkt plaats is voor G-CSF in de (laterelijns) palliatieve setting. In Nederland zal vaak gekozen worden voor enkel dosisreductie. Inmiddels is bekend dat patiënten met homozygotie voor het UGT1A1*28-genotype een hoger risico op ernstige bijwerkingen van irinotecan hebben. Dit geldt dus ook voor patiënten die behandeld worden met sacituzumab govitecan, waarvan het werkzame bestanddeel de actieve metaboliet van irinotecan is.
De registratietekst van de EMA verschilt subtiel van de inclusiecriteria van de ASCENT- studie, namelijk dat in de EMA-registratie eventuele chemotherapie in de (neo)adjuvante setting altijd meetelt als 1 van de 2 vereiste eerdere behandellijnen en dat eerdere behandeling met een taxaan niet verplicht is.
Het belang van histologie bij gemetastaseerde ziekte wordt nogmaals benadrukt door het feit dat 30 procent van de patiënten in deze studie bij initiële diagnose nog geen TNBC had, maar in de gemetastaseerde setting wel, en hierdoor toch voor sacituzumab govitecan in aanmerking kwam. Patiënten met stabiele hersenmetastasen mochten geïncludeerd worden in de studie, maar werden niet meegenomen in de analyse van het primaire eindpunt. Dit was reeds meegenomen in het statistisch plan van de studie. De studieresultaten geven geen aanleiding om aan te nemen dat deze patiënten geen baat hebben bij de behandeling met sacituzumab govitecan. Er zijn geen data over de kwaliteit van leven tijdens behandeling met sacituzumab govitecan.
5. Kosten
Op dit moment is de vergoeding voor sacituzumab govitecan in Nederland nog niet geregeld en zit het medicament nog in de sluis. De kosten van sacituzumab govitecan zijn nog niet bekend (bron: medicijnkosten.nl d.d. 14 februari 2022).
Conclusie
In de hier besproken ASCENT-studie bij patiënten met een irresectabel of gemetastaseerd TNBC die eerdere behandeling met ten minste 2 lijnen systemische therapie met in ieder geval 1 lijn taxaanbevattende therapie hebben gekregen, wordt een statistisch significant langere PFS gezien na palliatieve behandeling met sacituzumab govitecan dan na chemotherapie (HR: 0,41 [95%-BI: 0,32-0,52]; P < 0,001). Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL-criteria voor palliatieve behandeling. Ook het secundaire eindpunt overleving was beter in de sacituzumab govitecan-groep dan in de chemotherapie-groep: 12,1 maanden (95%-BI: 10,7-14,0) versus 6,7 maanden (95%-BI: 5,8-7,7) (HR: 0,48 [95%-BI: 0,38-0,59]; P < 0,001).
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab en chemotherapie als eerstelijnsbehandeling bij het lokaal irresectabel gerecidiveerd of gemetastaseerd tripelnegatief mammacarcinoom. Med Oncol 2021;24(10):31-5.
- Ocean AJ, Starodub AN, Bardia A, et al. Sacituzumab govitecan (IMMU-132), an anti-Trop-2-SN-38 antibodydrug conjugate for the treatment of diverse epithelial cancers: safety and pharmacokinetics. Cancer 2017;123(19):3843-54.
- Bardia A, Mayer IA, Vahdat LT, et al. Sacituzumab govitecanhziy in refractory metastatic triplenegative breast cancer. N Engl J Med 2019;380(8):741-51.
- Bardia A, Hurvitz SA, Tolaney SM, et al; ASCENT Clinical Trial Investigators. Sacituzumab govitecan in metastatic triplenegative breast cancer. N Engl J Med 2021;384(16):1529-41.