
Inleiding
Jaarlijks zijn er in Nederland ongeveer 700 nieuwe patiënten met een schildkliercarcinoom, waarbij er bij ongeveer 5 procent van de patiënten sprake is van het medullaire type (circa 30 à 40 patiënten per jaar). Het medullair schildkliercarcinoom (MTC) is een tumor uitgaande van calcitonineproducerende parafolliculaire C-cellen. De primaire behandeling is chirurgie, waarmee het merendeel van de patiënten wordt gecureerd. Bij 20 à 30 procent van de patiënten met een medullair schildkliercarcinoom is er sprake van een erfelijke vorm op basis van een kiembaanmutatie in het RET-gen (het MEN2-syndroom). Bij het sporadisch medullair schildkliercarcinoom komt ook frequent een mutatie voor in het RET-gen, namelijk bij ongeveer 60 procent. Ook treden sporadisch RET-alteraties op bij andere schilkiercarcinomen. Het lokaal gevorderd of gemetastaseerd medullaire schildkliercarcinoom is slechts zeer beperkt gevoelig voor radioactief jodium, radiotherapie en chemotherapie.
De multitargeted kinaseremmers vandetanib en cabozantinib zijn voor de behandeling van het lokaal gevorderd of gemetastaseerd medullair schildkliercarcinoom geregistreerd en werden in 2013 en 2015 door de commissie BOM positief beoordeeld.1,2
Selpercatinib is een orale, hoogselectieve RET-kinaseremmer. In de hier te bespreken LIBRETTO-001-studie3 wordt de efectiviteit van selpercatinib beschreven in een cohort patiënten met een gevorderd of gemetastaseerd schildkliercarcinoom en een RET-alteratie (mutatie of genfusie), met of zonder voorbehandeling met een multitargeted kinaseremmer. In september 2022 werd op het ESMO-congres een poster gepresenteerd met meer patiënten en een langere follow up van dit cohort.4
Selpercatinib heeft door de EMA een voorwaardelijke toelating gekregen voor de behandeling van volwassenen en adolescenten vanaf 12 jaar met een gevorderd of gemetastaseerd schildkliercarcinoom en een RET-alteratie (mutatie of genfusie).
2. Onderbouwing voor een niet-gerandomiseerde studie
Het gevorderd of gemetastaseerd schildkliercarcinoom met een RET-alteratie is zeldzaam. Er is echter een eerstelijnsbehandeling beschikbaar, namelijk vandetanib of cabozantinib. Deze middelen zijn beide in een gerandomiseerde fase III-studie efectief gebleken. De efectiviteit van selpercatinib in de eerste lijn vergeleken met de reeds beschikbare middelen wordt momenteel onderzocht in de LIBRETTO-531-studie, waarin wordt gerandomiseerd tussen selpercatinib en vandetanib of cabozantinib als eerstelijnsbehandeling. Resultaten hiervan worden na 2026 verwacht. Een gerandomiseerde studie in de tweede lijn voor deze zeldzame indicatie wordt door de cieBOM niet als haalbaar beschouwd. Om deze reden is er alleen sprake van een unmet need voor patiënten met een schildkliercarcinoom en een RET-alteratie met progressie na eerdere systemische behandeling. De LIBRETTO-001-studie zal derhalve door de cieBOM alleen voor deze subgroep worden beoordeeld.
3. Methode en kwaliteit van de studie
De LIBRETTO-001-studie is een fase I/II-multicenterstudie waarin patiënten met een gevorderd of gemetastaseerd schildkliercarcinoom met een RET-alteratie (mutatie of genfusie) met of zonder eerdere behandeling met vandetanib, cabozantinib of beide werden behandeld met selpercatinib.
Om voor inclusie in aanmerking te komen dienden patiënten 12 jaar of ouder te zijn en een ECOG-performancestatus van 0-2 te hebben. Daarnaast was adequate orgaanfunctie en een gecorrigeerde QT-tijd van ≤ 470 ms vereist. Patiënten mochten meerdere lijnen behandeling, inclusief multitargeted kinaseremmers, hebben gehad. Vereist was een prospectief vastgestelde RET-mutatie of fusie met behulp van next generation sequencing, fuoresence in situ hybridisatie, of PCR, uitgevoerd in een gecertifceerd centrum. Ook moest er sprake zijn van meetbare ziekte volgens RECIST 1.1.
Patiënten in het dosis-escalatiegedeelte van de fase I-studie kregen selpercatinib in oplopende doseringen van 20 mg eenmaal daags tot 240 mg tweemaal daags. In fase I bestond de mogelijkheid de dosering binnen patiënten te verhogen. Alle patiënten die deelnamen aan het fase II-deel van de studie kregen de aanbevolen dosis van 160 mg tweemaal daags. Patiënten met gedocumenteerde ziekteprogressie mochten doorgaan met selpercatinib als ze klinisch voordeel hadden. In de huidige rapportage werden alleen patiënten geanalyseerd met een medullair schildkliercarcinoom en een RET-mutatie en patiënten met elk type schildkliercarcinoom en een RET-fusie.
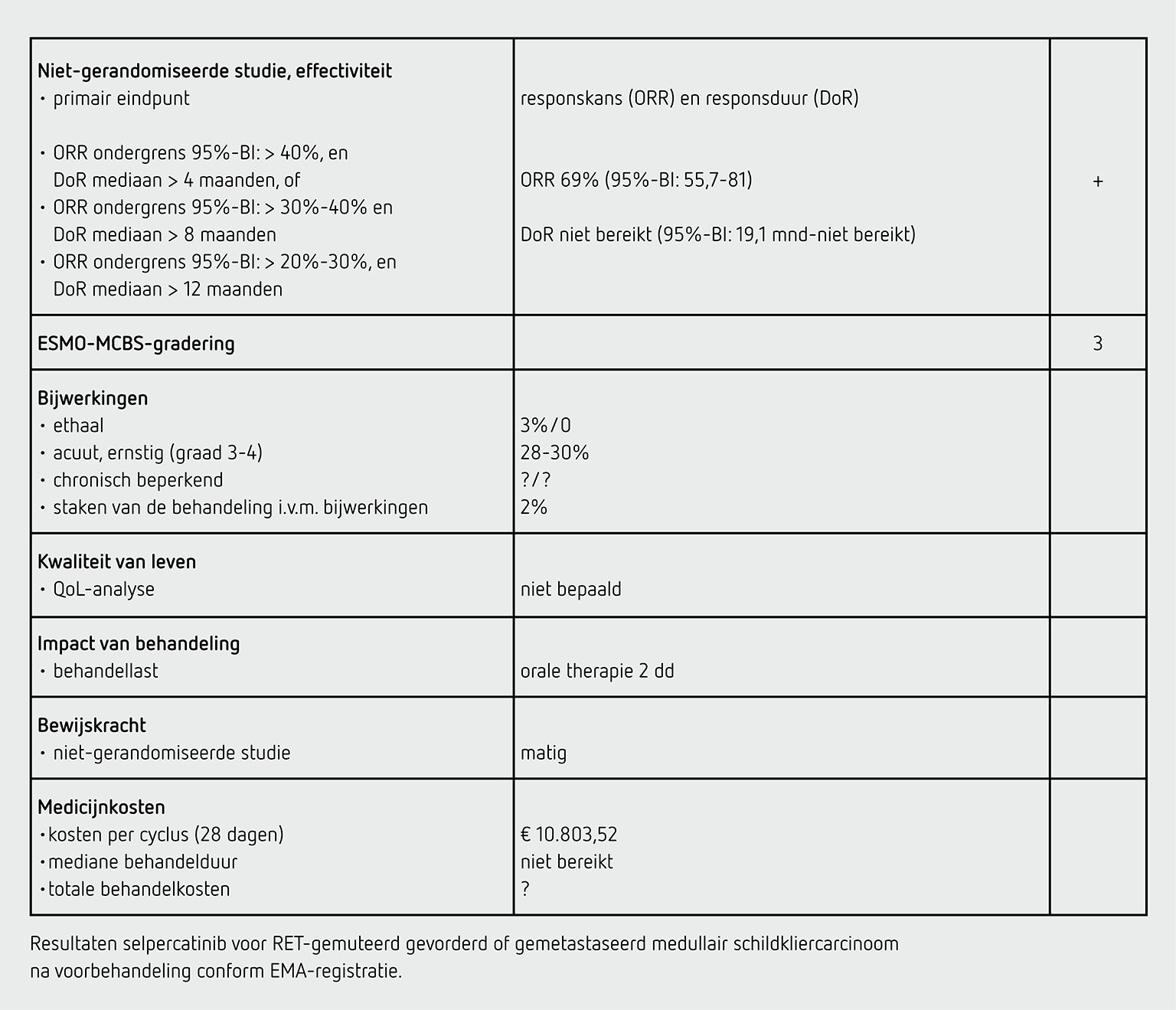
Het primaire eindpunt was het percentage patiënten met een objectieve respons (ORR), bevestigd middels een tweede meting en centraal en onafhankelijk bepaald. Secundaire eindpunten waren progressievrije overleving, duur van de respons (DoR) en veiligheid. Kwaliteit van leven werd niet gemeten.
Een CT-scan voor evaluatie werd in het eerste jaar elke 8 weken uitgevoerd, daarna elke 12 weken. Serum calcitonine en het CEA werden longitudinaal gevolgd. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.03. Data over vervolgbehandelingen zijn niet verzameld in deze studie. De primaire-analysepopulatie betrof de eerste 55 achtereenvolgend behandelde patiënten in zowel het fase I- als het fase II-deel van de studie met een medullair schildkliercarcinoom en een RET-mutatie, meetbare ziekte volgens RECIST 1.1, en eerdere behandeling met vandetanib, cabozantinib, of beide. In tweede instantie werden in de primaire-analysepopulatie ook patiënten zonder meetbare ziekte uit de fase I geïncludeerd.
Bij een ORR van 40 procent in de primaire analyse waren 55 patiënten nodig om met een power van 89 procent en een 95 procent tweezijdig betrouwbaarheidsinterval een ondergrens van het betrouwbaarheidsinterval van 20 procent vast te stellen.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen mei 2017 en juni 2019 werden door 65 centra in 12 landen in totaal 162 patiënten geïncludeerd in de drie cohorten: 55 patiënten met een RET-gemuteerd medullair schildkliercarcinoom eerder behandeld met vandetanib en/of cabozantinib; 88 patiënten met een RET-gemuteerd medullair schildkliercarcinoom die nog geen behandeling hadden gekregen en 19 patiënten met een eerder behandeld RET-gefuseerd niet-medullair schildkliercarcinoom.
De hierna beschreven resultaten betrefen die uit de primaire analyse van 55 patiënten met een RET-gemuteerd medullair schildkliercarcinoom. De mediane leeftijd van de patiënten was 57 jaar, 89 procent was Kaukasisch, 75 procent had een ECOG-PS van 1. Het mediane aantal vorige behandelingen was 2 (range 1-8). Eerdere therapie bestond uit vandetanib (33 procent), cabozantinib (24 procent) of beide (43 procent). De ORR was 69 procent (95%-BI: 55-81): 5 patiënten (9 procent) hadden een complete respons en 33 patiënten (60 procent) hadden een partiële respons. Na één jaar duurde de respons voort bij 86 procent (95%-BI: 67-95) van de patiënten met een respons. De eenjaars progressievrije overleving was 82 procent (95%-BI, 69-90). De mediane follow-up was 16,7 maanden. De mediaan voor PFS, DoR en OS was nog niet bereikt.
Op ESMO 2022 werd een geüpdatete analyse, waarbij het cohort uitgebreid was tot 151 voorbehandelde patiënten met een mediane follow-up van 27,6 maanden.
In dat cohort was de ORR 73,5 procent (95%-BI: 65,7-80,4) met een complete respons in 9,3 procent en een partiele respons in 64,2 procent. Na 2 jaar was er sprake van een aanhoudende respons bij 64,5 procent (95%-BI: 52,9-73,9) van de patiënten. De mediane PFS was 34 maanden (95%-BI: 25,7-niet bereikt). De 2-jaarsoverleving was 77,2 procent in deze 151 patiënten.
In de groep patiënten die ten minste één dosis selpercatinib hadden gekregen (n = 162) waren de meest voorkomende behandelingsgerelateerde bijwerkingen van graad 3 en hoger: hypertensie (12 procent) en verhoogde leverenzymen (7-10 procent). Vijf patiënten (3 procent) overleden tijdens de behandeling (waaronder 1 aan een hartstilstand en 1 aan hartfalen). Dit werd niet gerelateerd aan de selpercatinib door de onderzoekers. In de LIBRETTO-studie, waarin meer patiënten behandeld met selpercatinib bestudeerd werden (n = 531), werd de dosis vanwege bijwerkingen gereduceerd in 160 patiënten (30 procent) en staakten 12 patiënten (2 procent) de behandeling vanwege behandelingsgerelateerde bijwerkingen.
Discussie
Om voor beoordeling volgens de PASKWIL-criteria van een niet-gerandomiseerde studie in aanmerking te komen moet de behandelindicatie voor het betrefende middel zeldzaam en goed defnieerbaar zijn, wat in het geval van RET-gemuteerd gevorderd of gemetastaseerd schildkliercarcinoom het geval is. Daarnaast moet er ook geen mogelijkheid zijn om een fase III-studie uit te voeren. Er is momenteel een fase III-studie met selpercatinib voor deze indicatie in de eerste lijn (LIBRETTO-531) met als primaire uitkomstmaat PFS. In die studie worden patiënten gerandomiseerd worden tussen selpercatinib versus cabozantinib of vandetanib. De huidige beschikbare middelen cabozantinib en vandetanib zijn destijds ook in een gerandomiseerde fase III-studie onderzocht.1,2 Voor de eerste lijn is er dus geen sprake van een unmet need. Om deze reden beoordeelt de commissie BOM alleen de patiënten uit de primaire-analysepopulatie, waarop ook de power van de LIBRETTO-001 is gebaseerd, namelijk de patiënten met een medullair schildkliercarcinoom met een RET-mutatie na eerdere behandeling met vandetanib en/of cabazantinib.
In de LIBRETTO-001-studie wordt bij mediane follow-up van ten minste 14 maanden een ORR van 69 procent gevonden bij voorbehandelde patiënten die met selpercatinib behandeld worden, met een ondergrens van het betrouwbaarheidsinterval van 55 procent. Na 1 jaar heeft nog 86 procent een respons. In een update, gepresenteerd op ESMO 2022, worden deze data bevestigd in een groter cohort. Hiermee voldoet de studie aan de PASKWIL-criteria voor niet-gerandomiseerde studies voor een voorlopig positief advies bij patiënten met een RET-gemuteerd medullair schildkliercarcinoom na eerdere behandeling.
De bijwerkingen van deze behandeling lijken hanteerbaar en weinig patiënten kiezen ervoor de behandeling te staken vanwege bijwerkingen. De plaats van selpercatinib in de eerste lijn wordt momenteel onderzocht in een fase III-studie met PFS als primair eindpunt. Zodra de resultaten van die studie bekend zijn, zal herbeoordeling van dit advies plaatsvinden. Mede door de lange behandelingsduur is de behandeling kostbaar.
5. Kosten
De behandeling met selpercatinib kost per 4 weken bij gebruik 2 maal per dag 160 mg 10.804,64 euro (bron: www.medicijnkosten.nl d.d. 6 maart 2023).
De mediane behandelduur is lang en nog niet bepaald. Per jaar kost de behandeling ongeveer 140.000 euro.
Conclusie
In de hier besproken LIBRETTO-001-studie wordt bij patiënten met een RET-gemuteerd gevorderd of gemetastaseerd medullair schildkliercarcinoom na eerdere behandeling met vantedinib, cabozantinib of beide, een ORR van 69 procent en een DoR van meer dan 19 maanden gezien. Hiermee voldoet de studie aan de PASKWIL-criteria voor niet-gerandomiseerde studies voor een voorlopig positief advies. De beoordeling door cieBOM is restrictiever dan de voorlopige toelating door EMA.
Dit advies is tot stand gekomen op basis van de uitkomsten van niet-gerandomiseerd onderzoek. De kwaliteit van het bewijs is matig. Het is waarschijnlijk dat met verder onderzoek de schatting van de grootte van het efect van de behandeling zal veranderen.
Referenties
- Kerst JM, Eskens FALM, Gelderblom AJ, et al; NVMO-commissie BOM. Vandetanib bij het lokaal gevorderd of gemetastaseerd medullair schildkliercarcinoom. Med Oncol 2013;16(1):29-31.
- NVMO-commissie BOM medische oncologie april 2015
- Wirth LJ, Sherman E, Robinson B, Solomon B, et.al. Efficacy of selpercatinib in retaltered thyroid cancers. N Engl J Med. 2020 Aug 27;383(9):825-35.
- 1656P Durable efficacy of selpercatinib in patients (pts) with medullary thyroid cancer (medullair schilkliercarcinoom): Update of the LIBRETTO-001 trial. Annals of Oncology (2022) 33 (suppl_7): S750S757. 10.1016/annonc/annonc1077