
Inleiding
Jaarlijks wordt in Nederland bij ongeveer 2.000 mensen een kleincellig longcarcinoom (SCLC) gediagnosticeerd, zo’n 15 procent van alle longkankerdiagnoses. Ten aanzien van behandelingsmogelijkheden wordt er onderscheid gemaakt tussen ‘limited-stage’ SCLC (SCLC-LS) en ‘extensive-stage’ SCLC (SCLC-ES). Bij twee derde van de patiënten met SCLC is er bij diagnose sprake van ES waarbij de behandeling een palliatieve intentie heeft. De standaardbehandeling bestaat uit 4 tot 6 kuren met een platinumderivaat en etoposide met een responspercentage van rond de 80 procent en een mediane overleving (OS) van 10 tot 12 maanden. De prognose is de afgelopen 30 jaar nauwelijks verbeterd. Profylactische schedelbestraling en aanvullende thoracale radiotherapie zijn te overwegen bij patiënten die geen progressie hebben onder chemotherapie. In 2018 werd voor SCLC-ES de combinatie van de PD-L1-remmer atezolizumab met carboplatine en etoposide door EMA goedgekeurd. Vervolgens werd in 2021 de combinatie durvalumab, een andere PD-L1-remmer, met carboplatine en etoposide door EMA goedgekeurd. De resultaten van de IMpower133- en de CASPIAN-studie voldeden echter niet aan de PASKWIL-criteria voor een positief advies op basis van hazard ratio (HR) en overlevingswinst.1,2
De hier te bespreken ASTRUM-005-studie betreft de vergelijking van serplulimab, een monoklonaal antilichaam gericht tegen PD-1, in combinatie met carboplatine en etoposide ten opzichte van placebo en chemotherapie bij patiënten met SCLC-ES.3 EMA heeft serplulimab gecombineerd met carboplatine en etoposide geregistreerd als eerstelijnsbehandeling van patiënten met SCLC-ES.
Kankersoort en lijn van behandeling
Eerstelijnsbehandeling met serplulimab met carboplatine en etoposide werd onderzocht bij patiënten met SCLC-ES.
Vergelijking met de referentiebehandeling in Nederland
De in de ASTRUM-005-studie gebruikte controlebehandeling met carboplatine en etoposide komt overeen met de huidige standaard eerstelijnsbehandeling voor SCLC-ES in Nederland.
Methoden van de studie
De ASTRUM-005-studie is een dubbelblind placebogecontroleerde gerandomiseerde fase III-multicenterstudie voor patiënten met SCLC-ES. Om voor inclusie in aanmerking te komen dienden patiënten ten minste 18 jaar te zijn, een WHOperformancestatus van 0 of 1, een levensverwachting van minimaal 12 weken en een adequate orgaan- en beenmergfunctie te hebben. Daarnaast moest er meetbare ziekte zijn volgens RECIST 1.1. Patiënten met asymptomatische of behandelde en stabiele hersenmetastasen, gedefinieerd als minimaal 2 maanden geen groei of nieuwe lesies op 2 radiologische onderzoeken (met een interval van minimaal 4 weken) en geen behandeling met steroïden binnen 3 dagen voorafgaand aan de behandeling, konden aan de studie deelnemen. De belangrijkste exclusiecriteria waren gemengd grootcellig- en kleincelligcarcinoom en een contra-indicatie voor immuuntherapie.
Patiënten werden 2:1 gerandomiseerd tussen behandeling met serplulimab en chemotherapie of placebo en chemotherapie. Bij de randomisatie werd er gestratificeerd naar PD-L1-expressie (tumor proportion score [TPS] < 1 procent versus ≥ 1 procent versus niet beschikbaar of niet evalueerbaar), hersenmetastasen (ja versus nee) en leeftijd (< 65 jaar versus ≥ 65 jaar). De chemotherapie bestond uit 4 3-wekelijkse cycli intraveneus etoposide (100 mg/m2) op dag 1-3 en carboplatine (AUC 5 tot maximaal 750 mg) op dag 1. Serplulimab (4,5 mg/kg) of placebo werd elke 3 weken intraveneus toegediend tot progressie, overlijden, intrekken van consent of onacceptabele toxiciteit. Dosisaanpassing en behandelonderbreking van de chemotherapie waren toegestaan volgens lokale standaarden. Serplulimab kon onderbroken worden, maar dosisreductie was niet toegestaan.
Voor de patiënten in de placebogroep was cross-over naar serplulimab bij progressie niet toegestaan. Patiënten in de serplulimabgroep mochten na progressie doorbehandeld worden met serplulimab als ze er volgens de behandelend arts klinisch voordeel bij hadden. Profylactische hersenbestraling was niet toegestaan. Data over vervolgbehandelingen zijn verzameld. Het primaire eindpunt van de studie was OS. Er waren 13 secundaire eindpunten waaronder progressievrije overleving (PFS), objectieve responskans, duur van de respons en veiligheid.
Een CT- of MRI-scan voor responsevaluatie werd gemaakt voor start, elke 6 weken gedurende de eerste 48 weken en daarna elke 9 weken. Kwaliteit van leven werd geëvalueerd middels de vragenlijsten EQ-5D-5L, EORTC-QLQ-C30 en QLQ-LC13, die werden afgenomen voor start behandeling en vervolgens op dag 1 om elke cyclus. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 5.0.
Er waren 342 overlijdens nodig om met 85 procent power en een tweezijdige alfa van 0,05 een verschil in OS vast te kunnen stellen als de HR 0,70 is voor de serplulimabgroep ten opzichte van de placebogroep. Gepland werd om 567 patiënten te includeren, rekening houdend met een verwachte uitval van 20 procent. Een interim-analyse voor OS was gepland nadat 226 patiënten waren overleden, waarbij een tweezijdige alfa van 0,012 werd gehanteerd gebaseerd op de alfa-verdeling volgens de O’Brien-Fleming-methode. Voor de finale analyse resteerde een tweezijdige alfa van 0,046.
Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
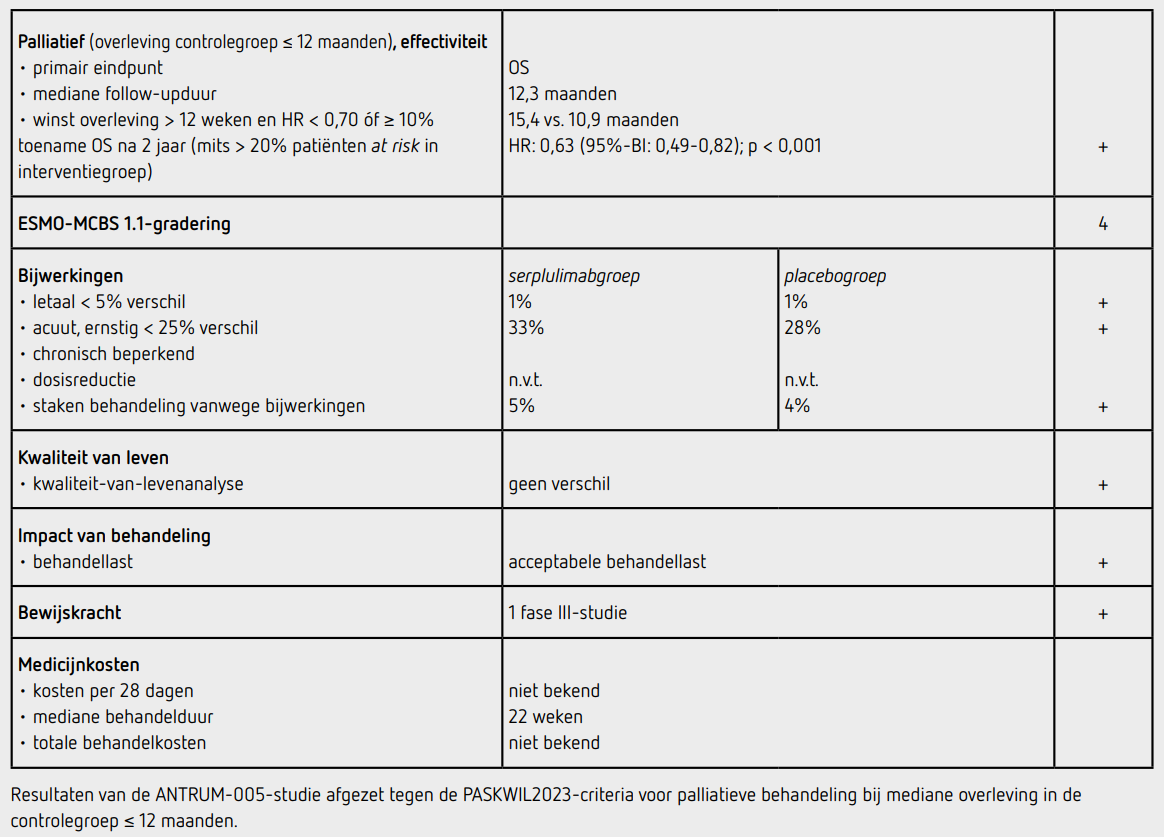
Tussen september 2019 en april 2021 werden 894 patiënten gescreend en 585 patiënten geïncludeerd door 114 centra in 6 landen (China, Rusland, Oekraïne, Polen, Georgië en Turkije): 389 patiënten in de serplulimabgroep en 196 in de placebogroep. De mediane follow-upduur ten tijde van deze interim-analyse bedroeg 12,3 maanden. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 63 jaar, 82 procent was man, 69 procent was Aziatisch, 13 procent had hersenmetastasen en 25 procent had levermetastasen. PD-L1 TPS was < 1 procent bij 83 procent van de tumoren. Twintig procent van de patiënten had nooit gerookt. Er waren 146 patiënten (37,5 procent) overleden in de serplulimabgroep en 100 patiënten (51,0 procent) in de placebogroep. De mediane OS was 15,4 maanden (95%-BI: 13,3- niet bereikt) in de serplulimabgroep en 10,9 maanden (95%-BI: 10,0-14,3) in de placebogroep. Het verschil in OS was statistisch significant (HR: 0,63 [95%-BI: 0,49-0,82]; p < 0,001). De geschatte OS na 1 jaar was 60,7 procent in de serplulimabgroep en 47,8 procent in de placebogroep. In de vooraf gespecificeerde subgroepen was de HR voor OS consistent in het voordeel van de serplulimabgroep, inclusief bij patiënten met of zonder Aziatische herkomst en wel of geen (voormalige) rokers. Bij patiënten met hersenmetastasen was de mediane OS 13,9 maanden in de serplulimabgroep en 10,0 maanden in de placebogroep (HR: 0,61 [95%-BI: 0,33-1,13]).
223 patiënten (57,3 procent) in de serplulimabgroep hadden ziekteprogressie of waren overleden en in de placebogroep waren dit 151 patiënten (77,0 procent). De mediane PFS, geblindeerd en centraal vastgesteld, was 5,7 maanden in de serplulimabgroep en 4,3 maanden in de placebogroep (HR: 0,48 [95%-BI: 0,38- 0,59]). De objectieve responskans was 80,2 procent in de serplulimabgroep en 70,4 procent in de placebogroep. De mediane responsduur was 5,6 maanden in de serplulimabgroep en 3,2 maanden in de placebogroep.
Het mediane aantal behandelcycli was 8 (behandelduur 22 weken) in de serplulimabgroep en 6 (behandelduur 16 weken) in de placebogroep. Alle geïncludeerde patiënten hadden ten minste één dosis medicatie ontvangen. Behandeling met serplulimab of placebo werd gestaakt ten gevolge van bijwerkingen bij respectievelijk 19 patiënten (5 procent) en 8 patiënten (4 procent).
In totaal hadden 129 patiënten (33 procent) behandeld in de serplulimabgroep ten minste één behandelingsgerelateerde bijwerking van graad 3 of hoger ten opzichte van 54 patiënten (28 procent) in de placebogroep. De meest voorkomende bijwerking van graad 3 of 4 was neutropenie (14 procent in beide groepen). Immuungerelateerde toxiciteit van graad 3 of hoger werd gezien bij 37 patiënten (9,5 procent) in de serplulimabgroep en bij 11 patiënten (5,6 procent) in de placebogroep. Er overleden 3 patiënten (1 procent) als gevolg van de behandeling in de serplulimabgroep en 1 patiënt (1 procent) in de placebogroep. Na progressie kregen 172 patiënten (44 procent) in de serplulimabgroep en 85 patiënten (43 procent) in de placebogroep een vervolgbehandeling. In de serplulimabgroep kregen 126 patiënten (32 procent) chemotherapie en 108 patiënten (28 procent) immuuntherapie, waarvan bij 95 patiënten (24 procent) serplulimab gecontinueerd werd na progressie. In de placebogroep kregen 75 patiënten (38 procent) chemotherapie en 19 patiënten (10 procent) immuuntherapie.
Tijdens het ASCO-congres 2024 werd een update gepresenteerd nadat 427 patiënten overleden waren en bij een mediane followupduur van 31,6 maanden. Het OS-verschil was consistent met de resultaten van de interim-analyse met een mediane OS van 15,8 maanden in de serplulimabgroep en 11,1 maanden in de placebogroep (HR: 0,61 [95%-BI: 0,50-0,74]). Analyse van kwaliteit-van-leven liet geen verschil van baseline tot week 18 in de functionele en symptoomdomeinen van de QLQ-C30, de symptoomdomeinen van de QLQ-LC13 en de EQ-5D-5L VAS zien tussen beide groepen en de waarden vertoonden over het algemeen verbetering in beide groepen.
Kwaliteit van de studie en interpretatie van de uitkomsten
Twee derde van de patiënten in deze studie is afkomstig uit Azië. Bij subgroepanalyse was er geen verschil in uitkomst tussen Aziatische patiënten en niet-Aziatische patiënten. Het valt daarnaast op dat 20 procent van de patiënten nooit gerookt heeft.
De referentiebehandeling met carboplatine en etoposide is conform het Nederlandse behandellandschap. Profylactische hersenbestraling was echter niet toegestaan in deze studie terwijl dat bij SCLC-LS wel de standaardbehandeling is en bij SCLC-ES overwogen kan worden bij goede respons op eerstelijns chemotherapie.
Er heeft een majeure tussentijdse wijziging in studiedesign plaatsgevonden. Het primaire eindpunt is gewijzigd van PFS naar OS. Aangezien OS het primaire eindpunt was en er nog geen bewijs was van effectiviteit van serplulimab in laterelijnsbehandeling is het begrijpelijk dat cross-over in de studie niet was toegestaan. In beide groepen kreeg 44 procent van de patiënten een vervolgbehandeling, maar in de placebogroep kreeg slechts 10 procent een vorm van immuuntherapie. In de serplulimabgroep was dat 28 procent wat echter vooral het continueren van serplulimab betrof na ziekteprogressie omdat er nog een klinisch voordeel zou zijn.
Discussie
In de ASTRUM-005-studie wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt OS van eerstelijns palliatieve behandeling met serplulimab met carboplatine en etoposide ten opzichte van behandeling met placebo met carboplatine en etoposide bij patiënten met SCLC-ES (HR: 0,63 [95%-BI: 0,49-0,82]; p < 0,001) met een toename van de mediane OS van 4,5 maanden. Deze uitkomsten voldoen aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling met mediane overleving in de controlegroep ≤ 12 maanden. De resultaten zijn gebaseerd op de interim-analyse, waarbij de mediane follow up slechts 12,3 maanden was, maar de OS winst bleef bestaan in een geüpdatete analyse na een mediane follow-up van 31,6 maanden.
Het belangrijkste aandachtspunt is of de resultaten voldoende te extrapoleren zijn naar Nederlandse patiënten, hoewel deze zorgen niet door de subgroepanalyses ondersteund worden. De behandeling met serplulimab wordt goed verdragen. Het bijwerkingenpatroon is conform andere PD-1-remmers. Het effect van serplulimab bij SCLC-ES is meer uitgesproken dan de eerder door cieBOM beoordeelde PD-L1-remmers die niet aan de PASKWIL-criteria voldoen.1,2
Kosten
De kosten van behandeling met serplulimab zijn nog niet bekend (bron: medicijnkosten.nl d.d. juni 2025).
Conclusie
In de hier besproken ASTRUM-005-studie wordt bij patiënten met SCLC-ES na een follow-upduur van mediaan 12,3 maanden een statistisch significant langere OS gezien na palliatieve behandeling met serplulimab toegevoegd aan standaard chemotherapie (verbetering mediane OS met 4,5 maanden; HR: 0,63 [95%-BI: 0,49-0,82]; p < 0,001). Deze resultaten voldoen aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor een palliatieve behandeling met mediane overleving in de controlegroep ≤ 12 maanden.
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Atezolizumab met chemotherapie als eerstelijns behandeling voor ‘extensive stage’ kleincellig longcarcinoom. Med Oncol 2019;22(8):23-6.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Durvalumab met chemotherapie als eerstelijnsbehandeling voor ‘extensive stage’ kleincellig longcarcinoom. Med Oncol 2022;24(2):27-30.
- Cheng Y, Han L, Wu L et al. Effect of first-line serplulimab vs placebo added to chemotherapy on survival in patients with extensive-stage small cell lung cancer: The ASTRUM-005 randomized clinical trial. JAMA 2022;328(12):1223-32.
- Cheng Y, Han L, Wu L et al. Serplulimab vs. placebo combined with chemotherapy as first-line treatment for extensive-stage small-cell lung cancer: Extended follow-up results and patient-reported outcomes from the international phase 3 ASTRUM-005 study. J Clin Oncol 2024;42(16suppl):8100.