
Inleiding
De incidentie van het oesofaguscarcinoom is in Nederland de laatste jaren fors toegenomen: van 684 diagnoses in 1989 naar ruim 2.700 in 2023.1 Deze stijging betreft vooral adenocarcinomen van de oesofagus. Het aantal plaveiselcelcarcinomen bleef stabiel en betreft thans minder dan 30 procent van het totaal aantal oesofaguscarcinomen. Wereldwijd is ongeveer 90 procent van het totaal aantal oesofaguscarcinomen een plaveiselcelcarcinoom. Bijna de helft van de patiënten met een oesofaguscarcinoom heeft reeds metastasen op afstand bij het stellen van de diagnose. Combinatiebehandeling met een fluoropyrimidine en een platinumderivaat wordt gezien als de standaard eerstelijns behandeloptie voor lokaal uitgebreid of metastaseerde ziekte. In Nederland wordt meestal een combinatiebehandeling met oxaliplatine en capecitabine of 5-FU gegeven. Voor patiënten met een plaveiselcelcarcinoom van de slokdarm met PD-L1-positieve ziekte kan hieraan nivolumab (TPS-score ≥ 1 procent) of pembrolizumab (CPS ≥ 10 procent) worden toegevoegd.2,3 Voor behandeling in de tweede lijn bij het plaveiselcelcarcinoom van de oesofagus heeft EMA nivolumab geregistreerd. In Nederland wordt deze tweedelijns behandeling niet gegeven vanwege de beperkte winst in overleving, namelijk 10,9 versus 8,4 maanden (HR: 0,77), die niet voldeed aan de PASKWIL-criteria voor palliatieve behandeling voor een positief advies.4 Bij ziekteprogressie of intolerantie voor de eerstelijns behandeling wordt op dit moment overgegaan op palliatief ondersteunend beleid of behandeling in studieverband.
Tislelizumab is een volledig humaan immunoglobuline G4 (IgG4) monoklonaal antilichaam gericht tegen de T-cell suppression immune-checkpoint programmed death-1-receptor (PD-1-receptor). In de RATIONALE-302-studie is onderzocht wat de meerwaarde is van behandeling met tislelizumab in vergelijking met paclitaxel of docetaxel of irinotecan naar keuze van de onderzoeker bij patiënten met een irresectabel, lokaal gevorderd of gemetastaseerd plaveiselcelcarcinoom van de oesofagus na eerdere platinumbevattende chemotherapie.5 EMA heeft tislelizumab geregistreerd als monotherapie voor de behandeling van patiënten met een irresectabel, lokaal gevorderd of gemetastaseerd plaveiselcelcarcinoom van de oesofagus na eerdere platinumbevattende chemotherapie, onafhankelijk van de PD-L1-score.
1. Kankersoort en lijn van behandeling
Tweedelijns behandeling met tislelizumab werd onderzocht bij patiënten met een irresectabel, lokaal gevorderd of gemetastaseerd plaveiselcelcarcinoom van de oesofagus na eerdere platinumbevattende chemotherapie.
2. Vergelijking met de referentiebehandeling in Nederland
In de RATIONALE-302-studie wordt palliatieve behandeling met tislelizumab vergeleken met paclitaxel of docetaxel of irinotecan naar keuze van de onderzoeker. In Nederland is voor patiënten met een irresectabel, lokaal gevorderd of gemetastaseerd plaveiselcelcarcinoom van de oesofagus na eerdere platinumbevattende chemotherapie geen standaard tweedelijns therapie beschikbaar en wordt vaak overgegaan op een palliatief ondersteunend beleid of behandeling in studieverband.
3. Methode en kwaliteit van de studie
De RATIONALE-302-studie is een gerandomiseerde fase III-multicenterstudie voor patiënten met een irresectabel, lokaal gevorderd of gemetastaseerd plaveiselcelcarcinoom van de oesofagus na progressie op eerdere platinumbevattende chemotherapie. Patiënten kwamen ook in aanmerking voor studiedeelname als zij tumorprogressie hadden binnen 6 maanden na afronden van definitieve chemoradiotherapie, neoadjuvante of adjuvante chemotherapie. Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1 te hebben.
Patiënten die eerdere anti-PD-1- of PD-L1-behandeling ontvangen hebben, met actieve hersen- of leptomeningeale metastasen, actieve auto-immuunziekte, of tumorinvasie in organen aangrenzend aan het aangedane deel van de oesofagus (bijvoorbeeld aorta of luchtwegen) werden geëxcludeerd. De patiënten konden deelnemen aan de studie ongeacht het PD-L1-expressieniveau van hun tumor. Indien beschikbaar werd retrospectief getest op PD-L1-expressiestatus. Expressie van PD-L1 werd beoordeeld in een centraal laboratorium met behulp van de Ventana PD-L1 (SP263)-assay die aankleuring van PD-L1 herkent op zowel tumorcellen als met de tumorgeassocieerde immuuncellen. Deze manier van PD-L1-scoren is ook wel bekend als de Tumour Area Positivity (TAP)-score en gaat uit van het positieve oppervlakte in plaats van het percentage positieve cellen zoals bij de TPS of CPS.
De patiënten werden gerandomiseerd (1:1) naar elke 3 weken behandeling met tislelizumab 200 mg of intraveneuze chemotherapie naar keuze van de onderzoeker, waarbij gekozen kon worden uit paclitaxel (135 tot 175 mg/m² op dag 1 om de 3 weken of 80 tot 100 mg/m2 wekelijks), docetaxel (75 mg/m2 op dag 1 om de 3 weken), of irinotecan (125 mg/m2 op dag 1 en 8, om de 3 weken). Japanse patiënten kregen een aangepast schema paclitaxel en docetaxel. De behandeling werd gestratificeerd naar geografische regio (Azië [exclusief Japan] versus Japan versus Europa en Noord-Amerika), ECOG-performancestatus (0 versus 1) en de chemotherapiekeus van de onderzoeker (paclitaxel versus docetaxel versus irinotecan). De patiënten werden behandeld tot progressie van de ziekte, beoordeeld door de onderzoeker volgens RECIST 1.1 of tot onaanvaardbare toxiciteit.
Het primaire eindpunt van de studie was overleving (OS) in de intention-to-treat (ITT)-populatie. Secundaire eindpunten waren OS in de PD-L1-positieve analyseset (PD-L1-TAP ≥ 10 procent), responspercentage (ORR), progressievrije overleving (PFS) en duur van de respons (DoR), zoals beoordeeld door de onderzoeker volgens RECIST 1.1. Een CT-scan voor evaluatie werd gedurende de eerste 6 maanden elke 6 weken gemaakt en daarna elke 9 weken. Kwaliteit van leven werd gemeten gebruikmakend van de mondiale scores voor gezondheidsstatus/kwaliteit van leven (GHS/QoL), fysiek functioneren en vermoeidheid van de EORTC QLQ-C30 en de dysfagie-, reflux-, eet- en pijnscores van de EORTC QLQ-OES18 op moment van screening tot en met cyclus 6 of tot stopzetting van de behandeling (afhankelijk van wat zich het eerst voordeed). Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE 4.03. Data over vervolgbehandelingen zijn verzameld in deze studie.
Volgens het ontwerp van de studie waren 400 overlijdens (ofwel 500 patiënten) nodig om met 82 procent power en een eenzijdige alfa van 2,5 procent een hazard ratio (HR) van 0,75 voor overlijden vast te kunnen stellen. Dit komt overeen met een toename in mediane overleving van 6 naar 8 maanden. In een interim-analyse werd niet voorzien. OS van patiënten met TAP PD-L1 ≥ 10 procent werd hiërarchisch getest als het primaire eindpunt positief was met behoud van de tweezijdige alfa van 5 procent.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
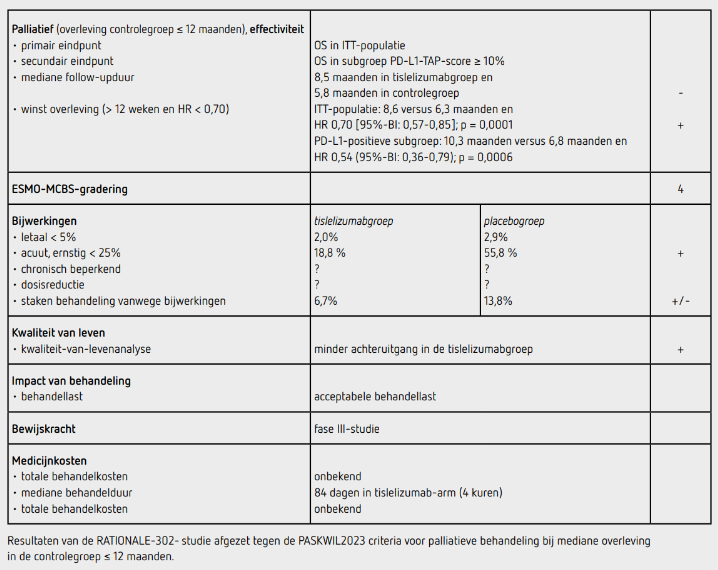
Tussen januari 2018 en maart 2020 werden 512 patiënten geïncludeerd in Azië (404 patiënten [78,9 procent]) en Europa/ Noord-Amerika (108 patiënten [21,1 procent]) en gerandomiseerd naar tislelizumab (n = 256) of chemotherapiekeus van de onderzoeker (n = 256; paclitaxel [n = 85], docetaxel [n = 53] of irinotecan [n = 118]). De mediane follow-up bedroeg 8,5 maanden in de tislelizumabgroep en 5,8 maanden in de controlegroep. De uitgangskarakteristieken in de beide behandelgroepen waren vergelijkbaar: mediane leeftijd 62 jaar; 84 procent was man; 80 procent was Aziatisch; 25 procent had een ECOG-PS van 0 en 75 procent een ECOG-PS van 1. 95 procent van de onderzoekspopulatie had bij aanvang van het onderzoek gemetastaseerde ziekte. Alle patiënten hadden ten minste één voorafgaande chemotherapie tegen kanker gekregen, waarbij dit voor 97 procent van de patiënten een platinumbevattend schema betrof. 157 patiënten (30,7 procent) hadden een PD-L1-TAP-score ≥ 10 procent, 256 (50,0 procent) een PD-L1-TAP-score < 10 procent en hadden 99 (19,3 procent) een onbekende PD-L1-status. Meer patiënten in de tislelizumabgroep hadden een PD-L1-TAP-score ≥ 10 procent dan in de controlegroep (34,8 procent versus 26,6 procent). In de tislelizumabgroep waren op het moment van analyse (cut off-datum 1 december 2020) 197 (77,0 procent) patiënten overleden en 213 (83,2 procent) in de controlegroep.
De OS in de ITT-populatie was statistisch significant beter in de tislelizumabgroep dan in de controlegroep (HR: 0,70 [95%-BI: 0,57-0,85]; p = 0,0001). De mediane OS bedroeg 8,6 maanden (95%-BI: 7,5-10,4) in de tislelizumabgroep en 6,3 maanden (95%-BI: 5,3-7,0) in de controlegroep. De 1-jaars overleving was 37,4 procent in de tislelizumabgroep en 23,7 procent in de controlegroep. Er was geen heterogeniteit in de uitkomst voor de subgroepen. Bij de patiënten met een PD-L1-TAP-score ≥ 10 procent was de HR voor OS 0,54 (95%-BI: 0,36-0,79), met een eenzijdige p-waarde van 0,0006. De mediane overleving was 10,3 maanden (95%-BI: 8,5-16,1 maanden) en 6,8 maanden (95%-BI: 4,1-8,3 maanden) voor respectievelijk de tislelizumabgroep en de controlegroep. In de PD-L1-negatieve subgroep (PD-L1-TAP-score < 10 procent) was de gestratificeerde HR voor OS 0,82 (95%-BI: 0,62-1,09), met een mediane totale overleving van 6,9 maanden (95%-BI: 5,3-8,7 maanden) en 5,8 maanden (95%-BI: 4,9 6,9 maanden) voor respectievelijk de tislelizumabgroep en de controlegroep.
De mediane PFS was 1,6 maanden (95%-BI: 1,4-2,7 maanden) versus 2,1 maanden (95%-BI: 1,5 2,7 maanden) in de tislelizumabgroep en de controlegroep (HR: 0,83 [95%-BI; 0,67-1,01]). De geschatte 1-jaars PFS was 12,7 procent in de tislelizumabgroep en 1,9 procent in de controlegroep. Een objectieve respons werd bereikt in 52 patiënten (20,3 procent) in de tislelizumabgroep versus 25 patiënten (9,8 procent) in de controlegroep. De mediane responsduur was 7,1 maanden in de tislelizumabgroep en 4,0 maanden in de controlegroep. In de tislelizumabgroep kregen 255 van de 256 patiënten (99,6 procent) ten minste 1 gift en in de controlegroep kregen 240 van de 256 patiënten (93,8 procent) ten minste 1 gift chemotherapie. In totaal 48 patiënten (18,8 procent) van de 255 patiënten behandeld met tislelizumab hadden ten minste één gerelateerde bijwerking van graad 3 of hoger en 134 patiënten (55,8 procent) van de patiënten behandeld met chemotherapie.
De meest voorkomende bijwerkingen in de tislelizumabgroep waren een verhoogd aspartaataminotransferase (ASAT; 11,4 procent), anemie (11,0 procent) en hypothyreoïdie (10,2 procent). De meest voorkomende bijwerkingen in de controlegroep waren leukopenie (12,5 procent), neutropenie (12,9 procent), anemie (34,6 procent), verminderde eetlust (31,3 procent), misselijkheid (27,5 procent) en diarree (27,5 procent). In de tislelizumab-arm zijn 5 patiënten (2,0 procent) overleden aan bijwerkingen van de behandeling en in de controlegroep 7 patiënten (2,9 procent). In de tislelizumabgroep moest 6,7 procent van de patiënten stoppen met de behandeling vanwege bijwerkingen en in de controlegroep 13,8 procent.
In de tislelizumabgroep kregen 129 patiënten (50 procent) behandeling na progressie (waarvan immuuntherapie bij 4 procent) en in de controlegroep waren dit 132 patiënten (51 procent), waarvan 55 patiënten (21 procent) immuuntherapie kregen. Vergeleken met chemotherapie hadden tislelizumab behandelde patiënten meer stabiele GHS/QoL- en vermoeidheidsscores, evenals minder achteruitgang in fysiek functioneren. Ook was er een lager risico op verergering van dysfagie (HR: 0,76 [95%-BI: 0,53-1,07], p = 0,0562).
Discussie
In de RATIONALE-302-studie wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt OS van tweedelijns palliatieve behandeling met tislelizumab ten opzichte van de chemotherapie bij patiënten met een irresectabel, lokaal gevorderd of gemetastaseerd plaveiselcelcarcinoom van de slokdarm na eerdere platinumbevattende chemotherapie (HR: 0,70 [95%-BI: 0,57-0,85]; p = 0,0001). De overlevingswinst in de totale ITT-groep is 10 weken, namelijk 8,6 maanden in de tislelizumabgroep ten opzichte van 6,3 maanden in de controlegroep. De resultaten van dit eindpunt voldoen niet aan de PASKWIL2023-criteria voor een positief advies.
De vooraf gedefinieerde PD-L1-positieve subgroep (PD-L1-TAP-score ≥ 10 procent) laat een groter voordeel zien met een OS winst van 15,2 weken (HR: 0,54 [95%-BI: 0,36-0,79]; p = 0,0006). De resultaten van dit eindpunt voldoen wel aan de PASKWIL2023-criteria voor een positief advies voor palliatieve behandeling bij mediane overleving in de controlegroep ≤ 12 maanden. Gezien het werkingsmechanisme van tislelizumab is een beter effect in de PD-L1-positieve subgroep goed te verklaren. Het vaststellen van de TAP PD-L1-score vereist echter wel specifieke training van de patholoog.
Tislelizumab lijkt goed verdragen te worden. De bijwerkingen zijn in lijn met de andere PD-L1-remmers. Kwaliteit van leven-onderzoek ondersteunt deze gegevens waarbij er minder achteruitgang is in kwaliteit van leven, fysiek functioneren en minder kans is op verergering van dysfagie voor patiënten die tislelizumab behandeling krijgen ten opzichte van patiënten die chemotherapie krijgen. 16 patiënten in de controlegroep hebben geen behandeling gekregen. In de tislelizumabgroep was dit slechts één patiënt. De reden hiervan is onbekend. Het kan zijn dat patiënten zich terugtrokken uit de studie vanwege het loten voor de controlegroep. Slechts een beperkt aantal patiënten in de controlegroep kreeg na progressie een vorm van immunotherapie.
Belangrijk is dat de studiepopulatie voor 80 procent bestond uit Aziatische patiënten. Het is daarmee niet zeker dat de resultaten volledig te extrapoleren zijn naar de voornamelijk Kaukasische populatie in Nederland. Er is gezien het werkingsmechanisme en de farmacologische eigenschappen van tislelizumab geen reden om aan te nemen dat er verschil zou zijn in werkzaamheid of bijwerkingen tussen de Aziatische en Kaukasische populatie. In de praktijk zal de groep patiënten die voor tislezilumab in aanmerking komt klein zijn. Het zal zich beperken tot de patiënten met een plaveiselcelcarcinoom van de oesofagus (in Nederland ongeveer 30 procent van de patiënten met slokdarmcarcinoom), die een PD-L1-TAP-score ≥ 10 procent hebben (ongeveer een derde van de patiënten) en niet eerder immunotherapie hebben gehad (inmiddels standaard bij PD-L1-positieve patiënten in de eerste lijn). Daarnaast werd een andere manier van scoring van PD-L1-positiviteit gebruikt in deze studie dan tot nu toe gebruikelijk voor de pathologen in Nederland.
De EMA heeft tislelizumab geregistreerd voor de gehele groep van patiënten met een irresectabel, lokaal gevorderd of gemetastaseerd plaveiselcelcarcinoom van de oesofagus na eerdere platinumbevattende chemotherapie, onafhankelijk van PD-L1-score in de tumor. Belangrijk hier te noemen is dat de PASKWIL-criteria voor een positief advies alleen van toepassing zijn voor de PD-L1-positieve subgroep (PD-L1-TAP-score ≥ 10 procent).
5. Kosten
De kosten van behandeling met tislelizumab zijn nog onbekend. Tislelizumab is in de sluis voor dure geneesmiddelen geplaatst.
Conclusie
In de hier besproken RATIONALE-302-studie wordt bij de subgroep van patiënten met een irresectabel, lokaal gevorderd of gemetastaseerd plaveiselcelcarcinoom van de oesofagus met een PD-L1-positieve tumor (PD-L1-TAP-score ≥ 10 procent) na eerdere platinumbevattende chemotherapie een statistisch significant langere overleving gezien na palliatieve behandeling met tislelizumab dan na chemotherapie (HR: 0,54 [95%-BI: 0,36-0,79]; p = 0,0006). Dit resultaat voldoet aan de criteria voor een positief advies volgens de PASKWIL2023-criteria voor palliatieve behandeling bij een mediane overleving in de controlegroep ≤ 12 maanden. De toepassing zal beperkt zijn omdat bij PD-L1-positieve patiënten immuuntherapie meestal in de eerste lijn wordt gegeven in combinatie met chemotherapie. De prijs voor tislelizumab is nog onbekend.
Referenties
- Nederlandse Kankerregistratie (cijfersoverkanker.nl)
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Nivolumab combinatietherapie als eerstelijnsbehandeling bij het plaveiselcelcarcinoom van de oesofagus. Med Oncol 2022;25(10):42-8.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Pembrolizumab en chemotherapie als eerstelijnsbehandeling van het lokaal irresectabel of gemetastaseerd oesofaguscarcinoom. Med Oncol 2022;25(4):37-42.
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Nivolumab als tweedelijnsbehandeling bij het plaveiselcelcarcinoom van de oesofagus. Med Oncol 2021;24(1):41-4.
- Lin Shen, MD,; Ken Kato,; Sung-Bae Kim, et al. Tislelizumab versus chemotherapy as second-line treatment for advanced or metastatic esophageal squamous cell carcinoma (RATIONALE-302): A randomized phase III study. J Clin Oncol 2022; 40(26): 3065-75.