Inleiding
Resectabele levermetastasen bij patiënten met colorectaal carcinoom worden vaak lokaal behandeld om te trachten curatie te bereiken. Deze lokale behandeling kan bestaan uit metastasectomie of leverresectie, radiofrequente ablatie (RFA), microwave-ablatie (MWA) of stereotactische external beam radiotherapie. Bij succesvolle behandeling wordt in caseseries een 5-jaarsoverleving tot 50 procent gemeld; er zijn echter geen fase III-data beschikbaar.
Bij patiënten met irresectabele colorectale levermetastasen is chemotherapie bestaande uit 5-fluoro-uracil (5-FU) en oxaliplatine of 5-FU en irinotecan, al dan niet gecombineerd met bevacizumab of cetuximab de behandeling van keus.1 Bij een goede respons kan lokale behandeling van de levermetastasen worden overwogen.
Bij patiënten met permanent irresectabele levermetastasen kunnen in salvagesetting selectieve interne radiotherapie (SIRT), ook bekend als radio-embolisatie, en transarteriële chemo-embolisatie (TACE) worden overwogen.2
SIRT is in Europa CE-gemarkeerd, hetgeen betekent dat wordt voldaan aan algemene eisen die betrekking hebben op de technische veiligheid, steriliteit en biocompatibiliteit van het product.3 Voor SIRT is er ook evaluatie van klinische veiligheid verricht. Registratie wordt gecontroleerd door de Inspectie voor de Gezondheidszorg en Jeugd. Op verzoek van behandelaren in het veld heeft de commissie BOM conform haar mandaat ‘…de klinische waarde van nieuwe geregistreerde geneesmiddelen, behandelmethoden en behandelindicaties op het gebied van de medische oncologie te beoordelen…’ deze niet door de EMA geregistreerde behandelmodaliteit beoordeeld. Voor de indicatiestelling van SIRT is een multidisciplinair team, met participatie van ten minste een interventieradioloog, nucleair geneeskundige, internist-oncoloog en leverchirurg nodig.
Bij SIRT kunnen drie verschillende CE-gemarkeerde producten worden gebruikt:
- yttrium-90-harsmicrosferen (SIR-Spheres van Sirtex);
- yttrium-90-glasmicrosferen (TheraSphere van BTG);
- holmium-166-polymelkzuurmicrosferen (QuiremSpheres van Quirem)
De in dit rapport beschreven techniek betreft yttrium-90-harsmicrosferen. Er zijn klinisch relevante verschillen tussen de verschillende producten, onder andere met betrekking tot het aantal microsferen, de specifieke activiteit, het gebruikte isotoop en de gehanteerde activiteitsberekeningen.
Bij de in dit rapport besproken studies bestond SIRT uit een éénmalige toediening van yttrium-90-harsmicrosferen. Hierbij werden SIR-Spheres via een lieskatheter en de arteria hepatica selectief in de kleinere aanvoerende bloedvaten van de levermetastasen gebracht. Na toediening lopen de microsferen vast in de arteriolen en leidt lokale bètaradiatie tot vernietiging van het tumorweefsel.4 De rationale voor intra-arteriële toediening van SIRT is dat metastasen in de lever voor hun bloedvoorziening afhankelijk zijn van de arteria hepatica, terwijl gezond leverweefsel hoofdzakelijk door de vena portae van bloed wordt voorzien. Voorafgaand aan de behandeling wordt een angiografie van de lever verricht om de vasculatuur/perfusie van de lever in kaart te brengen en shunting naar de gastrointestinale circulatie (maag, duodenum en pancreas) uit te sluiten.5 Indien mogelijk worden aangetoonde shunts opgeheven door coiling van de communicerende vaten om depositie van yttrium-90-microsferen buiten de lever te voorkomen. Vervolgens wordt een technetium-99macrogeaggregeerde albuminescan uitgevoerd om te beoordelen of er sprake is van hepatopulmonale shunting.5
De meest voorkomende bijwerking van radio-embolisatie is post(radio-)embolisatiesyndroom, dat meestal mild verloopt en gepaard gaat met buikpijn, misselijkheid, braken, koorts en vermoeidheid (≤ 55 procent). Complicaties die ernstiger kunnen verlopen zijn radiatiegeïnduceerde leverziekte (0-4 procent), galwegcomplicaties (< 10 procent), gastrointestinale ulceratie (< 5 procent), radiatiecholecystitis waarvoor operatie (< 1 procent), radiatiegeïnduceerde pneumonitis (< 1 procent) en portale hypertensie ten gevolge van leverfibrose (zelden).5
De in dit rapport beschreven SIRT-techniek middels yttrium-90-harsmicrosferen wordt momenteel in verschillende Nederlandse centra toegepast in de salvagesetting waarbij er sprake is van leverdominante metastasering en chemotherapierefractaire ziekte.6
1. Kankersoort en lijn van behandeling
In de in deze publicatie besproken gerandomiseerde fase III-multicenterstudies SIRFLOX, FOXFIRE en FOXFIRE-global (alle open label)7-10 wordt de combinatie van 5-FU en oxaliplatine met of zonder bevacizumab of cetuximab, in combinatie met SIRT middels yttrium-90-harsmicrosferen vergeleken met een behandeling bestaande uit 5-FU en oxaliplatine met of zonder bevacizumab of cetuximab zonder SIRT bij patiënten met irresectabele levermetastasen of leverdominante metastasen van colorectaal carcinoom.
2. Vergelijking met de referentiebehandeling in Nederland
De eerstelijns behandeling van patiënten met gemetastaseerd colorectaal carcinoom bestaat in Nederland in het algemeen uit combinatiechemotherapie (met 5-FU en oxaliplatine of 5-FU en irinotecan), vaak in combinatie met bevacizumab, of soms met cetuximab.1
3. Methoden en kwaliteit van de studie
Het betreft drie vergelijkbare gerandomiseerde fase III-multicenterstudies (open label). Deze werden uitgevoerd in respectievelijk 28, 87 en 69 ziekenhuizen wereldwijd met in totaal 1.103 geanalyseerde patiënten, die werden geïncludeerd tussen oktober 2006 en december 2014. In de FOXFIRE-studie kregen patiënten maximaal 12 kuren OxMdG-chemotherapie (oxaliplatin modified de Gramont): oxaliplatine 85 mg/m2, Lleucovorine 175 mg of D,L-leucovorine 350 mg en 5FU 400 mg/m2 gevolgd door 46 uur continue infusie van 5FU 2.400 mg/m2. In SIRFLOX en FOXFIRE-global kregen patiënten mFOLFOX6 (tweewekelijks oxaliplatine 85 mg/m2, leucovorine 200 mg en 5-FU 400 mg/m2 gevolgd door 46 uur continue infusie van 5-FU 2.400 mg/m2) tot progressie. Patiënten in de experimentele arm kregen dezelfde chemotherapie in combinatie met éénmalig SIRT, gegeven op dag 3 of 4 van cyclus 1 of 2.
Cetuximab of bevacizumab (FOXFIRE) of bevacizumab (SIRFLOX en FOXFIRE-global) kon in de controlearm aan de chemotherapie worden toegevoegd vanaf kuur 1. In de experimentele arm werd oxaliplatine in de eerste drie kuren gegeven in een gereduceerde dosis van 60 mg/m2 en werd cetuximab of bevacizumab vanaf kuur 4 aan de chemotherapie toegevoegd om het risico op bijkomende toxiciteit van in het maag-darmstelsel terechtgekomen yttrium-90-harsmicrosferen te minimaliseren. Inzet en dosis van cetuximab of bevacizumab werd aan de individuele onderzoeker gelaten.
Inclusiecriteria voor de drie studies waren vergelijkbaar, maar niet volledig identiek: alle patiënten waren 18 jaar of ouder en hadden een WHO-performancestatus 0-1. Zij hadden bewezen adenocarcinoom van colon of rectum en bewezen levermetastasen. Deze levermetastasen moesten irresectabel zijn en meetbaar middels CT. De primaire tumor mocht in situ zijn. Extrahepatische ziekte was toegestaan in de long (minder dan 5 laesies < 1 cm diameter of een enkele metastase < 1,7 cm) of lymfeklieren (metastasen op 1 locatie < 2 cm diameter) (SIRFLOX en FOXFIRE-global). Maximaal 5 longmetastasen en één gebied van andere extrahepatische metastasen (bijvoorbeeld één of meerdere lymfekliermetastasen in één anatomische regio) waren toegestaan na centrale beoordeling van het studieteam opdat deze in de toekomst voor in opzet curatieve lokale behandeling in aanmerking zouden kunnen komen (FOXFIRE). Patiënten mochten geen eerdere chemotherapie voor gemetastaseerde ziekte hebben gehad. Adjuvante of neo-adjuvante chemoradiatie (bij rectumcarcinomen) was toegestaan mits minimaal 6 maanden voor randomisatie beëindigd. Er moest sprake zijn van adequate nierfunctie, leverenzymen en bloedbeeld. Er mocht geen sprake zijn van neuropathie > graad 1, ascites, cirrose, portale hypertensie, tumoringroei in de vena portae of trombose van de vena portae. Voorafgaande radiotherapie op abdomen, lumbale wervelkolom of lever was niet toegestaan.
De randomisatie (1:1) was gestratificeerd voor aanwezigheid van extrahepatische metastasen, voor de hoeveelheid door tumor aangedaan leverweefsel (minder of meer dan 25 procent, gemeten op de baseline CT-scan), voorgenomen gebruik van bevacizumab of cetuximab, en deelnemend centrum.
In FOXFIRE en FOXFIRE-global was het primaire eindpunt totale overleving (OS). Secundair eindpunt was progressievrije overleving (PFS). Bij SIRFLOX was het primaire eindpunt PFS op alle plaatsen; OS was één van de secundaire eindpunten. PFS werd bepaald door centrale onafhankelijke en geblindeerde beoordeling, door 2 onafhankelijke radiologen of, bij discrepantie, door een derde radioloog (FOXFIRE en SIRFLOX). PFS werd niet centraal bepaald in de FOXFIRE-global. Secundaire eindpunten in alle drie studies waren: PFS in de lever, tumorrespons in de lever, tumorrespons op alle plaatsen, aantal uitgevoerde leverresecties, tijd tot lever- en extrahepatische ziekteterugkeer, kwaliteit van leven (niet in deze publicaties), bijwerkingen en veiligheid (volgens CTCAE 3.0).
Beeldvorming middels CT-scan vond plaats < 28 dagen voor randomisatie en vervolgens iedere 8 weken (FOXFIRE) of 12 weken (FOXFIRE-global en SIRFLOX), inclusief beoordeling op resectabiliteit van de levermetastasen. Responsevaluatie vond plaats volgens RECIST 1.0. Progressie werd gecategoriseerd als intrahepatisch of extrahepatisch, en of het een nieuwe laesie betrof of groei van een bestaande laesie, of beide.
Voor het in dit rapport primair gerapporteerde eindpunt, OS, werd een aantal van 1.075 patiënten (710 overlijdens) berekend met een HR van 0,8 bij een verwachte mediane OS in de controlearm van 19,7 maanden en in de SIRT-arm van 24,6 maanden. Hierbij werd gerekend met een tweezijdige alfa van 5 procent, 80 procent power en 5 procent noncompliance. Met de studie kon tevens met een power van 80 procent een verschil van 6 maanden OS worden aangetoond bij patiënten zonder extrahepatische metastasen, waarvoor 708 patiënten (463 overlijdens) benodigd waren. Veiligheidsdata werden gebaseerd op alle patiënten die minimaal 1 cyclus chemotherapie ondergingen, tot 28 dagen na einde behandeling of 7 maanden na randomisatie.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van behandeling
Er werden 549 patiënten in de controlearm behandeld en 554 patiënten in de SIRT-arm. In de SIRT-arm kregen 47 patiënten (8 procent) deze behandeling niet. Redenen hiervoor waren verslechterde performance, serious adverse events of ziekteprogressie voor start van behandeling, weigering van de toegewezen behandeling, afwijkende vasculaire anatomie of complicaties ten tijde van de SIRT-procedure. In alle drie de studies was de minimale follow-up 2 jaar na inclusie van de laatste patiënt. De mediane follow-up was 43,3 maanden (interkwartielrange [IQR]: 31,6-58,4 maanden).
In de SIRFLOX-studie vond SIRT-behandeling plaats mediaan 20 dagen na randomisatie (range: 8-76 dagen) en de mediaan toegediende activiteit was 1,4 GBq (0,4-3,1). Van 246 in de SIRFLOXstudie behandelde patiënten werd SIRT bij 227 patiënten (92,3 procent) toegepast in beide leverlobben. Deze data zijn voor de andere twee studies niet gedetailleerd voorhanden.
Er waren geen significante verschillen in patiëntkarakteristieken in beide studiearmen. De mediane leeftijd was 63 jaar en ongeveer twee derde was man. Ongeveer 35 procent van de patiënten had extrahepatische ziekte en bij ongeveer de helft van de patiënten was de primaire tumor in situ. In totaal 87 procent van de patiënten had synchrone metastasen, en bij ongeveer 32 procent van de patiënten was meer dan 25 procent van de lever aangedaan door tumorweefsel (gemeten op de baseline-CT-scan).
De protocollaire chemotherapiedosering tijdens de eerste 12 kuren werd gegeven bij 59 procent van de patiënten in de SIRT-arm en 68 procent van de patiënten in de controlearm (in de SIRT-arm bedroeg de oxaliplatinedosis in de eerste 3 kuren 60 mg/m2). Het mediane aantal FOLFOX-kuren was 12 (IQR: 7-13) in de SIRT-arm en 12 (IQR: 7-15) in de controlearm. Bevacizumab werd in de controlearm gegeven aan 256 van de 549 patiënten (47 procent) en in de SIRT-arm aan 197 van de 554 patiënten (36 procent). In de FOXIFIRE-studie werd cetuximab gegeven aan 9 (controlearm) en 4 (SIRT-arm) patiënten (4 procent van de patiënten in die studie van 364 patiënten).
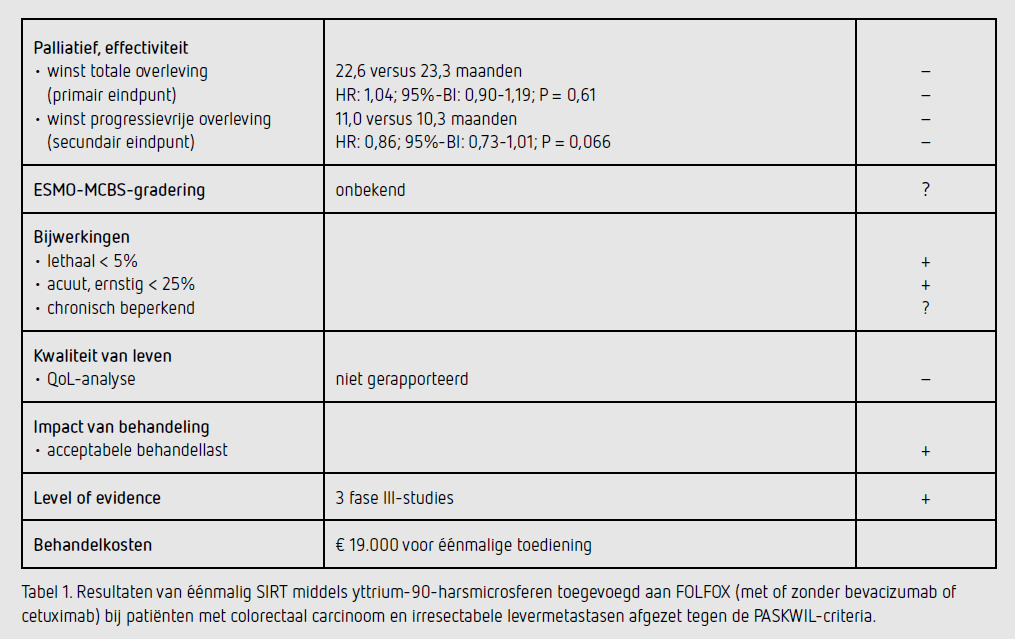
Het primaire eindpunt van deze studie, mediane OS, bedroeg 22,6 maanden (95%-BI: 21,0-24,5) in de SIRT-arm en 23,3 maanden (95%-BI: 21,8-24,7) in de controlearm (HR: 1,04; 95%-BI: 0,90-1,19, P =0,61). Er was geen verschil in mediane OS tussen patiënten met alleen levermetastasen: 24,5 maanden (95%-BI: 22,3-26,3) in de SIRT-arm (355 patiënten) en 24,6 maanden (95%-BI: 22,1-26,4) in de controlearm (358 patiënten) (HR: 1,00; 95%-BI: 0,85-1,19; P = 0,96). In analyse van de diverse subgroepen (> 25 procent door tumor aangedaan leverweefsel, leeftijd, geslacht, primaire tumor in situ, WHO-performancestatus, bevacizumab-gebruik en synchrone of metachrone metastasen) was er geen verschil in OS tussen de beide behandelarmen. Wel werd in de kleine subgroep van patiënten met een rechtszijdige tumor (SIRT-arm 98 patiënten, controlearm 81 patiënten) een HR voor overlijden gevonden van 0,67 in het voordeel van SIRT (post-hocanalyse).
De mediane PFS was niet verschillend tussen de beide behandelarmen en bedroeg 11,0 maanden (95%-BI: 10,211,8) in de SIRTarm en 10,3 maanden (95%-BI: 9,7-10,9) in de controlearm (HR: 0,90; 95%-BI: 0,79-1,02; P = 0,11). De PFS in de groep patiënten met alleen levermetastasen was ook vergelijkbaar tussen de beide behandelarmen: 11,9 maanden (95%-BI: 11,0-13,8) in de SIRT-arm en 11,1 maanden (95%-BI: 10,0-12,1) in de controlearm (HR: 0,86; 95%-BI: 0,73-1,01; P = 0,066). Er was ook geen verschil in PFS voor de subgroep van patiënten van wie de CT-scans centraal werden beoordeeld.
De cumulatieve incidentie van eerste progressie in de lever was lager in de SIRT-arm dan in de controlearm: 12 maanden cumulatieve leverprogressie bedroeg 22 procent in de SIRT-arm (95%-BI: 19-26) en 39 procent in de controlearm (95%BI: 35-43). Daarentegen was de cumulatieve incidentie van progressie buiten de lever en overlijden voorafgaand aan radiologische progressie binnen 12 maanden follow-up lager in de controlearm: de 12 maanden cumulatieve incidentie van extrahepatische progressie bedroeg 19 procent in de controlearm (95%-BI: 16-23) en 33 procent in de SIRT-arm (95%-BI: 29-37).
Een objectieve (complete of partiële) respons trad op bij 72 procent van de patiënten in de SIRT-arm en bij 63 procent van de patiënten in de controlearm (pooled OR: 1,52; 95%BI: 1,18-1,96; P = 0,0012). Ook in de lever was de responskans hoger voor patiënten in de SIRT-arm (70,380,2 procent) dan voor patiënten in de controlearm (61,568,5 procent) (pooled OR: 1,78; 95%-BI: 1,37-2,31; P < 0,0001). Het aantal patiënten dat resectabele levermetastasen kreeg was niet verschillend in beide groepen: 17 procent (94 patiënten) in de SIRT-arm en 16 procent (88 patiënten) in de controlearm onderging een resectie (pooled OR: 1,07; 95%-BI: 0,78-1,48; P = 0,67).
Bijwerkingen graad > 3 traden op bij 74 procent van de patiënten in de SIRT-arm en bij 67 procent van de patiënten in de controlearm. Graad > 3 hematologische bijwerkingen (neutropenie, trombopenie, neutropene koorts en leukopenie) kwamen significant vaker voor bij patiënten in de SIRT-arm dan bij patiënten in de controlearm (46 versus 29 procent); neutropenie (37 versus 24 procent). In de SIRT-arm was tevens vaker sprake van graad > 3 vermoeidheid (8 versus 5 procent), buikpijn (6 versus 2 procent) en longembolie (6 versus 4 procent). Graad ≥ 3 perifere neuropathie was meer frequent in de controlearm (6 versus 4 procent).
Specifieke SIRT-gerelateerde graad ≥ 3 bijwerkingen traden 30 keer op bij patiënten in de SIRT-arm en 10 keer bij patiënten in de controlearm. Dit waren maag/duodenum ulcera, ascites, leverfalen, radiatiehepatitis, hyperbilirubinemie, pancreatitis, hepatische encefalopathie, portale hypertensie, acute cholecystitis en perihepatisch abces; al deze complicaties traden op bij 1 tot 6 patiënten (< 1-1 procent). Er overleden in de SIRT-arm 10 patiënten en in de controlearm 11 patiënten als gevolg van een adverse event, waarvan 8 in de SIRT-arm en 3 in de controlearm gerelateerd waren aan de behandeling. Van de patiënten in de SIRT-arm die overleden was dat bij 3 patiënten het gevolg van radiatiegeïnduceerde leverschade. Daarnaast overleden 2 patiënten door complicaties na chirurgie, 1 patiënt door leverfalen, 1 patiënt door medicamenteuze pneumonitis en 1 patiënt door toediening van SIRT-microsferen buiten de lever. In de controlearm overleden 3 patiënten door respectievelijk chirurgische complicaties, neutropene sepsis en darmperforatie. In de periode na het veiligheidswindow (later dan de 28 dagen na einde studiebehandeling of 7 maanden na randomisatie) overleden nog 2 patiënten in de SIRT-arm aan levergerelateerde bijwerkingen (leverfalen en ascites).
Discussie
Deze gepoolde analyse van drie gerandomiseerde studies uitgevoerd bij meer dan 1.000 patiënten met irresectabele levermetastasen van colorectaal carcinoom toont aan dat de toevoeging van SIRT middels yttrium-90-harsmicrosferen aan eerstelijns palliatieve chemotherapie bestaande uit combinatiechemotherapie met 5-FU/leucovorine en oxaliplatine al dan niet in combinatie met bevacizumab (of cetuximab) niet leidt tot een toename van het primaire eindpunt OS. Ook PFS is niet verschillend. Deze resultaten voldoen niet aan de PASKWIL-criteria voor een positief advies. Er is wel een voordeel voor SIRT in tot de lever beperkte PFS en respons ín alleen de lever zonder dat dit leidt tot een hogere kans op resectabiliteit.
In de in dit rapport beschreven studies zijn niet alleen dosisaanpassingen gedaan ten aanzien van systemische behandeling, maar ook ten aanzien van de toegediende activiteit yttrium-90-harsmicrosferen. De dosisreductie was gebaseerd op een combinatie van longshunt en tumorload.11 Daarbij dient te worden aangemerkt dat voorafgaand aan deze studie wel een dosisescalatiestudie plaatsvond van oxaliplatine, maar niet van yttrium-90-harsmicrosferen. De toegediende mediane activiteit van 1,4 GBq is in vergelijking met gepubliceerde data laag te noemen. Dit heeft mogelijk geleid tot onderdosering. Dosimetriestudies zullen hierop antwoord moeten geven.
De frequentie van ernstige bijwerkingen is bij combinatie van SIRT middels yttrium-90-harsmicrosferen en chemotherapie hoger dan bij chemotherapie alleen (74 versus 67 procent). Vooral hematologische toxiciteit treedt vaker op bij de combinatiebehandeling. Bij 7 procent van de patiënten treden ernstige (graad ≥ 3) SIRT-gerelateerde bijwerkingen op. De salvagebehandeling van patiënten met chemotherapierefractaire ziekte met voornamelijk levermetastasen is niet het onderwerp van deze drie studies en dit rapport.
5. Kosten
De kosten voor een eenmalige behandeling met SIRT middels yttrium-90-harsmicrosferen bedragen ongeveer 19.000 euro (bron: rapport Zorginstituut Nederland).6
Conclusie
Bij patiënten met irresectabele levermetastasen van colorectaal carcinoom die eerstelijns behandeling met 5-FU en oxaliplatine (met of zonder bevacizumab of cetuximab) krijgen, leidt toevoegen van een eenmalige behandeling met SIRT middels yttrium-90-harsmicrosferen niet tot een verlenging van het primaire eindpunt mediane OS (22,6 versus 23,3 maanden; HR voor overlijden: 1,04; 95%-BI: 0,90-1,19; P = 0,61). Deze resultaten voldoen niet aan de PASKWIL-criteria voor een positief advies.
Referenties
- Landelijke richtlijn Colorectaal carcinoom (versie 3.0). Landelijke Werkgroep Gastrointestinale Tumoren, 16 april 2014 (www.oncoline.nl/colorectaalcarcinoom).
- Fiorentini G, Aliberti C, Tilli M, et al. Intra-arterial infusion of irinotecan-loaded drugeluting beads (DEBIRI) versus intravenous therapy (FOLFIRI) for hepatic metastases from colorectal cancer: final results of a phase III study. Anticancer Res 2012;32(4):1387-95.
- EU-richtlijn medische hulpmiddelen 93/42/EEG (eur-lex.europa.eu).
- Nace GW, Steel JL, Amesur N, et al. Yttrium-90 radioembolization for colorectal cancer liver metastases: a single institution experience. nt J Surg Oncol 2011;2011:571261.
- Whitney R, Tatum C, Hahl M, et al. Safety of hepatic resection in metastatic disease to the liver after yttrium-90 therapy. J Surg Res 2011;166(2):23640.
- Yttrium-90 radioembolisatie bij colorectale levermetastasen. Zorginstituut Nederland, 18 februari 2016 (www.zorginstituutnederland.nl).
- Van Hazel GA, Heinemann V, Sharma NK, et al. SIRFLOX: randomized phase III trial comparing first-line mFOLFOX6 (plus or minus Bevacizumab) versus mFOLFOX6 (plus or minus Bevacizumab) plus selective internal radiation therapy in patients with metastatic colorectal cancer. J Clin Oncol 2016;34(15):1723-31.
- Sharma RA, Wasan HS, Love SB, et al; FOXFIRE Trial Management Group. FOXFIRE: a phase III clinical trial of chemoradio-embolisation as first-line treatment of liver metastases in patients with colorectal cancer. Clin Oncol (R Coll Radiol) 2008;20(3):261-3.
- Wasan HS, Gibbs P, Sharma NK, et al; FOXFIRE trial investigators; SIRFLOX trial investigators; FOXFIRE-Global trial investigators. First-line selective internal radiotherapy plus chemotherapy versus chemotherapy alone in patients with liver metastases from colorectal cancer (FOXFIRE, SIRFLOX, and FOXFIRE-Global): a combined analysis of three multicentre, randomised, phase 3 trials. Lancet Oncol 2017;18(9):1159-71.
- Virdee PS, Moschandreas J, Gebski V, et al. Protocol for combined analysis of FOXFIRE, SIRFLOX, and FOXFIRE-Global randomized phase III trials of chemotherapy +/- selective internal radiation therapy as first-line treatment for patients with metastatic colorectal cancer. JMIR Res Protoc 2017;6(3):e43.
- Gibbs P, Gebski V, Van Buskirk M, et al; SIRFLOX Study Group. Selective Internal Radiation Therapy (SIRT) with yttrium-90 resin microspheres plus standard systemic chemotherapy regimen of FOLFOX versus FOLFOX alone as first-line treatment of nonresectable liver metastases from colorectal cancer: the SIRFLOX study. BMC Cancer 2014;14:897.