
Inleiding
Van de lokaal irresectabele en gemetastaseerde mammacarcinomen heeft ongeveer 20 procent een overexpressie van de human epidermal growth factor receptor 2 (HER2). Deze eigenschap heeft geleid tot de introductie van specifieke HER2-gerichte middelen (trastuzumab, pertuzumab, lapatinib, tucatinib) en antilichaam-geneesmiddelconjugaten (ADC) bestaande uit een HER2-gericht antilichaam en een cytostaticum (trastuzumab-emtansine, trastuzumab-deruxtecan), die de prognose van deze ziekte sterk hebben verbeterd. In ten minste 45 procent van de mammacarcinomen is sprake van een laag HER2-expressieprofiel (HER2-low), gedefinieerd als een immunohistochemische expressiescore (IHC) van 1+ of 2+ in combinatie met een negatieve in-situhybridisatietest (ISH).
Trastuzumab-deruxtecan (TDXd) is een ADC bestaande uit een monoclonaal gehumaniseerd IgG1-antilichaam, dat specifiek bindt aan HER2, en de topo-isomeraseremmer deruxtecan. De permeabiliteit van kankercellen voor deruxtecan is hoog; preklinisch onderzoek heeft getoond dat T-DXd zowel kankercellen met HER2-expressie doodt als nabijgelegen HER2 negatieve kankercellen. T-DXd is werkzaam bij patiënten met een gemetastaseerd HER2-positief mammacarcinoom, resulterend in een positief cieBOM-advies.1 Een fase Ib- en een fase II-onderzoek hebben aangetoond dat behandeling met T-DXd van patiënten met een lokaal irresectabel of gemetastaseerd mammacarcinoom met een laag HER2-expressieprofiel resulteert in een responspercentage van 37 procent.2,3 Deze bevindingen waren de aanleiding om de behandeling met T-DXd in een fase III-studie te vergelijken met reguliere systemische behandeling.
EMA heeft T-DXd geregistreerd voor behandeling van patiënten met een irresectabel of gemetastaseerd mammacarcinoom met een laag HER2-expressieprofiel die eerder behandeld zijn in de gemetastaseerde setting of die metastasen ontwikkelden binnen 6 maanden na het afronden van adjuvante chemotherapie.
1. Kankersoort en lijn van behandeling
T-DXd werd onderzocht bij patiënten met een irresectabel of gemetastaseerd hormoontherapierefractair mammacarcinoom met een laag HER2-expressieprofiel die 1 of 2 eerdere lijnen chemotherapie hadden gehad.4
2. Vergelijking met de referentiebehandeling in Nederland
In de controlegroep van de studie kon worden gekozen tussen behandeling met eribuline, capecitabine, gemcitabine, nab-paclitaxel of paclitaxel. In de Nederlandse situatie wordt in de tweede lijn meestal capecitabine of paclitaxel toegepast en in derde lijn bijvoorbeeld eribuline, vinorelbine of eventueel gemcitabine. Nab-paclitaxel is in Nederland niet beschikbaar voor de behandeling van het mammacarcinoom. Hiermee is de referentiebehandeling in de studie grotendeels vergelijkbaar met de Nederlandse situatie.
3. Methode en kwaliteit van de studie
De DESTINY-Breast04-studie is een multicenter, open label, gerandomiseerde fase III-studie voor patiënten met een lokaal irresectabel of gemetastaseerd mammacarcinoom met een laag HER2-expressieprofiel (IHC1+ of IHC 2+ met negatieve ISH), die ten minste 1 en ten hoogste 2 eerdere lijnen chemotherapie voor gemetastaseerde ziekte hebben gehad.4 Het ontwikkelen van een recidief binnen 6 maanden na afronden van adjuvante chemotherapie gold als 1 behandellijn. Patiënten moesten ouder zijn dan 18 jaar en een ECOG-performancestatus van 0 of 1 hebben.
De linkerventrikel-ejectiefractie moest ten minste 50 procent bedragen. Zowel patiënten met een hormoonreceptor-negatief (HR-) als patiënten met een hormoonreceptor-positief (HR+) mammacarcinoom, gedefinieerd als minimaal 1 procent oestrogeenreceptor- of progesteronreceptoraankleuring volgens ASCO-CAP mochten worden geïncludeerd. Patiënten met een HR+ mammacarcinoom moesten refractair zijn voor endocriene therapie, gedefinieerd als voorbehandeling met ten minste 1 lijn endocriene therapie en geen verwacht effect van verdere endocriene therapie. Hersenmetastasering was toegestaan, mits asymptomatisch. Interstitiële longziekte was een exclusiecriterium. Ten minste 1 metastase moest meetbaar zijn volgens RECIST 1.1.
Het primaire eindpunt van de studie was progressievrije overleving (PFS) in het cohort van patiënten met een HR+-mammacarcinoom. Secundaire eindpunten waren PFS in de totale populatie en overleving (OS) in het HR+-cohort en in de totale populatie. Kwaliteit van leven en ernstige bijwerkingen waren exploratieve eindpunten.
Van elke patiënt werd een nieuw tumorbiopt verkregen om de HER2-status te bepalen. Bij baseline en vervolgens elke 6 weken werd een CT- of MRI-scan van thorax en abdomen verricht. Bij baseline werd ook een CT- of MRI-scan van de hersenen verricht. Een echo cor of MUGA-scan werd bij baseline gemaakt en vervolgens elke 12 weken. Ook werd de hepatitis B- en hiv-status bij baseline bepaald. De bijwerkingen werden bijgehouden volgens de CTC-AE 5.0. Kwaliteit van leven werd gemeten met de EORTC QLQ-C30, QLQ-BR45 en de EQ-5D-5L.
Patiënten werden 2:1 gerandomiseerd tussen behandeling met T-DXd 5,4 mg/kg elke 3 weken intraveneus toegediend en chemotherapie naar keuze van de behandelend arts (controlegroep). Randomisatie werd gestratificeerd naar HER2-expressieprofiel (IHC1+ versus IHC2+ en ISH negatief), het aantal eerdere lijnen chemotherapie (1 versus 2) en hormoonreceptorstatus (positief [met versus zonder eerdere behandeling met een CDK4/6-remmer] versus negatief). Volgens het ontwerp van de studie waren 318 events (overlijdens of ziekteprogressie) nodig voor 90 procent power om een PFS-verschil aan te tonen als de hazard ratio (HR) 0,68 is met een tweezijdige alfa van 5 procent. Daartoe zouden volgens het design 480 HR+ patiënten moeten worden gerandomiseerd.
Daarnaast werd besloten om ongeveer 60 patiënten met een HR-mammacarcinoom toe te laten voor inclusie en de inclusie daarna te beperken tot patiënten met een HR+ mammacarcinoom. In het HR+-cohort werd het aantal patiënten dat geen eerdere CDK4/6-remmer heeft gehad beperkt tot 240 patiënten. Als het primaire eindpunt positief was werd eerst PFS in de totale populatie en daarna OS in het HR+-cohort en OS in de totale populatie hiërarchisch getest. Er was voorzien in 2 interim-analyses voor OS, namelijk op het moment van de primaire analyse van PFS (het was de verwachting dat op dat moment 162 patiënten overleden zouden zijn in het HR+-cohort [alfa 0,001] en bij 233 overlijdens in het HR+-cohort [alfa 0,007]).
Voor de finale OS-analyse bleef een alfa van 0,023 over. In dit rapport worden de resultaten van de primaire PFS-analyse en de eerste OS-interim-analyse vermeld, waarbij de grens voor statistische significatie van OS 0,0075 bedraagt op basis van het aantal geobserveerde overlijdens.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en de impact van de behandeling
Tussen 27 december 2018 en 31 december 2021 werden 713 patiënten gescreend en 557 patiënten geïncludeerd in 161 ziekenhuizen en 19 landen, van wie 494 een HR+ mammacarcinoom hadden. 373 patiënten (331 HR+, 42 HR-) werden gerandomiseerd voor de T-DXd-groep en 184 (163 HR+, 21 HR-) patiënten voor de controlegroep. In de controlegroep werd het merendeel (51,1 procent) behandeld met eribuline, gevolgd door capecitabine (20,1 procent), nab-paclitaxel (10,3 procent), gemcitabine (10,3 procent) en paclitaxel (8,2 procent). De uitgangskarakteristieken van de T-DXd-groep en de controlegroep kwamen goed overeen. De gemiddelde leeftijd was 56 jaar en ongeveer 38 procent was afkomstig uit Azië. De verdeling tussen lokaal irresectabel mammacarcinoom en gemetastaseerd mammacarcinoom werd niet vermeld. 5 procent van de patiënten had asymptomatische hersenmetastasen. In het HR+-cohort had 70 procent eerder behandeling met een CDK4/6-remmer gehad. Ongeveer een derde van de patiënten had 1 of 2 lijnen behandeling gehad voor inclusie.
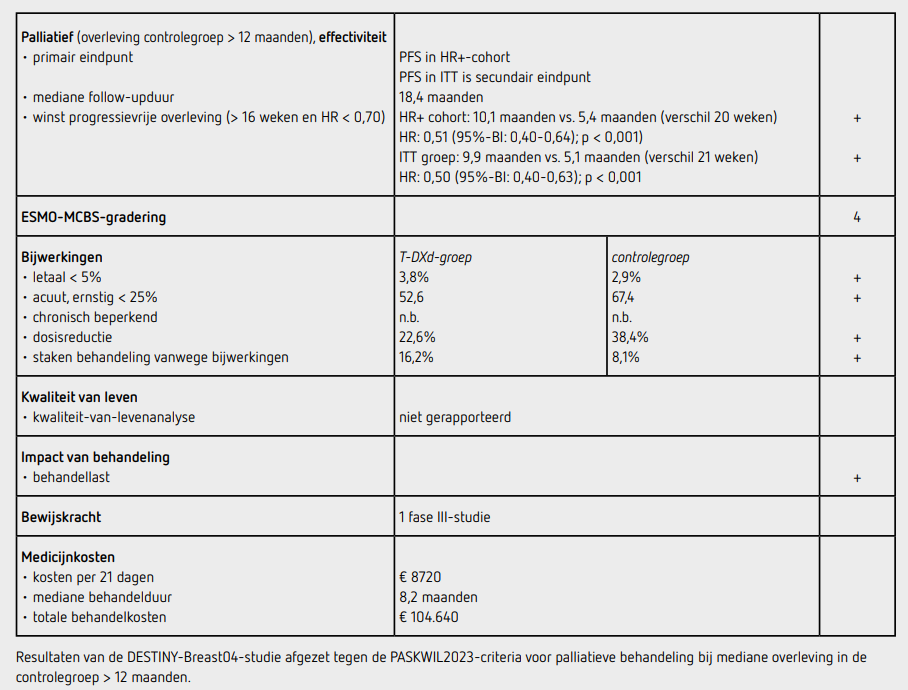
Ten tijde van de data-cutoff was de mediane follow-upduur 18,4 maanden. Er waren 321 patiënten met progressie of overlijden, 211 (64 procent) in de T-DXd-groep en 110 (67 procent) in de controlegroep. Het aantal overlijdens werd niet gerapporteerd. De mediane PFS in het HR+-cohort was 10,1 maanden (95%-BI: 9,5-11,5) in de T-DXd-groep en 5,4 maanden (95%-BI: 4,4-7,1) in de controlegroep met een HR van 0,51 (95%-BI: 0,40-0,64; p < 0,001). De mediane PFS in de totale populatie bedroeg 9,9 maanden (95%-BI: 9,0-11,3 maanden) in de T-DXd-groep en 5,1 maanden (95%-BI: 4,2-6,8 maanden) in de controlegroep met een HR van 0,50 (95%-BI: 0,40-0,63, p < 0,001). De mediane behandelduur was 8,2 maanden (95%-BI: 0,2-39,1) in de T-DXd-groep en 3,5 maanden (95%-BI: 0,3-19,7 maanden) in de controlegroep. Het responspercentage in het HR+-cohort bedroeg 52,6 procent (95%-BI: 47,0-58,0) in de T-DXd-groep en 16,3 procent (95%-BI: 11,0-22,8) in de controlegroep.
Bij patiënten in het HR+-cohort bedroeg de mediane OS 23,9 maanden (95%-BI 20,8-24,8) in de T-DXd-groep en 17,5 maanden (95%-BI: 15,2-22,4) in de controlegroep met een HR van 0,64 (95%-BI: 0,48-0,96; p = 0,003). Voor de totale patiëntenpopulatie bedroeg de mediane OS 23,4 maanden (95%-BI: 20,0-24,8) in de T-DXd-groep en 16,8 maanden (95%-BI: 14,5-20,0) in de controlegroep met een HR van 0,64 (95%-BI: 0,49-0,84; p = 0,001).
Bijwerkingen van graad 3 of hoger kwamen voor bij 52,6 procent van de patiënten in de T-DXd-groep en 67,4 procent van de patiënten in de controlegroep. De meest voorkomende bijwerking van graad 3 of hoger was neutropenie, bij 13,7 procent in de T-DXd-groep en 40,7 procent in de controlegroep. Dosisreductie was nodig bij 22,6 procent van de patiënten in de T-DXd-groep en 38,4 procent van de patiënten in de controlegroep, waarbij misselijkheid de meest voorkomende reden was in de T-DXd-groep en neutropenie in de controlegroep. Bij 16,2 procent van de patiënten in de T-DXd-groep en 8,1 procent van de patiënten in de controlegroep moest de behandeling worden gestaakt vanwege bijwerkingen. Er waren 14 (3,8 procent) patiënten overleden aan de behandeling in de T-DXd-groep en 5 (2,9 procent) in de controlegroep. In de T-DXd-groep ontwikkelden 45 patiënten interstitiële longziekte/ pneumonitis, waarvan 3 met dodelijke afloop.
Tijdens het ESMO-congres in oktober 2023 werd een update van de PFS, OS en veiligheidsdata na een mediane follow-upduur van 32 maanden gepresenteerd. Deze resultaten waren in lijn met de resultaten van de primaire analyse.5
5. Discussie
In de DESTINY-Breast04-studie werd behandeling met T-DXd in de tweede en derde lijn van het lokaal irresectabele of gemetastaseerde mammacarcinoom met een laag HER2-expressieprofiel vergeleken met chemotherapie. Na een mediane follow-upduur van 18,4 maanden bedroeg de winst in mediane PFS in het HR+-cohort 4,7 maanden (HR: 0,51 [95%-BI: 0,40-0,64]; p < 0,001) en de winst in mediane OS 6,4 maanden (HR: 0,64 [95%-BI: 0,48-0,96]; p = 0,003). De toename in PFS voldoet aan de PASKWIL2023-criteria voor een positief advies bij palliatieve behandeling bij een mediane overleving in de controlegroep van meer dan 12 maanden.
Daarnaast was het secundaire eindpunt OS ook beter voor de patiënten behandeld met T-DXd. In de studie was het HR-cohort klein, maar er lijkt geen evident verschil in uitkomst te zijn tussen HR+ en HR- patiënten. EMA heeft dan ook goedkeuring verleend voor alle tumoren met een laag HER2-expressieprofiel, onafhankelijk van de HR-status. Op dit moment wordt niet standaard de HER2-expressiestatus gerapporteerd, anders dan wel of geen overexpressie. Bij toepassing van T-DXd bij tumoren met een laag HER2-expressieprofiel zal hier aandacht voor moeten komen in de verslaglegging van het weefselonderzoek.
Er zijn op dit moment veel behandelmogelijkheden voor het gemetastaseerde mammacarcinoom. De tijd zal uitwijzen welke positie T-DXd krijgt binnen de systemische behandelmogelijkheden voor het lokaal irresectabele en gemetastaseerde HR+ en HR- mammacarcinoom met een laag HER2-expressieprofiel. De kosten van deze behandeling zijn erg hoog.
6. Kosten
De behandeling met T-DXd 5,4 mg per kg kost 8720 euro per 21 dagen, bij een gewicht van 80 kg uitgaande van 500 mg (bron: medicijnkosten.nl d.d. september 2024). Bij een mediane behandelduur van 8,2 maanden komt de prijs per behandeling neer op 104.640 euro voor deze behandeling.
7. Conclusie
De resultaten van de DESTINY-Breast04-studie tonen aan dat behandeling met T-DXd in de tweede of derde lijn bij patiënten met een lokaal irresectabel of gemetastaseerd mammacarcinoom en een laag HER2-expressieprofiel in vergelijking met chemotherapie leidt tot een winst in PFS die voldoet aan de PASKWIL2023-criteria voor een positief advies bij palliatieve behandeling bij een mediane overleving in de controlegroep van meer dan 12 maanden. Ook de OS was langer voor patiënten behandeld met T-DXd.
Referenties
- NVMO-commissie ter Beoordeling van Oncologische Middelen (BOM). Trastuzumab-deruxtecan bij het irresectabel of gemetastaseerd HER2-positief mammacarcinoom. Med Oncol 2022;25(9):42-6
- Modi S, Park H, Murthy RK, et al. Antitumor activity and safety of trastuzumab deruxtecan in patients with HER2 low expressing advanced breast cancer: results from a phase Ib study. J Clin Oncol 2020;38:1887-96.
- Diera V, Deluche E, Lusque A, et al. Trastuzumab deruxtecan (T-DXd) for advanced breast cancer patients (ABC) regardless of HER2 status: a phase 2 study with biomarker analysis (DAISY). Cancer Res 2022; 82: PD8-02. Abstract.
- Modi S, Jacot W, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022;387:9-20.
- oncologypro.esmo.org/meeting-resources/esmo-congress-2023/trastuzumab-deruxtecan-t-dxd-versus-treatment-of-physician-s-choice-tpc-in-patients-pts-with-her2-low-unresectable-and-or-metastatic-breast-c